Абсорбция вируса что это
Адсорбция вирусов
Адсорбция
Клетки животных имеют свойство притягивать (адсорбировать) ряд вирусов, вероятно, вследствие взаимодействия ионизированных групп. Процесс проникновения точно не установлен, но, учитывая, что клетки способны захватывать мелкие капли жидкости, можно предположить, что вирусные частицы заглатываются таким же образом и попадают в пузырьки и в цитоплазму клетки. Замечено, что определенный вирус способен адсорбироваться только на ограниченном типе клеток. Например, вирус полиомиелита адсорбируется только на некоторых клетках приматов. Существуют фаги, которые адсорбируются только на определенных мутантах микроорганизмов, только на мужских (т. е. несущих половой фактор) или только на женских клетках и т. п. Таким образом, адсорбция вируса на клетке является высоко-специфическим процессом.
Каждая клетка может адсорбировать большое, но тем не менее ограниченное число вирусных частиц. Так, например, одна клетка бактерии связывает около 300 частиц бактериофага. Фактические подсчеты показали, что при этом вся поверхность клетки покрывается фагом.
Прикрепление вириона к клеточной поверхности происходит путем случайных столкновений. Но не при каждом столкновении вирион прикрепляется к клетке.
Рецепторы связывающие вирус
Клеточная поверхность также обладает особыми клеточными рецепторами — структурами, которые ответственны за связывание вируса. В некоторых случаях эти клеточные рецепторы сосредоточены в определенных морфологических образованиях. Например, некоторые фаги прикрепляются только к жгутикам клетки хозяина. Чаще вирусы прикрепляются к участкам клеточной поверхности, которые не имеют выраженных морфологических отличий от соседних участков. Вирусная частица может эффективно реагировать только с определенными, специфичными для данного вируса рецепторами клетки.
Таким образом, первой стадией взаимодействия вируса и клетки является реакция между вирусными и клеточными рецепторами. Наличие соответствующих рецепторов — один из важных факторов, определяющих возможность или невозможность для данного вируса вызвать инфекционный процесс в клетке.
Абсорбция вируса что это
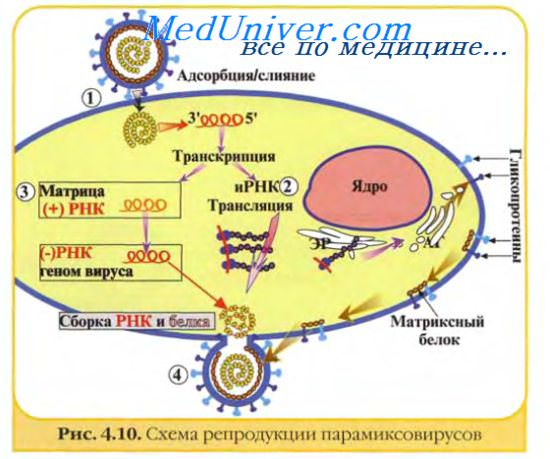
Цикл репродукции вирусов при продуктивной инфекции представляет собой специфическую последовательность событий, приводящих к образованию нового потомства вирионов. Его можно разделить на несколько стадий: адсорбция вирионов на поверхности клетки, проникновение вируса или вирусного нуклеопротеида внутрь клетки, депротеинизация генома, синтез вирусных компонентов, формирование и выход из клетки зрелых вирионов. Иногда не все стадии протекают последовательно и полностью даже при продуктивной инфекции. При заражении вирусной нуклеиновой кислотой отсутствует стадия депротеинизации. Цикл репродукции вируса может прерываться на какой-либо промежуточной стадии, и в этом случае инфекционные вирионы не образуются (абортивная инфекция).
Классическое изучение кривой роста вируса в одном цикле репродукции предполагает одновременное инфицирование клеток культуры с использованием высокой множественности заражения (М=10—100) и определение накопления вируса через определенные промежутки времени.
Детальное изучение процесса адсорбции вирусов показало, что он состоит из двух быстро следующих друг за другом периодов — обратимого и необратимого. В период обратимой адсорбции вирус можно удалить с поверхности клетки при обработке версеном, хемотрипсином и другими химическими веществами. При необратимой адсорбции вирус удалить с поверхности клетки не удается.
Первичный контакт с клеткой происходит в результате случайных столкновений вирионов с поверхностью клетки. Количество стабильных прикреплений вириона к клетке во много раз меньше количества случайных столкновений.
В основе прикрепления вируса к клетке лежат два механизма — неспецифический и специфический. Первый из них определяется силами электростатического взаимодействия, возникающими между разноименно заряженными группами, расположенными на поверхности клетки и вируса. В этом процессе, прежде всего, могут участвовать положительно заряженные аминные группы вирусного белка и отрицательно заряженные группы клеточной поверхности. В пользу электростатического взаимодействия между клеткой и вирусом свидетельствуют данные о зависимости присоединения вирионов к клеткам от ионной силы раствора и его рН, наличия в среде одно- и двухвалентных катионов и присутствия отрицательно заряженных групп на поверхности клетки.
Наиболее важным механизмом прикрепления вируса является специфическое взаимодействие рецепторов вируса с комплементарными рецепторами клетки.
Прикрепление происходит за счет связи между вирионными прикрепительными белками на поверхности вирионов и рецепторами на плазматической мембране клеток.
На поверхности вирионов многих семейств вирусов (все РНК-содержащие оболочечные вирусы и аденовирусы) имеются пепломеры (выступы и шипы) длиной от 10 до 30 нм, которые принимают непосредственное участие в прикреплении вируса к клетке. Отщепление пепломеров с помощью протеолитических ферментов приводит к потере вирионами способности адсорбироваться на клетках. На поверхности вирионов, не имеющих пепломеров, находятся участки связывания с клеточной поверхностью, которые отличаются сложным строением и, вероятно, состоят из нескольких полипептидов.
Спектр чувствительности клеток к вирусам в значительной мере определяется наличием соответствующих рецепторов. Рецепторный барьер может быть преодолен при заражении инфекционной нуклеиновой кислотой.
На поверхности клетки может находиться большое количество различных видов рецепторов. Полагают, что каждая клетка может адсорбировать от десятков до нескольких тысяч вирионов. На поверхности одной клетки находится около 10000 рецепторов для полиовируса. Каждый рецептор специфичен для одного или нескольких вирусов, как родственных между собой, так и относящихся к различным таксономическим группам. Например, аденовирус типа 2 и вирус Коксаки ВЗ связываются с одними и теми же клеточными рецепторами.
У герпесвирусов прикрепительными белками могут служить гликопротеины оболочки, которые соединяются с некоторыми рецепторами клетки. Клеточным рецептором для многих ортомиксовирусов являются концевые сиаловые кислоты олигосахаридов, входящих в структуру гликопротеринов или гликолипидов, экспонированных на поверхности клетки. Рецепторами для многих риновирусов являются иммуноглобулины. У вируса ВИЧ в прикреплении первоначально участвуют молекулы СД4, расположенные на поверхности клеток, особенно макрофагов и Т-хелперных лимфоцитов. Подобные взаимодействия рецептор-лиганд свойственны другим лентивирусным инфекциям.
Рецепторы для одних вирусов имеются на клетках нескольких или многих тканей, тогда как для других вирусов они обнаружены на клетках одного вида тканей или в один из периодов онтогенеза (новорожденные или взрослые животные).
Рецепторы клеток способны к регенерации после удаления их протеолитическими ферментами.
Что мы знаем о вирусах и методах защиты от них?
Что такое вирус?
Как устроен вирус?
В центре агента находится генетический материал РНК или ДНК, вокруг которого располагается белковая структура — капсид.
Капсид служит для защиты вируса и помогает при захвате клетки. Некоторые вирусы дополнительно покрыты липидной оболочкой, т.е. жировой структурой, которая защищает их от изменений окружающей среды.
Вирусолог Дэвид Балтимор объединил все вирусы в 8 групп, из которых некоторые группы вирусов содержат 1-2 цепочки ДНК. Другие же содержат 1 цепочку РНК, которая может удваиваться или достраивать на своей матрице ДНК. При этом каждая группа вирусов производит себя в различных органеллах зараженной клетки.
Вирусы имеют определенный диапазон хозяев, т.е. он может быть опасен для одних видов и абсолютно безвреден для других. Например, оспой болеет только человек, а чумкой только некоторые виды плотоядных. Вирус не способен выжить сам по себе, поэтому активируется только в хозяйской клетке, используя ее ресурсы и питательные вещества. Цель вируса — создание множества копий себя, чтобы инфицировать другие клетки!
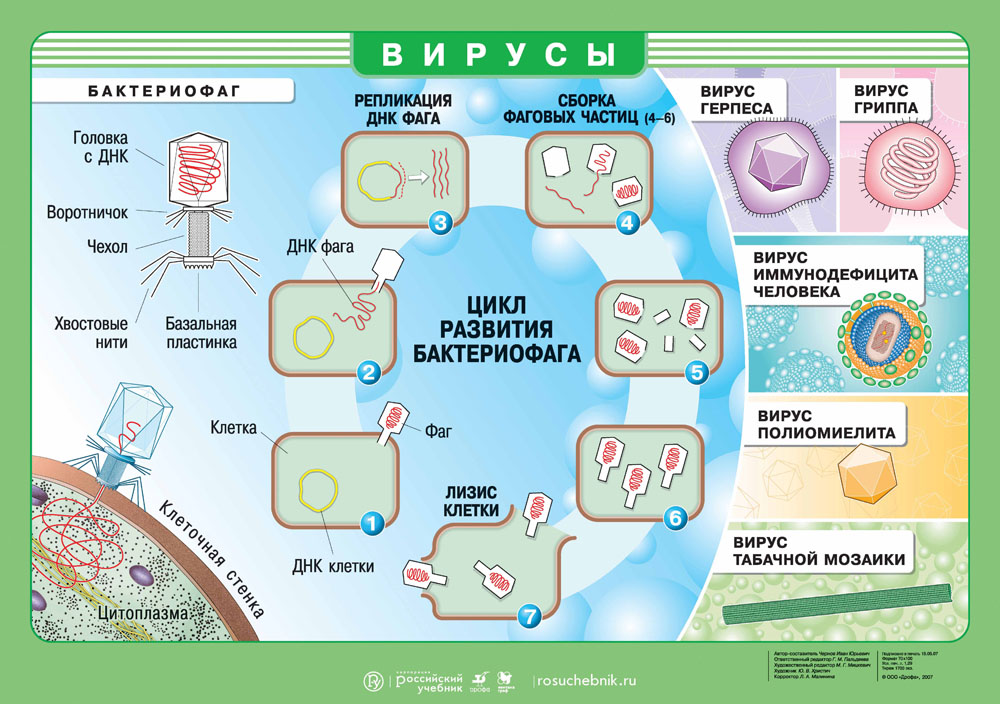
Вирусы. Цикл развития бактериофага. Скачать наглядное пособие в большом разрешении можно здесь.
Как вирус попадает в организм?
Геном вируса встраивается в одну из органелл или цитоплазму и превращает клетку в настоящий вирусный завод. Естественные процессы в клетке нарушаются, и она начинает заниматься производством и сбором белка вируса. Этот процесс называется репликацией. И его основная цель — это захват территории. Во время репликации генетический материал вируса смешивается с генами клетки хозяина — это приводит к активной мутации самого вируса, а также повышает его выживаемость. Когда процесс репликации налажен, вирусная частица отпочковывается и заражает уже новые клетки, в то время как инфицированная ранее клетка продолжает производство.
«Для проникновения в клетку белки поверхности вируса связываются со специфическими поверхностными белками клетки. Прикрепление, или адсорбция, происходит между вирусной частицей и клеточной мембраной. В мембране образуется дырка, и вирусная частица или только генетический материал попадают внутрь клетки, где будет происходить размножение вируса. Сегодня ученые всего мира сделали важное открытие о том, что заражение коронавирусом людей преклонного возраста объясняется тем, что у пожилых людей накапливается специфический белок, который помогает COVID-19 проникать внутрь клетки эпителия».
Выход вируса
Скорость распространения вирусной инфекции
Вирусная латентность
Как вирус распространяется?
Почему с вирусами так тяжело бороться?
Сегодня людям уже удалось победить некоторые вирусы, а некоторые взять под жесткий контроль. Например, Оспа (она же черная оспа). Болезнь вызывается вирусом натуральной оспы, передается от человека к человеку воздушно-капельным путем. Больные покрываются сыпью, переходящей в язвы, как на коже, так и на слизистых внутренних органов. Смертность, в зависимости от штамма вируса, составляет от 10 до 40 (иногда даже 70%), На сегодняшний день вирус полностью истреблен человечеством.
Кроме того, взяты под контроль такие заболевания, как бешенство, корь и полиомиелит. Но помимо этих вирусов существует масса других, которые требуют разработок или открытия новых вакцин.
Коронавирус
К наиболее распространенным симптомам COVID-19 относятся повышение температуры тела, сухой кашель и утомляемость. К более редким симптомам относятся боли в суставах и мышцах, заложенность носа, головная боль, конъюнктивит, боль в горле, диарея, потеря вкусовых ощущений или обоняния, сыпь и изменение цвета кожи на пальцах рук и ног. Как правило, эти симптомы развиваются постепенно и носят слабо выраженный характер. У некоторых инфицированных лиц болезнь сопровождается очень легкими симптомами.
Поскольку пока не изобретено вакцины от COVID-19, в целях защиты от инфекции самым важным для нас является соблюдение гигиены.
Гигиена — раздел медицины, изучающий влияние жизни и труда на здоровье человека и разрабатывающая меры (санитарные нормы и правила), направленные на предупреждение заболеваний, обеспечение оптимальных условий существования, укрепление здоровья и продление жизни.
Сегодня следует соблюдать определенные правила гигиены:
«Мы пытались рассказать Вам не только о существующих научных фактах о вирусах, но и показать, что определенные знания помогают нам в нынешней практической ситуации сохранить свое здоровье и здоровье своих близких. Мы понимаем, что сегодня коронавирус может находиться практически везде: на поверхностях любых предметов, в окружающей среде и т.д. Поэтому самоизоляция – это один из важнейших способов защиты от инфекции. Находясь дома, вы защищаете не только свое здоровье, но и помогаете медикам и ученым, которые сражаются с этим вирусов и день и ночь. Ведь, чем меньше шансов у нас с вами заболеть, тем больше шансов появляется у них, чтобы победить коронавирус. Пожалуйста, оставайтесь дома и соблюдайте режим самоизоляции и нормы гигиены».
ГЕМАДСОРБЦИЯ
ГЕМАДСОРБЦИЯ (греч. haima кровь + адсорбция) — способность клеток, зараженных нек-рыми вирусами (гл. обр. гемагглютинирующими), фиксировать на своей поверхности эритроциты.
Разработанные на основе этого явления реакция Г. и реакция торможения Г. служат для обнаружения, титрования и идентификации ряда вирусов, а также для выявления соответствующих антител в сыворотках.
Г. с целью обнаружения вирусов в исследуемом материале от больных чаще всего используют при диагностике оспы и парагриппозных заболеваний.
Г. впервые описали Фогель и Щелоков (J. Е. Vogel, A. Shelokov) в 1957 г. Они обнаружили адсорбцию эритроцитов морской свинки однослойными культурами почечных клеток обезьян, зараженными вирусом гриппа.
Достоинство реакций Г. и торможения Г. заключается в более раннем появлении у зараженных клеточных культур способности к Г. по сравнению с развитием выраженного цитопатического эффекта, а также в возможности выявления некоторых вирусов, размножение которых в культурах вызывает слабо выраженные и нерегулярные цитопатические изменения (напр., парагриппозных вирусов).
Способность к Г. обнаружена у различных вирусов, принадлежащих к разным классификационным группам (табл.). Большинство из них способно вызывать гемагглютинацию (см.), т. е. соединяться с эритроцитами и вызывать их склеивание. Способность этих вирусов к Г. также обусловлена их гемагглютинирующей активностью и, вероятно, вызывается вирусными частицами, еще не полностью освободившимися из клетки и расположенными у ее поверхности. Механизм соединения клеток с эритроцитами такой же, как при гемагглютинации, т. е. вирионы вступают в контакт с рецепторами эритроцитов.
ВИРУСЫ, ВЫЗЫВАЮЩИЕ ГЕМАДСОРБЦИЮ, И УСЛОВИЯ ЕЕ ВЫЯВЛЕНИЯ
Классификационная группа (род вирусов)
Выявление гемадсорбирующей активности вирусов
на культурах клеток
Африканской чумы свиней
Лейкоциты и костный мозг свиней
Инфекционного бронхита птиц
Почки эмбрионов кур
Почки обезьян и плода человека
Морских свинок, кур, человека
Почки поросят, телят, обезьян, хомячков, мышей, плода человека
Морских свинок, кур, человека
Почки обезьян, кожно-мышечная ткань эмбриона человека, амнион человека
Почки обезьян и плода человека
Парагриппа-2 обезьян (SV5, SV41)
Парагриппа-3 крупного рогатого скота
Почки телят, кроликов, собак, обезьян, цыплят
Морских свинок, кроликов, овец, крупного рогатого скота
Почки обезьян, морских свинок, кожно-мышечная ткань эмбрионов кур и японских перепелов
Кожно-мышечная ткань эмбрионов кур и японских перепелов
Кожно-мышечная ткань эмбрионов кур
Парвовирус-1 крупного рогатого скота
Почки крупного рогатого скота
Морских свинок, собак, человека
Исключение составляют возбудители инфекционного бронхита птиц и африканской чумы свиней, поскольку выделившиеся из клеток вирионы не обладают гемагглютинирующими свойствами. У вируса бронхита птиц гемагглютинин можно обнаружить путем дезинтеграции внешней оболочки трипсином. По-видимому, способность к Г. у зараженных этим вирусом клеток связана e одной из стадий синтеза вириона. Механизм Г., к-рая наблюдается в культурах, зараженных вирусом африканской чумы свиней, также не ясен. Однако не вызывает сомнения, что это явление связано с репродукцией вируса, поскольку эритроциты адсорбируются только на пораженных вирусом клетках, где развиваются специфические изменения и формируются включения.
Для выявления Г. в культурах, зараженных гемагглютинирующими вирусами, используют тот вид эритроцитов, который агглютинируется данным вирусом.. Однако спектр чувствительных эритроцитов, способных адсорбироваться на зараженных клетках, шире, чем чувствительных к агглютинирующему действию тех же вирусов. Подобное явление было выявлено, напр., в опытах с вирусами краснухи и осповакцины.
В пробирки с клеточным монослоем, зараженным вирусом, после удаления или без удаления питательной среды вносят 0,4—1% взвесь эритроцитов в объеме 0,2—0,5 мл. Пробиркам придают наклонное положение, чтобы взвесь эритроцитов покрывала клеточный слой, и выдерживают в течение определенного времени при t° 4° или 20—25°. Затем неадсорбированные эритроциты отделяют от поверхности клеток отмыванием культуры р-ром Ханкса или путем непродолжительного покачивания (или вращения) пробирок. Наличие Г. определяют при малом увеличении микроскопа.
Г. бывает островной и диффузной. Островной тип Г. наблюдается в культурах, зараженных, напр., вирусами гриппа, паротита, оспы. При этом эритроциты фиксируются на ограниченных участках культуры, соответствующих одной или нескольким клеткам. Парагриппозные вирусы вызывают диффузную адсорбцию эритроцитов на всем клеточном пласте.
Для обнаружения парагриппозных вирусов человека с целью диагностики заражают культуры почечных клеток обезьян или 12—30-недельного плода человека. Цитопатический эффект при этом появляется поздно или может вообще отсутствовать. Обычно реакцию Г. проводят на 4—5-й день культивирования с эритроцитами морской свинки.
При отсутствии Г. культивирование клеток продолжают до 20 дней и реакцию повторяют каждые 2—5 дней с полной или частичной сменой среды.
При диагностике оспы к Г. прибегают, если в зараженных исследуемым материалом культурах кожно-мышечных клеток эмбриона человека или почечных клеток обезьян цитопатические изменения слабо выражены (обычно они появляются через 24—96 час.).
Для выявления вируса клещевого энцефалита метод Г. не нашел широкого применения ввиду частых неспецифических реакций.
Г. используют при титровании на культурах клеток парагриппозных вирусов, а также возбудителей кори и паротита. При этом эритроциты вносят однократно в конце опыта.
Минимальная доза вируса, вызывающая отчетливую Г., носит название гемадсорбирующей единицы.
Вирусы, вызывающие островковую Г., можно титровать путем подсчета числа фокусов Г., т. е. участков, состоящих из одной или нескольких продуцирующих вирус клеток. Этот метод применяется редко.
Реакция торможения гемадсорбции служит для контроля специфичности наблюдаемой Г., идентификации выделенных вирусов и титрования иммунных сывороток.
Для идентификации и титрования вирусов их смешивают с соответствующей иммунной сывороткой в равном объеме и вносят в пробирки с клеточной культурой. Через 30 мин. инкубации жидкость отсасывают и наливают питательную среду. Эритроциты вносят после окончания срока инкубации (при работе с цитопатогенными вирусами — после появления соответствующих изменений).
С той же целью можно использовать культуры клеток, предварительно инфицированные испытуемым вирусом. Через определенный срок после заражения (в опытах с парагриппозными вирусами обычно на 5-й день) питательную среду удаляют и в культуры вносят иммунную сыворотку. После 15—30-минутной инкубации в комнате в пробирки наливают взвесь эритроцитов. Учет реакции производят через 3—5 мин.
С целью титрования антител реакцию задержки Г. используют гл. обр. в опытах с парагриппозными вирусами и возбудителем паротита. Для определения количества парагриппозных антител к двукратным разведениям испытуемой сыворотки прибавляют вирус в количестве 100 гемадсорбирующих единиц. Смеси выдерживают 2 часа в комнате, после чего помещают в пробирки с клеточной культурой. Эритроциты прибавляют через 4—5 дней.
При титровании антител к вирусу паротита смеси вируса с сывороткой вносят в культуры кожно-мышечных клеток куриных эмбрионов. Через 5—6 дней среду удаляют и в пробирки помещают 1% взвесь эритроцитов курицы в объеме 0,5 мл.. Этот метод определения количества паротитных антител дает более четкие результаты, чем учет реакции по цитопатическому действию вируса или по определению наличия гемагглютинина в культуральной жидкости.
При работе с гемадсорбирующими вирусами и особенно при попытках обнаружения вирусов в изучаемом материале следует иметь в виду возможность неспецифической фиксации эритроцитов на клетках, а также контаминацию (загрязнение) культур и питательных сред посторонними вирусами, вызывающими Г. Неспецифическая спонтанная Г. нередко имеет место, напр., при использовании эритроцитов старых морских свинок. Во избежание ошибок специфичность наблюдаемой Г. должна постоянно контролироваться в опытах нейтрализации с соответствующими иммунными сыворотками.
Библиография: Лабораторная диагностика вирусных и риккетсиозных заболеваний, под ред. Э. Леннета и Н. Шмидт, пер. с англ., М., 1974; Справочник по микробиологическим и вирусологическим методам исследования, под ред. М. О. Биргера, М., 1973; S t а г k e G. u. H 1 in a k P. Grundriss der allgemeinen Viro-logie, Jena, 1974, Bibliogr.
Абсорбция вируса что это
Поиск новых биологически активных соединений растительного происхождения для лечения и профилактики иммуносупрессии, инфекционных заболеваний, онкологии и метаболических заболеваний остается активной частью фармацевтических исследований [15]. В последние годы на рынке появилось более 40 новых препаратов природного происхождения, прошедших полный путь от исследования до клинических испытаний [2]. Такое внимание исследователей к природным соединениям обусловлено в первую очередь меньшей токсичностью растительных препаратов и более широким спектром действия. Некоторые лекарственные соединения растительного происхождения обнаружили способность эффективно блокировать развитие различных вирусов, включая вирус простого герпеса, гриппа, вирус иммунодефицита человека, вирусы гепатита С и В и многие другие [4, 8, 17, 19,].
Целью данного сообщения является систематизация данных по действию различных соединений растительного происхождения, способных ингибировать репродукцию вирусов.
Основой противовирусной терапии является воздействие на вирус или его составляющие компоненты на той или иной стадии репродукции. Весь процесс репродукции вирусов может быть условно разделен на три фазы [15]. Первая фаза охватывает события, которые ведут к адсорбции и проникновению вируса в клетку, освобождению его внутренних структурных компонентов и модификации его таким образом, что он способен вызвать инфекцию. Вторая фаза репродукции связана со сложными процессами, в течение которых происходит экспрессия вирусного генома. Заключительной стадией репродукции является выход вирусного потомства из клетки путем почкования или за счет лизиса, причем в последнем случае клетка погибает [12]. Имеющийся на сегодняшний день арсенал противовирусных средств способен оказывать воздействие на любой из этапов репродукции вируса.
Адсорбция и проникновение вируса в клетку
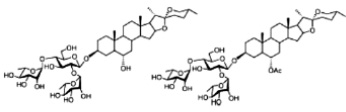
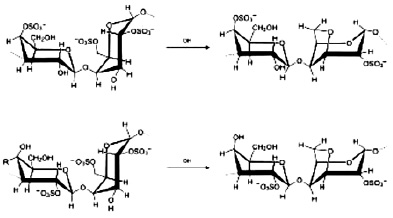
Взаимодействие вируса с клеткой начинается с процесса адсорбции, т.е. прикрепления вирусных частиц к клеточной поверхности. Этот процесс протекает при наличии соответствующих рецепторов на поверхности клетки и «узнающих» их субстанций на поверхности вируса. Прикрепление вируса к клетке происходит в два этапа, один из которых неспецифический, другой ‒ специфический. Поэтому химиотерапия этого этапа инфекции может быть также разделена на специфическую и неспецифическую. Неспецифическая стадия блокирования адсорбции вируса в первую очередь связана с электростатическими взаимодействиями между вирусом и клеткой, поэтому использование полисахаридов и некоторых пептидов, выделенных из растений и несущих большой отрицательный заряд, эффективно ингибирует адсорбцию вирусов. В подобных препаратах необходимы, как минимум, две сульфатные группы на один моносахарид. При этом противовирусная активность возрастает с возрастанием молекулярной массы в интервале от 1 до 10 kD. При меньших, а также больших массах полисахаридов противовирусная активность резко снижена. Не менее интересной группой химических соединений, подавляющих адсорбцию вирусов, можно назвать тритерпеновые сапонины, которые в силу своих структурных особенностей, связываясь с холестерином мембраны, способны изменять пространственную структуру мембраны клетки [13]. Установлено, что наличие у подобных препаратов трех сахарных остатков 3-O-β-хакотриозила увеличивает противовирусную активность соединений. Другой группой препаратов, блокирующих репликацию вирусов, являются полифенольные соединения, не только изменяющие заряд поверхности клетки, но и препятствующие специфической сорбции вируса на рецепторы (рис. 1).
Рис. 1. Соединения, блокирующие стадию адсорбции вируса [4, 8, 13]
Освобождение внутреннего компонента вируса
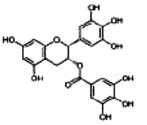
После проникновения вириона в клетку происходит целый комплекс превращений вируса, смысл которых заключается в удалении вирусных защитных оболочек, препятствующих экспрессии вирусного генома. Этот процесс сопровождается рядом характерных особенностей: исчезает инфекционность вируса, появляется чувствительность к нуклеазам, возникает устойчивость к нейтрализующему действию антител. Основной группой растительных соединений, способных подавлять репродукцию вирусов на этой стадии, являются аналоги силимарина, лютеолина и кверцетина (рис. 2) [4, 20, 21].
Рис. 2. Соединения, блокирующие освобождение внутреннего компонента вируса
Экспрессия вирусного генома и сборка вирусных частиц
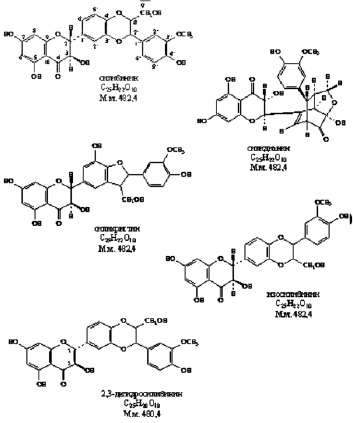
Экспрессия вирусного генома и сборка вирионов являются самыми сложными этапами, включающими транскрипцию нуклеиновых кислот, трансляцию белков, посттрансляционные модификации вирусных белков, репликацию нуклеиновых кислот, сборку вирусных частиц. Этот этап репродукции вирусов успешно блокируется 2 основными группами растительных соединений: ингибиторами РНК полимераз и ингибиторами посттрансляционных модификаций белков. К таким препаратам относятся алпизарин, госсипол, эпиген и др (рис. 3).
Механизм действия подобных препаратов связан с образованием ацил-ферментных производных и основан на блокировании одной из трех основных областей, критичных для активности аспарагиновой протеазы вируса: каталитическое ядро фермента, содержащее пару Asp-Thr/Ser-Gly триад, мобильная flap-область и домен димеризации на N- и С-концах протеазы [1, 10, 14].
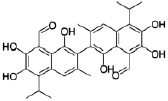
Рис. 3. Соединения, блокирующие экспрессию вирусного генома
Выход вирусного потомства
Завершающим этапом репродукции вируса является выход вирионов из инфицированной клетки. Этот процесс может протекать с помощью почкования вируса и лизиса клетки. Лизис клетки, как правило, сопровождается гибелью клетки. Блокировать такой механизм выхода вируса практически невозможно.
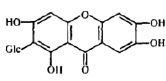
Выход из клетки путем почкования осуществляют вирусы с липопротеиновой оболочкой. При этом способе клетка может длительное время сохранять жизнеспособность и продуцировать вирусное потомство, пока не произойдет полное истощение ее ресурсов. Одним из механизмов блокирования этого этапа репродукции вируса является использование ингибиторов ферментативной активности вируса, участвующей в почковании вируса. Разработка препаратов группы ингибиторов фермента вируса гриппа – нейраминидазы (NA) ‒ является успешным достижением современной вирусологической науки последних лет – так называемого «рационального лекарственного дизайна», поскольку при синтезе данного препарата были использованы современные знания третичной структуры NA как антигена и фермента [3, 6].
Препараты с антинейраминидазным действием «имитируют» структуру натуральных субстратов каталитического сайта NA (рис. 4), что «привлекает» вирус к большему взаимодействию с ними [5, 18]. К подобным соединениям относятся коричные и оксикоричные кислоты, галлаты и др.
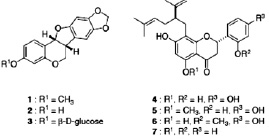
Рис. 4. Структура ингибиторов нейраминидазы [7, 9, 16]
На сегодняшний день практическая медицина обладает достаточно внушительным арсеналом противовирусных средств, способных подавлять репродукцию вируса на любой стадии процесса. Однако, несмотря на определенные успехи, достигнутые в вирусной химиотерапии, клиническая практика сталкивается с серьезной проблемой появления вариантов вируса, устойчивых к тем или иным препаратам.
Изучение растительных препаратов, обладающих антивирусными свойствами (алпизарин, эпиген, протефлазид, госсипол), показало, что за счет разных механизмов действия препаратов (противовирусное и иммуностимулирующее) появление вирусов, устойчивых к данным препаратам, не наблюдается. Большое разнообразие биологически активных соединений, находящихся в растениях, позволяет рассчитывать на возможность получения новых высокоактивных препаратов, обладающих способностью блокировать различные вирусы, в том числе, резистентные к существующим коммерческим химиопрепаратам. Подобные препараты, сочетающие в себе свойства иммуностимулирующих и противовирусных соединений, можно рекомендовать для лечения и профилактики инфекционных заболеваний, ассоциированных с иммунодефицитным состоянием, в том числе таких, как грипп, ВИЧ, гепатит С и др. [11, 17].
Рецензенты:
Саятов М.Х., д.б.н., академик НАН РК, профессор, главный научный сотрудник, РГП «Институт микробиологии и вирусологии» КН МОН РК, г. Алматы;
Жуматов К.Х., д.б.н., профессор, главный научный сотрудник, РГП «Институт микробиологии и вирусологии» КН МОН РК, г. Алматы.