Агенезия гонад что это
Агенезия гонад что это
Этиологические факторы первичной аменореи достаточно разнообразны. Как было сказано выше, к четырем основным причинам первичной аменореи относятся следующие:
• дисгенезия гонад (почти половина всех случаев);
• мюллерова агенезия (например, врожденное отсутствие матки и влагалища);
• гипоталамические расстройства, в том числе связанные с избыточной физической нагрузкой и нарушениями питания;
• конституциональная задержка полового созревания. К другим, более редким причинам первичной аменореи относятся анатомические особенности (неперфорированная девственная плева или поперечная перегородка влагалища), синдром тестикулярной феминизации, а также врожденные дефекты синтеза гонадотропинов или врожденная резистентность яичников к гонадотропинам. Некоторые из перечисленных нарушений рассмотрены в данной статье.
Дисгенезия гонад как причина первичной аменореи
Термин «дисгенезия гонад» в общем используют для описания всех форм нарушения развития гонад у пациентов с нормальным кариотипом (46ХХ; 46XY), а также ряда аномальных или мозаичных нарушений, наиболее частое из которых — синдром Тернера (45X0). Гонады в таких случаях представляют собой функционирующие фиброзные тяжи.
Чистая форма дисгенезии гонад. Для чистой формы дисгенезии гонад характерны: женский фенотип, наличие гонад в виде фиброзных тканей, наружные половые органы, развитые по женскому типу, нормально развитые мюллеровы структуры и кариотип 46XY (синдром Суайра) или 46ХХ. Это гетерогенное состояние может быть результатом структурных нарушений в Y-хромосоме, мутации гена SRY (мутации в участке Y-хромосомы, при которой происходит нарушение половой дифференцировки у мальчиков) или мутации аутосомного гена.
Смешанная дисгенезия гонад. Смешанная дисгенезия гонад развивается вследствие хромосомного мозаицизма. В кариотипе у таких больных отмечают частичную моносомию по половым хромосомам с отсутствием или аномалией второй половой хромосомы, причем кариотип чаще всего 45X0/46XY.
Фенотипически это могут быть и женщины, и мужчины, и псевдогермафродиты — в зависимости от отношения доли клеток с кариотипом 45X0 к клеткам с нормальным (46ХХ или 46XY) кариотипом в каждой из гонад. У этих пациентов обнаруживают нарушение половой дифференцировки.
Возможны варианты наличия фиброзированной половой железы с одной стороны и недостаточно развитой или нормальной — с другой в сочетании с ипсилатеральным развитием вольфова протока или мюллеровых структур. Большинство таких пациентов имеют низкий рост, а у одной трети выявляют признаки синдрома Тернера.
У большинства пациенток с дисгенезией гонад никогда не бывает менструаций. Эта группа больных составляет около 40% всех случаев первичной аменореи, и у 40% из них обнаруживают аномалии кариотипа. При нарушениях кариотипа синдром Тернера (46,Х0) диагностируют в 50% случаев, мозаичный кариотип X0/XY — в 25%.
Больных с дисгенезией гонад и нормальным кариотипом необходимо также обследовать для исключения нейросенсорной тугоухости и синдрома инактивированной Х-хромосомы. Поиск этих клинических связей особенно важен, если в семейном анамнезе есть случаи преждевременной яичниковой недостаточности (ПЯН).
Лечение дисгенезии гонад
Подростки с дисгенезией гонад нуждаются в гормональной терапии с целью стимуляции роста и своевременного полового развития. В течение первого года применяют эстрогены в низких дозах (0,25-0,3 мг/сут) иногда в сочетании с гормоном роста, чтобы индуцировать нормальное половое развитие, минимизировать эффекты раннего закрытия эпифизов костей и обеспечить нормальный рост. Приблизительно через год терапии эстрогенами подключают препараты прогестерона (например, медроксипрогестерон по 5 мг/сут или иную форму прогестерона), который используют во второй половине месяца.
Дозы эстрогенов постепенно увеличивают, чтобы за 2-3 года больные достигли половой зрелости.
Для поддерживающей терапии используют 2 мг/сут эстрадиола или 1,25 мг/сут конъюгированных эстрогенов. Если назначено лечение гормоном роста, эстрогены можно назначить раньше. Если же гормон роста не используется, начало лечения эстрогенами может быть отсрочено до 14-15 лет, но не позже. Применение этинилэстрадиола повышает риск артериальной гипертензии у больных с синдромом Тернера. Больным с Y-хромосомой с целью предотвращения малигнизации показана гонадэктомия.
Благодаря возможности использования донорской яйцеклетки у больных может наступать беременность. Однако повышенные требования, которые беременность предъявляет к сердечно-сосудистой системе (с учетом того, что распространенность ее аномалий у этих больных достигает 25-50%), становятся у таких больных существенным фактором риска. В докладе ASRM говорится, что риск развития расслаивающей аневризмы аорты и ее разрыва составляет 2% и выше, а риск смерти во время беременности повышается в 100 раз.
Выявление любых тяжелых аномалий сердечно-сосудистой системы необходимо рассматривать как противопоказание для донации ооцитов. Даже при отсутствии подобных аномалий сохраняется риск расслаивающей аневризмы аорты во время беременности.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Болезни эндокринной систем
Причины
В основе развития аномалий гонадной дифференцировки лежат количественные или качественные аномалии половых хромосом, приводящие к нарушению формирования первичной половой закладки в полноценный тестикул или яичник. Этот процесс осуществляется на 6—10-й неделе внутриутробного развития и требует полноценного набора половых хромосом (XX у девочек и XY у мальчиков).
«Чистая» агенезия гонад (кариотип XX) характеризуется женским строением наружных и внутренних половых органов. Гонады представлены в виде соединительнотканных тяжей (стреков). Предполагаемой причиной заболевания является мутация аутосомного или Х-сцеплен-ного гена, необходимого для нормальной дифференцировки и функционирования яичника. В пубертатном периоде не развиваются молочные железы, имеется первичная аменорея. Гормональные показатели характерны для первичных, гонадных форм гипогонадизма: высокое содержание ЛГ, ФСГ, низкий уровень эстрадиола. Заболевание часто сочетается с неврологическими нарушениями: глухонемотой, церебральной таксией.
«Чистая» агенезия гонад (кариотип XY) характеризуется женским строением наружных и внутренних половых органов, наличием гонад в виде стреков (фиброзных тяжей), половым инфантилизмом в пубертатном возрасте. Иногда отмечается слабая вирилизация наружных гениталий в виде гипертрофированного клитора. Причина заболевания связана с делецией короткого плеча Y-хромосомы, содержащего ген SRY. Предполагаются также аутосомные мутации, нарушающие процесс половой дифференцировки. Заболевание часто сочетается с неврологическими и почечными врожденными аномалиями. Имеется высокий риск развития гонадобластомы в пубертатном возрасте.
Симптомы
Заболевание является одной из самых частых причин гипогонадиз-ма у девочек. В период новорожденное характерны снижение роста и массы тела при нормальных сроках гестации, лимфоидный отек голеней и стоп. Заболевание, обусловленное моносомией по Х-хромо-соме и кольцевой Х-хромосомой, характеризуется выраженными внешними стигмами дизэмбриогенеза: укороченной шеей, крыловидными складками шеи, эпикантусом, «готическим нёбом», укорочением пястных костей и др. Возможны пороки сердечно-сосудистой системы (ко-арктация аорты), почечные аномалии (нефроптоз, ротация почек). Отчетливая задержка роста у детей с синдромом Шерешевского — Тернера отмечается к 6—7 годам, прогрессируя в дальнейшем из-за отсутствия пубертатного ростового скачка; конечный рост больных обычно достигает 140—150 см. Дифференцировка костного скелета незначительно отстает от хронологического возраста ребенка. Секреция гормона роста не нарушена, однако в пубертатном периоде при отсутствии половых гормонов ответная реакция гормона роста на фармакологические стимулы может быть снижена. В период пубертата у 92% больных вторичные половые признаки полностью отсутствуют, наблюдается первичная аменорея. Вторичное оволосение развивается к 12—13 годам за счет эффектов надпочечниковых андрогенов.
Диагностика
Диагностика заболевания основана на проведении кариотипирова-ния и выявлении моносомии по Х-хромосоме или мозаичных вариантов синдрома. Учитывая высокую частоту синдрома Шерешевского — Тернера, кариотипированию подлежат все девочки, имеющие выраженную задержку роста и отсутствие вторичных половых признаков к началу пубертатного периода. Дифференциальная диагностика проводится с синдромом Ну-нана, имеющим все диагностические признаки синдрома Шерешевского — Тернера при сохраненной половой функции. Кариотип при синдроме Нунана не изменен (46ХХ). Заболевание имеет аутосомно-доминантный тип наследования, в семье есть родственники с аналогичным фенотипом.
Врожденные аномалии развития половых органов
Общая информация
Краткое описание
Врожденные пороки развития половых органов – стойкие морфологические изменения органа, выходящие за пределы вариаций их строения. Врожденные пороки развития возникают внутриутробно в результате нарушения процессов развития зародыша или (много реже) после рождения ребенка, как следствие нарушения дальнейшего формирования органов [1].
Пользователи протокола: акушеры-гинекологи, урологи, хирурги, врачи общей практики, терапевты, педиатры, неонатологи, врачи скорой помощи.
Критерии, разработанные Канадской Целевой группой Профилактического Здравоохранения (Canadian Task Forceon Preventive Health Care) для оценки доказательности рекомендаций*
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
• удвоение матки и влагалища с полной аплазией всего протока с одной стороны (однорогая матка).
• аплазия нижней трети
6. Наличие добавочных яичников
Диагностика
II. МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
• определение резус-фактора крови.
Жалобы: на отсутствие менструации, боли внизу живота в ожидаемые дни менструации, невозможность полового контакта, отсутствие беременности.
• при ректоабдоминальном исследовании в малом тазу пальпируют малоподвижное шаровидная матка, чувствительная при пальпации и попытках смещения. Шейка матки не определяется. В области придатков – образования ретортообразной формы (гематосальпинксы).
• при пальпации живота и ректоабдоминальном исследовании на расстоянии от 2 до 8 см от ануса выявляют образование тугоэластической консистенции (гематокольпос). На вершине гематокольпоса пальпируют более плотное образование (матку), которое может быть увеличено в размерах (гематометра). В области придатков определяют образования веретенообразной формы (гематосальпинксы).
• свищевое отверстие расположено выше девственной плевы.
• дефект короткого плеча Х-хромосомы.
Диагностическая лапароскопия [IА, 5,11]: визуализация аномалий развития гениталий в виде изменений формы, количества, расположения внутренних половых органов.
Дифференциальный диагноз
Таблица 2. Дифференциальная диагностика аномалий развития половых органов в зависимости от клинических признаков [8]
Органические причины нарушения полового созревания у подростков
Обобщены современные представления о физиологии полового развития. Рассмотрены основные причины органических нарушений половой дифференцировки и полового созревания, методы диагностики, подходы к лечению.
Summarizes the current understanding of the physiology of sexual development. The main causes of organic disorders of sexual differentiation and puberty, diagnostic methods, treatment approaches.
Половое созревание это процесс, который начинается в эмбриональном периоде и продолжается в период пубертата, подготавливая организм к репродуктивной функции.
Наступление пубертата контролируется всеми эндокринными железами, но ведущую роль играет гипоталамо-гипофизарная система, которая активирует выработку овариальных и тестикулярных гормонов, оказывающих свое биологическое действие практически на все ткани.
Возраст начала пубертата у детей имеет достаточно широкий диапазон. Прежде всего, он зависит от этнической принадлежности, пола, состояния здоровья, генетической предрасположенности, некоторых факторов внешней среды. Так, холодный климат ассоциирован с более поздним началом полового созревания в популяции. Для детей европейской популяции в 95% случаев пубертат наступает в возрастном интервале от 8 до 13 лет у девочек и от 9 до 14 лет у мальчиков. Половое созревание начинается с появления импульсной секреции лютеинизирующего гормона релизинг-гормона (ЛГ-РГ) в гипоталамусе, который стимулирует выработку в гипофизе фолликулостимулирующего гормона (ФСГ) и лютеинизирующего гормона (ЛГ).
Ранние стадии мужского и женского полового созревания очень похожи. Для становления пубертатной фазы характерно ночное пульсирующее увеличение выброса ЛГ-РГ. Ночной пик ЛГ у мальчиков вызывает более высокий подъем уровня тестостерона. У девочек увеличивающаяся амплитуда колебаний ЛГ стимулирует тека-клетки яичников, в которых вырабатывается тестостерон и в меньшей степени прогестерон. В зернистых клетках яичников под воздействием ФСГ, который вызывает усиление активности ароматазы, основная часть тестостерона конвертируется в эстрадиол. Максимальная концентрация эстрадиола наблюдается в дневное время, т. к. для его образования в яичниках нужен более длительный период времени.
Клинически уровень полового созревания оценивают соответственно критериям шкалы Таннера. Задержкой полового развития считается отсутствие или неполное развитие вторичных половых признаков у детей, достигших максимального возраста нормального пубертата. У мальчиков средний возраст проявления первых признаков полового созревания, а именно увеличение объема тестикул (более 4 мл), около 14 лет. В то время как у девочек развитие грудной железы, как признак начала пубертата, происходит в среднем на 1–2 года раньше [1].
Половое и подмышечное оволосение, которое обусловлено надпочениковыми андрогенами, не является признаком созревания и может встречаться у пациентов с выраженными симптомами гипогонадизма.
Задержка начала созревания может быть связана с нарушением в одном из звеньев гипоталамо-гипофизарно-гонадной цепочки. В подавляющем числе позднее начало пубертата встречается у подростков с семейной предрасположенностью к замедлению роста. В ее основе лежит функциональная незрелость нервных механизмов, которые запускают импульсную секрецию ЛГ-РГ. В этом случае препубертатная скорость роста нормальная, но скелетное созревание и подростковый скачок роста происходят позже [2].
Однако у 0,1% детей позднее начало полового созревания связано с органической патологией. Врожденные или приобретенные аномалии центральной нервной системы (ЦНС) и гипоталамо-гипофизарных структур вызывают полное или частичное нарушение способности гипоталамуса секретировать ЛГ-РГ или гипофиза — вырабатывать ЛГ и ФСГ, что приводит к развитию гипогонадотропного гипогонадизма (гипоГ). Дефект гонад, врожденного или приобретенного характера, которые неспособны к выработке достаточного количества половых гормонов, лежит в основе гипергонадотропного гипогонадизма (гиперГ). Соматические заболевания, приводящие к хронической гипоксии или нарушению белкового обмена, также имеют большое значение в развитии гипогонадизма: синдром нарушенного кишечного всасывания, не компенсированные врожденные пороки сердца, хронические заболевания печени и почек, сахарный диабет и др.
Выделяют три основные формы органического гипогонадизма: первичный, вторичный и гипогонадизм, вызванный нечувствительностью рецепторов к гормонам [3].
Первичный гипогонадизм
Первичный, или гипергонадотропный, гипогонадизм встречается при нарушениях синтеза стероидных гормонов половыми железами. По принципу обратной связи дефицит половых гормонов стимулирует выработку в гипофизе ФСГ и ЛГ. Органические формы гипергонадотропного гипогонадизма чаще связаны с врожденными хромосомными и генетическими аномалиями. Редко встречаются формы гиперГ с отсутствием гонад, но с нормальным хромосомным набором.
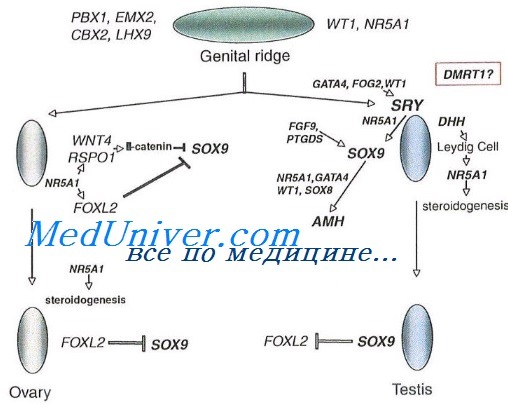
Процесс гонадной и генитальной дифференцировки происходит в период раннего эмбриогенеза. Развитие половых желез обусловлено набором половых хромосом (ХХ и ХУ), определяющих генетический пол. Они инициируют трансформацию первичной биопотенциальной гонады в тестикул или яичник, что в конечном счете формирует гонадный пол.
Для нормального формирования мужского фенотипа необходима интактная У-хромосома с локализацией на ней гена SRY (sex-determining on Y chromosome), а также нормальная функция Х-хромосомы с наличием на ней гена, ответственного за рецепторы к андрогенам.
Для последующей дифференциации органов по мужскому типу необходима достаточная секреция тестостерона клетками Лейдига и выработка антимюллерова гормона (АМГ) клетками Сертоли, а также наличие в клетках-мишенях фермента a-редуктазы.
Тестостерон требуется для развития вольфовых протоков, что приводит к образованию из них придатка яичка, семявыносящих протоков и семенных пузырьков. Активность АМГ вызывает регресс мюллеровых протоков. Под воздействием интратестикулярного тестостерона количество семенных канальцев увеличивается во внутриутробном периоде. Кроме того, тестостерон необходим для развития предстательной железы, полового члена и мошонки. В этих органах тестостерон превращается в более активный метаболит дигидротестостерон (ДГТ) под действием фермента 5-a-редуктазы. Интратестикулярный тестостерон необходим для поддержания сперматогенеза и препятствует апоптозу зародышевых клеток.
Дефект в любом звене этого механизма ведет к нарушению половой дифференцировки и развитию органов по женскому типу.
Формирование яичника из первичной гонады происходит позже, чем у плода мужского пола. Предшественники ооцитов окружаются веретенообразными клетками, которые в последующем превращаются в гранулезные клетки. Совокупность ооцита и гранулезных клеток образует примордиальный фолликул. В последующем наружный слой веретенообразных клеток видоизменяется в тека-клетки. Гранулезные и тека-клетки составляют основу стероидсекретирующих структур яичника. Гормональная активность ячников в фетальный период минимальна.
При отсутствии андрогенов в период раннего внутриутробного развития вольфовы протоки редуцируются. Из мюллерова канала формируются маточные трубы, матка и верхняя треть влагалища.
Характер и степень повреждения гонад и генитальной дифференцировки зависит от времени внутриутробного повреждения. На самом раннем этапе дифференциации пола (2–7 неделя) для эмбрионов любого пола мутация аутосомных генов приводит к дисгенезу гонад у плода.
На 7–10 неделе из первичной биопотенциональной гонады формируется тестикул или яичник, что определяется влиянием генов, находящихся на половых хромосомах. Отсутствие гена SRY у детей с нормальным мужским кариотипом приводит к дисгенезии тестикул. Наличие гена SRY у детей с нормальным женским кариотипом приводит к формированию первичной гонады в тестикул (ХХ-мужчины).
Дифференцировка внутренних и наружных гениталий (фенотипический пол) происходит на 9–14 неделе. У плода мужского пола это зависит от функциональной активности эмбриональных тестикул. В этот период формируются различные варианты ложного мужского и женского гермафродитизма. Дефект секреции АМГ у мальчиков приводит к образованию у них матки и фаллопиевых труб в сочетании с бесплодием. Дефект биосинтеза тестостерона и дигидротестостерона — к феминному или бисексуальному строению наружных гениталий при нормально развитых тестикулах. У девочек экстрагонадная секреция тестостерона (ВДКН) вызывает андрогенизацию наружных гениталий при нормально сформированных яичниках. Повышенная экспрессия АМГ приводит к агенезии матки и влагалища (синдром Рокитанского).
Итак, мутация генов, контролирующих процессы половой дифференцировки, в сочетании с мутациями аутосомных генов способствует формированию различных клинических синдромов [4].
Врожденные формы
Синдром Кляйнфельтера
Это генетическое заболевание, характеризующееся дополнительной женской половой Х-хромосомой (47ХХY). Реже встречаются мозаичные формы (46ХY/47XXY). Частота данного синдрома колеблется в пределах 1 на 500–700 новорожденных мальчиков. Патология возникает в результате нарушения расхождения хромосом на ранних этапах формирования яйцеклеток и сперматозоидов. Дополнительная Х-хромосома не влияет на формирование тестикул и наружных гениталий по мужскому типу, но сперматогенез нарушен [5].
Юноши с синдромом Кляйнфельтера, как правило, выше своих сверстников, так как линейный рост продолжается дольше. Формируются евнухоидные пропорции тела: длинные конечности, высокая талия, бедра относительно шире пояса верхних конечностей, избыточное отложение жира в области сосков, живота, у гребешков подвздошных костей; мышцы дряблые, слабые, голос высокий, детский. Характерна пубертатная смешанная гинекомастия. Тестикулы небольших размеров, плотные на ощупь.
Дефицит андрогенов приводит к замедленному или неполноценному половому созреванию, а в дальнешем к бесплодию. Степень вирилизации больных варьирует, но в большинстве случаев отмечается оволосение лобка по женскому типу, а также недостаточный рост волос на лице. Возможна патология урогенитального тракта: крипторхизм, гипоспадия и микропенис.
У части больных выявляются признаки костной дисплазии: «готическое» небо, искривление нижних конечностей, деформация грудины. Со стороны сердечно-сосудистой системы обнаруживают разнообразные врожденные пороки сердца.
По сравнению со здоровыми такие подростки в будущем имеют повышенный риск рака молочной железы, системных заболеваний (красная волчанка и др.). У этих больных могут быть проблемы с обучением, трудности контакта с людьми, но индивидуальные черты личности различаются.
Специфического лечения нет. Проводится пожизненная заместительная гормональная терапия (ЗГТ) препаратами тестостерона, начиная с 13–14 лет.
Синдром Шерешевского–Тернера
Синдром Шерешевского–Тернера (СШТ) представляет собой хромосомную мутацию, которая влияет на рост и развитие девочек. Частота возникновения приблизительно 1 на 2500 новорожденных, но значительная часть приходится на неразвивающиеся беременности и мертворождение. Хромосомная аномалия определяется отсутствием одной Х-хромосомы (моносомия 45ХО) или ее дефектом (45ХО/46ХХ,45ХО/XY)
Наиболее общая черта СШТ — низкорослость, которая очевидна уже в 5-летнем возрасте. До этого возраста темпы роста относительно приемлемы. В патогенензе низкорослости имеют значение генетические нарушения, связанные с делецией гена SHOX. Низкий рост у таких пациенток сочетается с костными аномалиями: девиацией локтевых суставов, искривлением костей голеней, изменением костей позвоночника (короткая шея), укороченем IV и V пальцев рук, пятый палец нередко искривлен, недоразвитие лицевого скелета, «готическое» небо. Характерна остеопения в пубертатном возрасте.
Структурные аномалии Х-хромосомы приводят к двухсторонней дисгенезии гонад. При наличии только одной Х-хромосомы овоциты яичника подвергаются дегенерации еще до рождения. Половой инфантилизм встречается у 95–98% пациентов с СШТ. Ранняя потеря функции яичников при СШТ сопровождается высокой гипоталамо-гипофизарной реакцией. Первое время яичники развиваются нормально, но яйцеклетки (ооциты), как правило, преждевременно редуцируются и большая часть овариальной ткани дегенерирует еще до рождения. Строма яичников фиброзируется, и они превращаются в «strеak»-гонады [6]. В пубертатный период уровень ФСГ резко повышается. Однако у большинства девочек не начинается половое созревание без гормонального лечения, и они не могут забеременеть. Вторичное оволосение — лобковое и подмышечное — развивается спонтанно к 12 годам у всех девочек с СШТ под влиянием надпочечниковых андрогенов. Лишь небольшой процент девочек сохраняют нормальную функцию яичников в юношеском возрасте. Также высокий риск заболеваний щитовидной железы (хронический аутоиммунный тиреоидит, гипотиреоз, гипертиреоз) и развития сахарного диабета 2-го типа.
Около 30% девочек с СШТ имеют дополнительную кожную складку на шее (крыловидная шея), низкий уровень роста волос на задней поверхности шеи, отечность рук и ног (лимфедема), пороки почек (подковообразная, гипоплазия, удвоение мочевыводящих путей). От трети до половины пациенток рождаются с пороком сердца (коарктация аорты, дефект аортального клапана, стеноз легочной артерии и др.). Осложнения, связанные с этими пороками, потенциально опасны для жизни. Высокое артериальное давление распространено у женщин с СШТ. Это может быть связано с коарктацией аорты или заболеванием почек, хотя часто причину найти не удается.
У девочек с СШТ часто развивается хронический средний отит, особенно в раннем возрасте, что в конечном итоге может привести к снижению слуха. Такие дети должны регулярно наблюдаться ЛОР-врачом.
Большинство девушек и женщин с СШТ имеют нормальный интеллект. Но возможны задержки моторного развития и поведенческие проблемы.
Лечение включает в себя несколько направлений. Инъекции гормона роста в раннем детстве позволяют увеличить конечный рост на несколько сантиметров. Терапию эстрогенами рекомендуется назначать в возрасте 15 лет, когда костный возраст достигает максимума. Эстроген-гестагенные препараты применяются в период, когда нужно поддержать фертильность.
Синдром Нунан
Встречается с частотой 1 на 10 000–25 000 всех новорожденных. Фенотипически дети схожи с синдромом Шерешевского–Тернера, но в отличие от последнего имеют нормальный набор хромосом (46XX или 46XY). Заболевание встречается у мальчиков и у девочек [6].
Дети с синдромом Нунан имеют выраженные симптомы дисэмбриогенеза: широко расставленные бледно-голубые или сине-зеленые глаза, низко посаженные уши, высокое арочное небо, небольшую нижнюю челюсть (микрогнатия). У многих детей короткая шея с избытком кожной ткани и низкая линия роста волос на задней части шеи. Около 50–70% низкорослые. При рождении они, как правило, имеют нормальную длину тела и вес, но со временем рост замедляется (низкий уровень соматотропного гормона (СТГ)). Специфическая деформация грудной клетки по типу «куриная грудь» (pectus carinatum) или «воронкообразная грудная клетка» (pectus excavatus) сочетается со сколиозом.
Большинство пациентов имеют порок сердца — наиболее часто стеноз легочной артерии, гипертрофическую кардиомиопатию. Нарушение в свертывающей системе крови проявляются чрезмерной кровоточивостью: длительными кровотечениями после травм или операций. У женщин отмечают меноррагии и родовые кровотечения.
У мальчиков часто встречается задержка полового развития. У большинства из них выявляется крипторхизм и гипоплазия тестикул, фертильность нарушена. Девочки с синдромом Нунан обычно не имеют отставаний в половом развитии и нарушений фертильности.
Большинство детей интеллектуально развиваются нормально, однако встречаются больные с выраженным снижением мнестико-интеллектуальных функций.
Синдром Свайера при 46ХY (чистая дисгенезия)
Для больных с этим синдромом характерен женский фенотип — наружные и внутренние половые органы (матка и фаллопиевые трубы). В пубертатном возрасте отмечается недостаточное развитие вторичных половых признаков, первичная аменорея, гипергонадотропный гипогонадизм. Вместо половых желез у них имеются скопления неразвитой ткани (стрековые гонады), неспособные секретировать тестостерон и АМГ. Кариотип определяется как 46ХY. Эти аномальные половые железы часто малигнизируются, поэтому должны быть хирургически удалены в раннем детстве. Синдром встречается с частотой 1 на 30 000 новорожденных. Гонадный дисгенез вызывается мутацией гена SRY [7].
Пациенты с синдромом Свайера обычно выглядят как женщины и идентифицируют себя соответственно. ЗГТ начинают в подростковом возрасте, чтобы вызвать менструацию и развитие женских вторичных половых признаков, таких как развитие груди и оволосение. ЗГТ также помогает предотвратить остеопороз. Женщины с этим синдромом не имеют собственных яйцеклеток, но могут выносить беременность с помощью донорского эмбриона. В связи с риском перерождения стрековых гонад в злокачественную опухоль рекомендуется их удалять.
Сертолиноклеточный синдром (Дель Кастильо)
Синдром изолированной аплазии сперматогенного эпителия сравнительно редкое заболевание, характеризуется азооспермией при нормальном уровне тестостерона и ЛГ, но повышенном уровне ФСГ. Больные в физическом и половом развитии мало отличаются. Ведущим симптомом заболевания является бесплодие, кариотип нормальный (46XY), в очень редких случаях может отмечаться легкая гипоплазия яичек. При биопсии обнаруживается умеренное уменьшение извитых канальцев, отсутствие предшественников сперматозоидов и зародышевых клеток. Семенные канальцы выстланы только клетками Сертоли. Гистологическая картина напоминает ткань допубертатного тестикула. Функция клеток Лейдига не нарушена. Уровень тестостерона нормальный.
Приобретенные формы
Гипергонадотропный гипогонадизм развивается у больных в результате хирургической операции (опухоль, острый некроз тестикул), воспаления (при вирусном, туберкулезном паротите), телегамма- и химиотерапии. Длительное наблюдение за детьми с различными эндокринопатиями позволило выявить гонадную недостаточность у 42% у них.
Вторичный (центральный, гипогонадотропный) гипогонадизм
ГипоГ формируется в случае нарушения способности секреции гипоталамусом ЛГ-РГ или аденогипофизом — ЛГ и ФСГ. Результатом дефицита гонадотропинов является резкое снижение биосинтеза половых стероидов в тестикулах или в яичниках. Причиной гипоГ может быть врожденная и приобретенная патология гипоталамуса и гипофиза. В подавляющем числе случаев эта форма гипогонадизма диагностируется у юношей. У девушек это проявляется, прежде всего, первичной аменореей, которая может иметь множество других причин, в том числе при anorexia nervosa, травмах и опухолях ЦНС.
В норме ЛГ-РГ секретируется нейронами гипоталамуса. Выделение нейронами этого гормона носит импульсный характер. Последнее является необходимым условием для нормального функционирования гонадотропных клеток гипофиза. ЛГ в мужском организме стимулирует синтез андрогенов (С-19-стероидов), а ФСГ регулирует сперматогенез в тестикулах. В женском организме ЛГ также поддерживает биосинтез андрогенов, ФСГ стимулирует ароматизацию (ферментативная реакция), превращая андрогены в эстрогены. Синтез гормонов осуществляется под контролем различных генов, мутация которых может сопровождаться гипогонадизмом [8].
Клинически гипоГ проявляется симптомами дефицита андрогенов и отсутствием или задержкой полового созревания.
Врожденные формы
Большое количество пациентов с данной патологией свидетельствует о еще не известных мутациях в генах. Исследования в этом направлении привели к открытию нескольких генов, которые необходимы для развития и правильного функционирования ГЛ-РГ-зависимых нейронов гипоталамуса, дисфункция которых может привести к гипоГ без выпадения обоняния и с выпадением, как при синдроме Кальмана.
У отдельных мутаций разная пенетрантность и экспрессивность. Есть два биологических пути, которые могут привести к гипоГ. Первый берет начало в эмбриологии. ЛГ-РГ-секретирующие нейроны мигрируют из обонятельной луковицы к гипоталамусу во время эмбриогенеза. Мутации, которые мешают этой миграции, приводят к гипогонадизму с выпадением обоняния, т. е. к синдрому Кальмана. Второй путь предполагает наличие мутаций, которые вызывают аномальную низкую активность ЛГ-РГ-секретирующих нейронов, прошедших нормальный путь миграции. Соответственно, развивается гипогонадизм без нарушений со стороны обоняния. Заболеваемость врожденным гипоГ встречается с частотой 1–10:100 000 живорожденных, две трети случаев приходится на синдром Кальмана, остальные это идиопатические формы.
Синдром Кальмана
Характеризуется задержкой или отсутствием полового созревания в сочетании с нарушением обоняния [8]. По разным оценкам встречается у 1 на 10 000–86 000 новорожденных, чаще у мальчиков. Исследователи выделяют четыре формы синдрома Кальмана (4-го типа), которые отличаются своей генетической природой. Наиболее распространенной формой является синдром Кальмана 1-го типа. Гипогонадизм при этом синдроме связан с дефицитом ЛГ-РГ. Дефект секреции гонадолиберина приводит к отсутствию или выраженному дефициту ЛГ.
У новорожденных часто выявляют микропенис и крипторхизм. В период полового созревания у юношей не развиваются вторичные половые признаки, такие как рост волос на лице и теле, изменение тембра голоса. Девушки не менструируют, молочные железы формируются плохо или не развиваются вовсе. Больные высокого роста с евнухоидными пропорциями тела.
При синдроме Кальмана обоняние либо уменьшается (гипосмия) или полностью отсутствует (аносмия). Этот специфический признак отличает синдром Кальмана от других форм гипоГ, которые не влияют на обоняние. Нужно учитывать, что часто люди не подозревают о дефекте обоняния, пока это не обнаружится специальными тестами. Обонятельные нейроны, так и нейроны, секретирующие ЛГ-РГ, в период эмбриогенеза совместно формируются, а затем мигрируют в разные отделы мозга. При этом синдроме формирование обоих нейронов происходит нормально, а миграция нарушена.
Клинические симптомы синдрома варьируются даже среди одной семьи: односторонняя почечная агенезия, «заячья губа» и «волчья пасть», «готическое» небо, хаотичные движения глазных яблок, потеря слуха и аномалии развития зубов. У некоторых пациентов диагностируют бимануальную синкенезию, при которой движения одной стороны зеркально повторяются другой. Бимануальная синкенезия сильно затрудняет выполнение задач. требующих действий только одной рукой (игра на музыкальном инструменте).
Лечение заключается в длительном введении гонадотропинов. При резкой гипоплазии яичек наряду с хориогонином применяют препараты тестостерона. В дальнейшем возможно лечение только ХГЧ.
Синдром Паскуалини (синдром плодовитых евнухов)
Редкое заболевание, связанное с врожденной изолированной недостаточностью ЛГ и тестостерона. Содержание ФСГ в пределах нормы, сперматогенез активный. Некоторые авторы выявили у этой группы больных частичный дефицит ЛГ-РГ. Этого количества гормона достаточно, чтобы местно стимулировать клетки Лейдига для выработки тестостерона, необходимого для сперматогенеза и увеличения тестикул.
В пубертатном возрасте такие больные высокорослы, имеют евнухоидные пропорции тела, скудное оволосение на лице, подмышечных впадинах, лобке. Тестикулы нормальных размеров. Сперматогенез не нарушен [9, 10].
Септооптическая дисплазия (мутация гена HESX1, синдром Morsier)
Мутация гена HESX1 ассоциирована с септооптической дисплазией, синдромом врожденного гипопитуитаризма, гипоплазией зрительного нерва и агенезом срединных структур головного мозга. Ген HESX1 кодирует белок, который играет важную роль в раннем развитии мозга [5, 11]. Описано четыре мутации этого гена. Заболевание встречается с частотой 1 на 10 000 новорожденных. Признаки и симптомы данного синдрома варьируют, но существуют три характерные черты: гипоплазия зрительного нерва, нарушение формирование структур вдоль средней линии мозга и гипоплазия гипофиза.
Гипоплазия зрительного нерва вызывает нарушение зрения в одном или обоих глазах. Клинические симптомы в виде косоглазия, нистагма, снижения остроты зрения, а при исследовании глазного дна — атрофии зрительного нерва выявляются уже на первом году жизни. Вследствие задержки визуального развития у младенцев, которые кажутся слепыми, зрение может улучшиться в течение первых нескольких месяцев жизни. У детей с односторонней или ассиметричной двусторонней гипоплазией зрительного нерва снижение зрения стойкое и необратимое.
Характерной чертой дисплазии является неправильное развитие срединных структур мозга (мозолистого тела), разделяющих правое и левое полушарие. Следствием аномалии развития мозга является снижение интеллекта.
Недоразвитие гипофиза приводит к дефициту тропных гормонов, необходимых для нормального роста, полового развития и других важных функций. С возрастом нарастает отставание в физическом развитии и низкорослость. В пубертатном периоде развивается гипоГ. В тяжелых случаях пангипопитуитаризма, когда гипофиз не производит никаких гормонов, в крови наблюдается постоянная гипогликемия.
Симптомы септико-оптической дисплазии могут существенно различаться. Некоторые исследователи предполагают, что они проявляются группой связанных синдромов, а не каким-то одним. Около трети людей с диагнозом дисплазии сочетают все три группы симптомов, у большинства две главные особенности. В редких случаях синдром Morsier ассоциирован с повторными эпилептическими припадками, задержкой развития и нарушением координации.
Дети с пангипопитуитаризмом должны получать соответствующую ЗГТ.
Генетические дефекты формирования аденогипофиза
Более десятка генных мутаций могут вызвать гипоплазию гипофиза, у большинства из них не наблюдается дисплазии зрительных нервов (KAL, GNRHR, PIT1, PROP1). Наиболее изученными являются гены PIT1 и PROP [12]. Мутации этих генов вызывает дефицит тиреотропного гормона (ТТГ), пролактина (ПРЛ), соматотропного гормона (СТГ), ЛГ и ФСГ, который может быть тотальный или парциальный. В детском возрасте чаще встречаются симптомы, связанные с дефицитом СТГ и ТТГ. В период созревания диагностируется отставание в половом развитии.
Мутация гена DAX1, ассоциированная с врожденной гипоплазией надпочечников и гипогонадотропным гипогонадизмом
Мутации в гене DAX1 вызывает Х-хромосомную врожденную надпочечниковую гипоплазию и гипопогонадотропный гипогонадизм. Ген DАX1 кодирует белок, который комплексируется с ядерным ДНК в гипоталамусе и гипофизе [13]. Роль DAX1 и других неопределенных аутосомно-рецессивных генов в развитии коры надпочечников пока не совсем ясна. DAX1 представляется необходимым для окончательной дифференцировки коры надпочечников у взрослых, но не у плода, поскольку последняя сохраняется у пациентов с делецией этого гена. Врожденная гипоплазия надпочечников встречается редко. Клинический опыт показывает, что эта болезнь встречается не так часто, как врожденная гиперплазия коры надпочечников вследствие дефицита 21-гидроксилазы (заболеваемость примерно 1 на 10 000–15 000 новорожденных по всему миру).
Врожденная гипоплазия коры надпочечников это потенциально смертельное заболевание при отсутствии ранней диагностики и лечения. Х-сцепленная врожденная гипоплазия надпочечников связана с дефицитом глицеролкиназы и мышечной дистрофией Дюшена. Дефицит глицеролкиназы приводит к повышению концентрации триглицеридов в крови.
Заболевание встречается только у мальчиков и связано с измененной X-хромосомой.
У заболевших детей после рождения развиваются симптомы первичной глюкокортикоидной и минералокортикоидной надпочечниковой недостаточности и им ошибочно ставят диагноз врожденной дисфункции коры надпочечников. У некоторых больных этот период может пройти относительно благополучно и проявляется в дальнейшем признаками хронической надпочечниковой недостаточности, а в период полового созревания задержкой пубертата [14]. ГипоГ сочетается с первичным дефектом сперматогенеза. У некоторых пациентов была диагностирована нейросенсорная глухота. Возможна внутриутробная задержка физического развития и аномалии наружных половых органов.
Изучение родословной больного позволяет заподозрить гипоплазию коры надпочеников. Похожие симптомы можно отметить у родственников мужского пола (братьев, дядей), но решающую роль в диагностике играет молекулярно-генетический анализ.
Продолжение статьи читайте в следующем номере.
Литература
ГБОУ ВПО РНИМУ им. Н. И. Пирогова МЗ РФ, Москва