Аммоний двухромовокислый чем опасен
Аммоний двухромовокислый чем опасен
Шестивалентный хром в бихромате неспецифически связывается с белками и нуклеопротеинами и специфически поглощается эритроцитами и тромбоцитами. Он восстанавливается до трехвалентного хрома, но соединение, возможно, в совокупности с образующимся в качестве промежуточного продукта пятивалентным хромом вызывает тяжелое свободнорадикальное поражение митохондрий, особенно в почечных канальцах и гепатоцитах.
а) Клиника отравления бихроматом:
— Хронические эффекты. Порошковый хромат вызывает конъюнктивит, хронические проникающие поражения кожи, слезотечение, изъязвление носовой перегородки и рак дыхательных путей.
— Острые эффекты. Большие дозы могут индуцировать головокружение, жажду, боль в животе, рвоту, олигурию, анурию, шок, припадки, тяжелую коагулопатию, внутрисосудистый гемолиз и гепаторенальный синдром.
— Изучение отдельных случаев. 15-летняя девочка проглотила несколько гранул бихромата калия. После этого у нее началась рвота, больная потеряла сознание и через 12 ч умерла. Концентрация хрома в крови составляла 3,5 мг/100 мл. Высокие концентрации хромата были также обнаружены в печени, почках и желудке.
б) Лабораторные данные отравления бихроматом:
— Усиление выведения. Взрослый пациент проглотил насыщенный раствор бихромата калия, после 5-часового гемодиализа было удалено около 5 мг хрома. Лечение гемодиализом проводилось ежедневно по 5 ч в течение 7 сут. Концентрация хрома в сыворотке снизилась с исходного значения 1,6 мг/л (норма от 0,06 до 0,54 мкг/л) до 0,86 мг/л. Концентрация хрома в моче снизилась с 2,4 мг/л (норма от 0,08 до 2,10 мкг/л) до 0,88 мг/л. Больной выздоровел.
БАЛ (димеркаптол), аскорбиновая, фолиевая и эдето-вая кислоты не проявили заметной эффективности в лечении отравления бихроматом.
в) Лечение отравления бихроматом:
— Антидоты бихромата. Назогастральный лаваж раствором аскорбиновой кислоты и внутривенные вливания больших доз аскорбиновой кислоты могут обеспечить восстановление шестивалентного хрома до менее токсичной трехвалентной формы. Внутривенное введение N-ацетилцистеина (140 мг/кг каждые 4 ч на протяжении 48 ч) и гемодиализ индуцировали значительное улучшение функции печени и почек у взрослого пациента, проглотившего бихромат натрия.
— Поддерживающая терапия. Следует контролировать функцию почек и печени. В случае дыхательной недостаточности необходимо вводить кислород.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
— Вернуться в оглавление раздела «Токсикология»
Группа компаний техпром
(8443) 20 54 74
(8443) 20 58 81
Категории
Компании по доставке
Аммоний двухромовокислый (бихромат аммония)
Изготовим изделия по вашим чертежам!
Изготавливаем нестандартные изделия по вашим чертежам.
Минимальный объём количества заказываемых товаров может варьироваться от 1 до 10 000 в зависимости от сложности изделия.
Насосы – промышленные, шестеренные, динамические, центробежные
Насос является гидравлическим устройством. С его помощью энергия (механическая) приводного двигателя преобразуется в энергию потока…
Электродвигатели – лифтовые, синхронные, многоскоростные
Лифтовые электродигатели Двигатели для привода лифтов предназначены для привода лебедок пассажирских, грузовых и грузопассажирских лифтов промышленных,…
Масляные силовые трансформаторы /p> Хорошую работу электросетей обеспечивают конкретные приспособления и приборы. Одним из таких приспособлением является…
Редуктор червячный Червячные редуктор – это устройство, которое преобразует момент двигатели и угловую скорость, применяя червячную…
Фрезерные станки Фрезерные станки используются для обработки фасонных и плоских поверхностей из дерева, металла, пластика, камня…
Фланец
Фланец – соединительная часть трубопровода. В его состав входят кольцо или квадратные рамки со специальными…
Задвижки
Задвижка является трубопроводной арматурой, в которой регулирующий либо запирающий компонент перемещается перпендикулярно оси потока рабочей…
Отводы
Отводы являются основой трубопроводов, компонентом трубопровода, с помощью которого в ходе монтажа меняется направление трубопровода.…
Затворы
Группа компаний Техпром © Все права защищены
Дихромат аммония
| Дихромат аммония | |
 | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Дихромат аммония |
| Традиционные названия | Аммоний двухромовокислый |
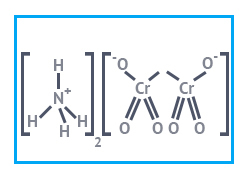
| Химическая формула | (NH4)2Cr2O7 |
| Физические свойства | |
| Молярная масса | 252,07 г/моль |
| Плотность | 2,115 г/см³ |
| Термические свойства | |
| Молярная теплоёмкость (ст. усл.) | 293 Дж/(моль·К) |
| Энтальпия образования (ст. усл.) | -1810 кДж/моль |
| Химические свойства | |
| Растворимость в воде | 35,6 20 ; 115 100 ; |
| Классификация | |
| Рег. номер CAS | 7789-09-5 |
| SMILES | [O-][Cr](=O)(=O)O[Cr]([O-])(=O)=O.[NH4+].[NH4+] |
| RTECS | HX7650000 |
| Безопасность | |
| Токсичность | Токсичен. Летальная доза 2 грамма |
Дихромат аммония— кристаллическое вещество оранжево-красного цвета, хорошо растворимое в воде.
Содержание
Получение
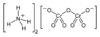
Дихромат аммония получают взаимодействием оксида хрома(VI) с разбавленным раствором аммиака:
Физические свойства
Оранжево-красные кристаллы принадлежат к моноклинной сингонии, пространственная группа C 2/c, параметры ячейки a = 1,327 нм, b = 0,754 нм, c = 0,778 нм, β = 93,70°, Z = 4.
Плотность 2,15 г/см³. Растворяется в воде и этаноле, не растворяется в ацетоне.
Химические свойства
Применение
Применяются в металлообрабатывающей, кожевенной, текстильной, химической, лакокрасочной, фармацевтической, керамической, спичечной промышленности.
Токсичность
Ссылки
Литература
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Hg2 2+ | Pb 2+ | Sn 2+ | Cu + | Cu 2+ | |
| OH − | P | P | P | — | P | М | Н | М | Н | Н | Н | — | Н | Н | Н | Н | Н | — | — | Н | Н | Н | Н | |
| F − | P | Н | P | P | Р | М | Н | Н | М | Р | Н | Н | Н | Р | Р | М | Р | Р | М | М | Н | Р | Н | Р |
| Cl − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | Н | М | — | Н | Р |
| Br − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | Н | М | Р | H | Р |
| I − | P | P | P | P | Р | Р | Р | Р | Р | Р | ? | Р | — | Р | Р | Р | Р | Н | Н | Н | Н | М | Н | — |
| S 2− | P | P | P | P | — | Р | М | Н | Р | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| SO3 2− | P | P | P | P | Р | М | М | М | Н | ? | ? | М | ? | Н | Н | Н | М | Н | Н | Н | Н | ? | Н | ? |
| SO4 2− | P | P | P | P | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Н | Р | Р | Р |
| NO3 − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | — | Р | Р |
| NO2 − | P | P | P | P | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? | ? | ? |
| PO4 3− | P | Н | P | P | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | ? | Н | Н | Н | Н |
| CO3 2− | М | Р | P | P | Р | Н | Н | Н | Н | — | — | Н | — | Н | Н | — | Н | Н | — | Н | — | — | ? | — |
| CH3COO − | P | Р | P | P | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | М | Р | — | Р | Р |
| CN − | P | Р | P | P | Р | Р | Р | Р | Р | ? | Н | Н | — | Н | Н | Н | Н | Н | Р | Н | Р | — | — | Н |
| SiO3 2− | H | Н | P | P | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | ? | Н | ? | ? | ? |
Полезное
Смотреть что такое «Дихромат аммония» в других словарях:
Дихромат натрия — Дихромат натрия … Википедия
Дихромат лития — Общие Систематическое наименование Дихромат лития Традиционные названия Бихромат лития; хромовокислый литий Химическая формула Li2Cr2O7 Физические свойства … Википедия
Дихромат рубидия — Общие Систематическое наименование Дихромат рубидия Традиционные названия Бихромат рубидия; двухромовокислый рубидий Химическая формула Rb2Cr2O7 Физические свойства … Википедия
Дихромат калия — У этого термина существуют и другие значения, см. хромпик. Дихромат калия … Википедия
аммония дихромат — amonio dichromatas statusas T sritis chemija formulė (NH₄)₂Cr₂O₇ atitikmenys: angl. ammonium dichromate rus. аммония дихромат ryšiai: sinonimas – diamonio heptaoksodichromatas … Chemijos terminų aiškinamasis žodynas
Бихромат аммония — Эту страницу предлагается переименовать в Дихромат аммония. Пояснение причин и обсуждение на странице Википедия:К переименованию/25 декабря 2012. Возможно, её текущее название не соответствует нормам современного русского языка и/или… … Википедия
Хромат аммония — Общие Систематическое наименование Хромат аммония Традиционные названия Хромовокислый аммоний Химическая формула (NH4)2CrO4 Физические свойства Состояние … Википедия
Список неорганических соединений по элементам — Основная статья: Неорганические соединения Список неорганических соединений по элементам информационный список неорганических соединений, представленный в алфавитном порядке (по формуле) для каждого вещества, водородные кислоты элементов (при их… … Википедия
Хромат таллия(I) — Общие Систематическое наименование Хромат таллия(I) Традиционные названия Хромовокислый таллий Химическая формула Tl2CrO4 Физические свойства Состояние ( … Википедия
Дихромат аммония
| Дихромат аммония | |
|---|---|
  | |
 | |
| Систематическое наименование | Дихромат аммония |
| Традиционные названия | Аммоний двухромовокислый, бихромат аммония |
| Хим. формула | (NH4)2Cr2O7 |
| Молярная масса | 252,07 г/моль |
| Плотность | 2,115 г/см³ |
| Температура | |
| • разложения | 180 °C |
| Мол. теплоёмк. | 293 Дж/(моль·К) |
| Энтальпия | |
| • образования | -1810 кДж/моль |
| Растворимость | |
| • в воде | 35,6 20 ; 115 100 ; |
| ГОСТ | ГОСТ 3763-76 |
| Рег. номер CAS | 7789-09-5 |
| PubChem | 24600 |
| Рег. номер EINECS | 232-143-1 |
| SMILES | |
| RTECS | HX7650000 |
| Номер ООН | 1439 |
| ChemSpider | 23002 |
| Предельная концентрация | 10 мкг/м 3 воздуха |
| ЛД50 | 20..250 мг/кг |
| Токсичность | токсин, канцероген, аллерген, мутаген |
| Пиктограммы ECB |       |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Дихромат аммония— кристаллическое вещество оранжево-красного цвета, хорошо растворимое в воде.
Содержание
Получение
Дихромат аммония получают взаимодействием оксида хрома VI с разбавленным раствором аммиака:
Физические свойства
Оранжево-красные кристаллы принадлежат к моноклинной сингонии, пространственная группа C 2/c, параметры ячейки a = 1,327 нм, b = 0,754 нм, c = 0,778 нм, β = 93,70°, Z = 4.
Плотность 2,15 г/см³. Растворяется в воде и этаноле, не растворяется в ацетоне.
Химические свойства
Применение
Применяются в металлообрабатывающей, кожевенной, текстильной, химической, лакокрасочной, фармацевтической, керамической, спичечной промышленности.
Опасность
Биологическая опасность
В России для всех солей дихромовой кислоты класс опасности 1, максимальная разовая концентрация ПДК в воздухе рабочей зоны составляет 10 мкг/м 3 (1998 год). В США предельный пороговый уровень однократного воздействия составляет 50 мкг/м3 воздуха (ACGIH, 2000 год). Средневзвешенная концентрация за 8-часовой рабочий день в воздухе не более 0,5 мкг/м 3 (OSHA, 2006 год). В ЕС все соединения шестивалентного хрома подпадают под директиву RoHS. Для питьевой воды и пищи ВОЗ рекомендует максимальное содержание шестивалентного хрома не более 50 мкг/кг.
Вещество очень токсично для водных организмов, вызывает долговременные изменения в водной экосистеме. Накапливается в живых организмах.
Вследствие высокой токсичности солей шестивалентного хрома демонстрация зрелищного опыта «вулкан Бёттгера» запрещена в школах многих стран.
Химическая опасность
При нагревании в герметичных контейнерах взрывоопасен. В январе 1986 года двое рабочих погибли и 14 пострадали в США при взрыве нескольких сотен килограмм вещества во время сушки.
Пожарная опасность
Горюч, самовоспламеняется при 225°С. Является окислителем, реагирует с горючими материалами, воспламеняя их.
Аммоний двухромовокислый — очень опасный, но полезный в экономике реактив
Аммоний двухромовокислый — неорганическое соединение, 
Свойства
Порошкообразное вещество, состоящее из кристаллов ярко-красного или красно-оранжевого цвета. Водорастворимо, растворимость увеличивается с ростом температуры. Растворяется также в этиловом спирте и диметилсульфоксиде. Не растворяется в ацетоне. При нагревании разлагается с выделением азота, паров воды и выбросом раскаленных твердых частиц оксида хрома. Эта реакция выглядит очень эффектно и даже получила отдельное название «Вулкан Бёттгера» («вулкан на столе», «химический вулкан»). Раньше ее часто использовали для демонстрации в учебных заведениях, но из-за токсичности реактива сейчас она запрещена в школах большинства стран мира. Бихромат аммония горюч, взрывоопасен, токсичен.
 |  |
| Вытяжной шкаф ВА-104, комплектация «Люкс» | Аммоний двухромовокислый |
С точки зрения химии — сильный окислитель, химически активный реагент. Бурно реагирует при контакте с органическими материалами, восстановителями, горючими веществами (воспламеняет их). Вступает в реакции с галогеноводородами. Взаимодействие со щелочами переводит бихромат аммония (NH4)2Cr2O7 в хромат (NH4)2CrO4.
Меры предосторожности
Вещество относится к 1-му классу опасности. Фатальная доза для человека — единовременное принятие 2 г реактива. Частицы пыли в воздухе могут вызвать тяжелое отравление при их вдыхании. При регулярном и длительном контакте вызывает аллергии, раздражение органов дыхания и слизистых глаз, провоцирует развитие онкологических заболеваний, астмы, трудно заживающих язв на коже. Реактив вызывает мутагенные изменения. При проглатывании легко всасывается в кровь, вызывает заболевания печени и почек, органов дыхания, ЖКТ.
Соединение крайне опасно для окружающей среды, особенно для водных экосистем. Может накапливаться в живых организмах.
На производстве рабочее место должно быть оснащено общей принудительной вентиляцией. Сотрудники должны пользоваться защитной одеждой, резиновыми перчатками, респираторами и защитными очками. В лабораториях опыты проводят в вытяжном шкафу.
Хранят на крытых складах, в прохладных помещениях, вдали от горючих материалов, источников тепла, источников искр. При повышении температуры реактив начинает разлагаться, что может привести к взрыву герметичных контейнеров.







