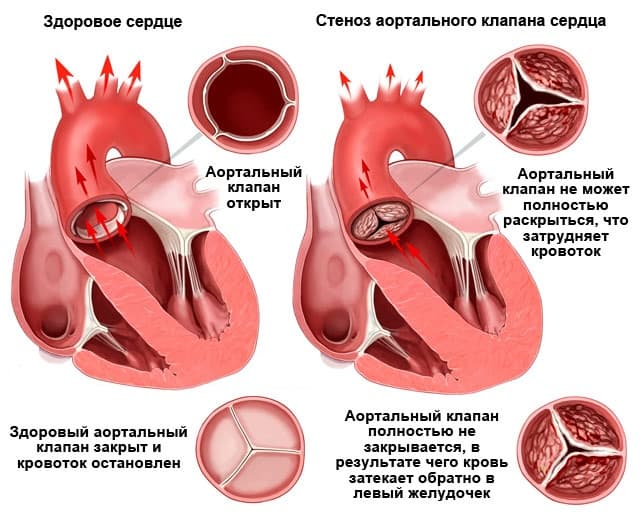
Аорта фиброзное кольцо что это
Аортальный стеноз: лечение, операция, пластика аортального клапана
Тел.: 8-800-25-03-03-2
(бесплатно для звонков из регионов России)
Санкт-Петербург, наб. реки Фонтанки, д. 154
Тел.: +7 (812) 676-25-25
Санкт-Петербург, В.О., Кадетская линия, д. 13-15
Тел.: +7 (812) 676-25-25
Санкт-Петербург, ул. Циолковского, д.3
Тел.: +7 (812) 676-25-10
Этиология:
Отмечается тенденция к увеличению частоты инволюционных (дегенеративно-атеросклеротических) причин аортального стеноза, что привело к увеличению возрастных пациентов старше 60-65 лет, нуждающихся в хирургической коррекции аортального порока.
При врожденном или ревматическом поражении клапана отмечается длительный латентный период без клинических проявлений. Летальность и риск осложнений существенно увеличиваются с появлением симптомов заболевания. При стенокардии, обмороках и проявлениях сердечной недостаточности, обусловленной систолической дисфункцией левого желудочка средняя продолжительность жизни 5, 3 и 2года соответственно. При бессимптомном течении риск внезапной смерти невелик (даже при тяжелом аортальном стенозе), тогда как при наличии симптомов 15 – 20% больных умирают внезапно.
Скорость прогрессирования поражения аортального клапана:
Мерцательная аритмия, аортальная недостаточность (спонтанная или вызванная инфекционным эндокардитом), митральная недостаточность и острый инфаркт миокарда ускоряют декомпенсацию.
При неосложненном течении аортального стеноза характерная аускультативная картина: систолический шум в точке Боткина и на основании сердца справа, проводится на сосуды шеи, ослабление 2-го тона за счет аортального компонента. Интенсивность систолического шума может уменьшаться при развитии систолической дисфункции левого желудочка и не является критерием тяжести порока. Часто течение аортального стеноза осложняется патологией митрального клапана («митрализация»).
Диагностика аортального стеноза
Средний систолический градиент между аортой и ЛЖ на уровне аортального клапана менее 50 мм рт. ст. – гемодинамически малозначимый аортальный стеноз, 50 – 80 мм рт.ст. – умеренный аортальный стеноз, более 80 мм рт.ст. – резкий аортальный стеноз.
Показания к хирургическому лечению (протезированию) аортального стеноза
(Американская Ассоциация сердца, Американская коллегия кардиологов)
Кроме того, уровни достоверности в поддержку рекомендаций изложены следующим образом:
КЛАСС I
1. Протезирование аортального клапана показано симптомным пациентам с тяжелым аортальным стенозом (Уровень достоверности: B).
2. Протезирование аортального клапана показано пациентам с тяжелым аортальным стенозом, при операции аорто-коронарного шунтирования (АКШ). (Уровень достоверности: С).
3. Протезирование аортального клапана показано пациентам с тяжелым аортальным стенозом, при операции на аорте или других клапанах сердца. (Уровень достоверности: C).
4. Протезирование аортального клапана показано пациентам с тяжелым аортальным стенозом и систолической дисфункцией ЛЖ (ФВ менее 50%). (Уровень достоверности: C).
КЛАСС IIА
Протезирование аортального клапана показано пациентам с умеренным аортальным стенозом, при операции АКШ, операции на аорте или других клапанах сердца. (Уровень достоверности: B).
КЛАСС IIБ
1. Протезирование аортального клапана показано асимптомным пациентам с тяжелым аортальным стенозом и патологическим ответом на нагрузку (например, развитие симптомов гипотензии). (Уровень достоверности: C).
2. Протезирование аортального клапана показано возрастным пациентам с тяжелым асимптомным аортальным стенозом, если существует высокая вероятность быстрого прогрессирования (возраст, кальциноз). (Уровень достоверности: C).
4. Протезирование аортального клапана показано асимптомным пациентам с крайне тяжелым аортальным стенозом (площадь аортального клапана менее 0.6 cм2, средний градиент более 60 мм рт.ст. и скорость потока более 5.0 м/с), когда ожидаемая операционная летальность пациентов составляет менее 1.0%. (Уровень достоверности: C).
КЛАСС III
1. Протезирование аортального клапана не показано для предупреждения внезапной смерти у асимптомных пациентов с аортальным стенозом у кого нет ни одного показателя из списка рекомендаций Классов IIА/IIБ. (Уровень достоверности: B).
2. У возрастных пациентов с тяжелым, симптомным, кальцинированным аортальным стенозом протезирование аортального клапана является единственным эффективным методом лечения.
3. Молодые пациенты с врожденным или ревматическим аортальным стенозом могут быть кандидатами на вальвулотомию. Хотя нет единого мнения относительно оптимального срока проведения операции у асимптомных пациентов, для большинства пациентов можно разработать рациональные рекомендации.
Протезирование аортального клапана
За последние годы в хирургическом лечении клапанов сердца наблюдался значительный прогресс. Усовершенствование техники (в т.ч. аппаратов искусственного кровообращения), разработка единых стандартов и протоколов как предоперационного обследования, так и хода операции позволили снизить риски периоперационных осложнений, сделав саму операцию на клапанном аппарате сердца более безопасной, чем отказ от операции и попытка жить с дисфункцией клапана.
Виды хирургического лечения: операции по замене клапана сердца
Принципиально существует два вида операции на клапанах сердца: протезирование искусственным или биологическим протезом и пластика собственного клапана. Вполне естественно, что собственный клапан человека после удачной реконструкции функционирует лучше, чем искусственный протез. Но в случае невозможности сохранения собственного клапана единственный выход – замена его на протез.
Виды клапанов, используемых при протезировании
При протезировании аортального клапана доступ к клапану осуществляется посредством рассечения аорты в восходящем отделе (поперечная аортотомия). После иссечения створок аортального клапана и тщательной декальцинации фиброзного кольца последнее прошивается П-образными швами. С целью предотвращения прорезывания фиброзного кольца швы укрепляют тефлоновыми прокладками. Для выбора размера имплантируемого протеза диаметр фиброзного кольца измеряют специальными калибраторами. Выбранный протез имплантируют в аортальную позицию путем прошивания его оплетки. После фиксации протеза оценивают подвижность запирательных элементов механического протеза или коаптацию створок биологического клапана. При отсутствии ограничений их подвижности рассеченную аорту герметизируют двумя рядами швов.
Фиброзные кольца клапанов сердца при недифференцированной дисплазии соединительной ткани
Рубрика: 6. Клиническая медицина
Статья просмотрена: 6303 раза
Библиографическое описание:
Кузнецова, В. В. Фиброзные кольца клапанов сердца при недифференцированной дисплазии соединительной ткани / В. В. Кузнецова. — Текст : непосредственный // Медицина и здравоохранение : материалы I Междунар. науч. конф. (г. Чита, ноябрь 2012 г.). — Чита : Издательство Молодой ученый, 2012. — С. 26-36. — URL: https://moluch.ru/conf/med/archive/62/2893/ (дата обращения: 28.12.2021).
В литературных источниках имеются сообщения о диаметре митрального и аортального фиброзных колец при дисплазии соединительной ткани. По данным исследования Яковлева В.М. и соавт. [5], увеличение диаметра митрального фиброзного кольца в обе фазы сердечного цикла может служить критерием соединительнотканной дисплазии митрального клапана с нарушением его функции. В этой работе было выявлено статистически достоверное увеличение диаметра митрального фиброзного кольца в обе фазы сердечного цикла в группе пациентов с пролапсом митрального клапана с наличием митральной регургитации в сравнении с контрольной группой (пациенты без дисплазии соединительной ткани) и внутри опытной группы (пациенты с пролапсом митрального клапана без митральной регургитации). В работе Малеева Э.Г и соавт. [1] пациенты с пролапсом митрального клапана также имели больший диаметр митрального фиброзного кольца по сравнению с контрольной группой.
Относительно диаметра двух других фиброзных колец сердца при дисплазии соединительной ткани в доступной литературе данных не обнаружено.
Цель исследования: изучение диаметра фиброзных колец клапанов сердца при дисплазии соединительной ткани и их взаимосвязи с антропометрическими показателями и морфо-функциональными показателями сердца.
Материал и методы. В основу исследования положены данные, полученные при обследовании 60 пациентов с ДСТ в возрасте от 18 до 44 лет (средний возраст — 25,9±6,8 года) и 27 пациентов без признаков ДСТ. Объективное исследование проводилось по общепринятой методике. Во время физикального исследования проводились следующие измерения: рост, вес, окружность грудной клетки (ОГК), окружность талии (ОТ), размах рук, рост сидя, длина кисти, длина стопы. На основании полученных данных рассчитывались ИМТ, площадь поверхности тела (ППТ), индексы пропорциональности (ИП между ОГК и ростом стоя, ИП между длиной ног и длиной туловища, индекс Пинье). У пациентов определялись САД, ДАД и ЧСС.
Статистическая обработка данных проводилась с помощью пакета прикладных программ S t atistica 6.0 фирмы StatSoft и MIX для Windows, а также возможностей Microsoft Excel. Анализ данных на нормальность распределения проводился с помощью теста Колмогорова-Смирнова. В качестве нулевой гипотезы принималась гипотеза о нормальном распределении количественного признака. Так как распределение всех признаков было отлично от нормального распределения, то признаки описаны медианой и интерквартильным размахом (25 и 75 процентили). Сравнение двух независимых групп выполнялось с помощью U-теста Манна-Уитни. Оценка зависимости между двумя переменными проводилась с применением коэффициента корреляции Спирмена. Уровень принятия или отклонения нулевой гипотезы составлял ниже 0,05.
Результаты и обсуждение. Общая характеристика сравниваемых групп. Пациенты с ДСТ (табл.1) имели достоверно большую длину тела по сравнению с группой контроля ( p =0,0001) и достоверно меньшую массу тела ( p =0,0004), что является отражением общих свойств популяции пациентов с дисплазией соединительной ткани. При этом ИМТ и ППТ у пациентов с ДСТ были статистически значимо ниже, чем у пациентов группы контроля ( p p =0,02). ОТ и ОГК у пациентов с ДСТ были статистически значимо меньше, чем у пациентов группы контроля ( p =0,00001 и p =0,0005). Рост сидя, длина кисти, стопы и размах рук статистически значимо не различались между группами. САД, ДАД и ЧСС у пациентов с ДСТ оказались статистически значимо снижены по сравнению с группой контроля ( p =0,007, p =0,03 и p =0,02 соответственно).
Аорта фиброзное кольцо что это
Центральное положение в сердце занимает корень аорты (КА), основной функцией которого является обеспечение эффективной доставки артериальной крови по всему телу [1]. Важность данной структуры еще в 1513 г. отметил Leonardo da Vinci: «в середине основания сердца находится начало, или основание аорты, которое занимает положение царственное, соответствующее его высочайшему назначению для жизни живого».
Различные патологические процессы в этой области могут привести к изменению структур КА и нарушению нормальной функции аортального клапана. Колоссальные гемодинамические нагрузки, которые постоянно испытывает КА, способствуют быстрому прогрессированию возникших воспалительно-деструктивных процессов и поражению прилежащих структур всего анатомического комплекса: митрального клапана, перегородок сердца, элементов проводящей системы и устьев коронарных артерий [2].
Заболевания аортального клапана представляют важную глобальную проблему здравоохранения. Точные данные о распространенности аортального стеноза и аортальной недостаточности отсутствуют, но исследования, проведенные в западных странах, показывают, что от 3 до 4% взрослого населения страдают умеренной или тяжелой патологией аортального клапана. Распространенность аортального стеноза и аортальной недостаточности увеличивается с возрастом. Частота умеренного или тяжелого аортального стеноза/недостаточности составляет 1% у лиц в возрасте моложе 55 лет и 6% у лиц старше 75 лет [3, 4].
На протяжении пяти десятилетий «золотым стандартом» в лечении пороков аортального клапана являлось его протезирование [5], при их сочетании с аневризмой КА — протезирование клапаносодержащим кондуитом по методике Bentall—DeBono [6].
Однако снижение качества жизни, связанное с необходимостью приема антикоагулянтов, и ассоциированные с этим осложнения требуют продолжения поиска альтернативных методов лечения данной патологии. В связи с этим на сегодняшний день все большее развитие получают реконструктивные операции на КА, для выполнения которых необходимо детальное понимание морфологии структур КА в норме.
Основы нормальной анатомии КА
Впервые КА зарисовал и описал Leonardo da Vinci в 1530 г. [7] (рис. 1). 
На сегодняшний день КА определяется как часть грудной аорты, простирающаяся от аортального кольца (так называемого базального кольца) до синотубулярного соединения. Это короткая часть длиной 2—3 см, состоящая из следующих компонентов: фиброзное кольцо аортального клапана, синусы Вальсальвы и синотубулярное соединение. Внутренние структуры включают створки аортального клапана, межстворчатые треугольники и комиссуры [10]. Некоторые описания КА включают в его состав устья коронарных артерий [11]. КА располагается между левым желудочком и аортой (рис. 2). 
При протезировании аортального клапана хирург фиксирует манжетку клапана к линии прикрепления трех створок аортального клапана. Эта линия в действительности формирует «корону», которую принято называть хирургическим кольцом аортального клапана. Это кольцо также известно как фиброзное кольцо аортального клапана. Оно богато эластическими волокнами и достаточно крепкое, чтобы выдерживать натяжение при фиксации к нему искусственного клапана. Базальное кольцо — это функциональная часть аорты, расположенная по виртуальной линии, соединяющей нижние точки каждой створки в одной плоскости [10, 12, 13]. Базальное кольцо по своей сути является эхо—кольцом, так как его диаметр измеряют при эхокардиографии [12]. Более одной трети хирургов называют базальное кольцо вентрикулоаортальным соединением [14]. Термин вентрикулоаортальное соединение как определение «кольца» довольно неоднозначен, так как «анатомическое вентрикулоаортальное соединение» представляет собой переход миокарда левого желудочка в структуру стенки аорты [15]. Собственно, вентрикулоаортальное соединение и базальное кольцо следует рассматривать отдельно (рис. 3) 
Пространства между внутренней поверхностью 3 выпуклых частей стенки КА и соответствующими створками называются аортальными синусами Вальсальвы (рис. 4). 
Под каждой комиссурой между арками, сформированными линиями прикрепления створок, лежат 3 фиброзных межстворчатых треугольника Генле (рис. 5). 
Треугольник между левым и правым венечными синусами находится сразу за правым желудочком. Треугольник между правым и некоронарным синусами обращен к правому предсердию. Он находится в тесной связи с мембранозной частью межжелудочковой перегородки, которая в проксимальном отделе содержит пучок Гиса. Эта область имеет особое значение при операциях на аортальном клапане, так как ятрогенное повреждение этой зоны может привести к временным или постоянным нарушениям проводимости, которые могут потребовать имплантации постоянного кардиостимулятора [25]. Под треугольником между левым коронарным и некоронарным синусом находится аорто-митральный комплекс с прилежащей передней створкой митрального клапана. Верхняя часть этого треугольника упирается в поперечный синус перикарда [26].
Анатомически каждую створку аортального клапана можно разделить на три части: тело створки, свободный край створки с утолщенным узелком Аранция и зона фиксации створки к КА [14]. Тело створок характеризуется эластичностью и неравномерной толщиной. Каждая створка имеет слегка шероховатую поверхность, обращенную к аорте, и более гладкую поверхность, обращенную к желудочку. На желудочковой поверхности створки расположена зона, известная как лунула, занимающая всю ширину вдоль свободного края и охватывающая приблизительно одну треть глубины створки. В этой части створки соприкасаются при закрытии клапана, образуя зону коаптации. Фенестрации в области лунулы являются частым явлением, особенно у пожилых людей. Тем не менее клапан остается состоятельным, потому что фенестрации располагаются выше линии коаптации. Более крупные фенестрации, которые выходят за пределы зоны коаптации, могут привести к значительной клапанной регургитации [27]. С возрастом створки становятся толще, увеличивается их жесткость. В своем исследовании Y. Sahasakul и соавт. [28, 29] сравнивали толщину интактных створок у пациентов трех возрастных групп: моложе 20 лет, 20—59 лет и старше 60 лет. Было обнаружено увеличение толщины узелка, лунулы и тела створки с возрастом, которое становилось более заметным после 50 лет, когда узелок становился вдвое толще лунулы. Склероз, дистрофический кальциноз или сращения комиссур могут привести к стенозированию клапана.
Гистологически каждая створка состоит из волокнистой основы, покрытой субэндотелиальными фиброэластическими слоями, называемыми артериальными со стороны аорты и желудочковыми со стороны левого желудочка. Артериальная часть содержит главным образом коллагеновые волокна с небольшим количеством эластина. Желудочковая часть состоит из более рыхлой соединительной ткани, богатой протеогликанами. Желудочковый слой тоньше артериального и содержит больше эластина и меньше организованных волокон коллагена. У лунулы и свободного края каждой створки вентрикулярный слой становится толще, особенно в области узелка Аранция, где он представляет собой массу эластической ткани [27]. Изучая механику аортального клапана, I. Vesely [30] прокомментировал, что эластин действует как «помощник» в восстановлении коллагеновых волокон обратно в исходное состояние.
Расположение КА
Левый коронарный синус прилежит к стенке левого желудочка и правой ветви легочной артерии. Под правым коронарным синусом лежат межжелудочковая перегородка и полость правого желудочка, под некоронарным синусом — мембранозный отдел межжелудочковой перегородки, межпредсердная перегородка, стенка правого предсердия, передняя створка митрального клапана и левое предсердие [2]. Плоскость аортального клапана наклонена книзу под углом к клапану легочной артерии. Нижние точки синусов аортального клапана лежат под углом 30° к горизонтальной плоскости [24].
Структуры КА, состоящие из плотной соединительной ткани, являются частью фиброзного каркаса сердца, выполняющего опорную и формообразующую функции. К ним относят дугообразные зоны прикрепления створок аортального клапана (хирургическое кольцо), от которых фиброзная ткань распространяется вокруг отверстий митрального и трикуспидального клапанов, формируя тем самым фиброзные кольца предсердно-желудочковых клапанов. К фиброзному каркасу сердца относится также аорто-митральный комплекс — фиброзная мембрана, соединяющая межстворчатый треугольник между некоронарной и правой коронарной створками аортального клапана с передней створкой митрального клапана [31].
Функция КА
Все компоненты корня аорты движутся согласованно и синхронно. Они изменяют свою форму и размер в течение различных фаз сердечного цикла, чтобы обеспечить выброс до 15 л в 1 мин с минимальными потерями энергии. Во время ранней систолы смещение кольца аорты вниз, вызванное изоволюметрическим сокращением левого желудочка, инициирует открытие аортального клапана. Во время поздней систолы окружность кольца клапана аорты уменьшается в результате сокращения желудочков, а окружность синотубулярного соединения увеличивается в результате повышения давления. Степень сужения кольца неодинакова с разных сторон. Левый и правый секторы кольца сокращаются значительно больше, чем некоронарный сектор. Во время диастолы аортальный клапан закрывается, и окружность кольца увеличивается в результате аортального обратного потока. Синусы Вальсальвы расширяются, и комиссуры перемещаются внутрь из-за эластичности стенки аорты и гемодинамической нагрузки на створки. Вихревые потоки крови в синусах Вальсальвы играют важную роль, на что впервые указал Леонардо да Винчи. Кровоток вихревого характера не только закрывает створки аортального клапана, но и поддерживает коронарное кровообращение во время систолы и диастолы [18].
Патологические варианты аортального клапана
Аортальный клапан может иметь от 1 до 4 створок различных размеров. Функционально аномалия развития клапана проявляется аортальным стенозом, недостаточностью или их комбинацией.
Наиболее частым вариантом является двустворчатый аортальный клапан, распространенность которого достигает 2,5% [32, 33]. У мужчин данная патология встречается в 4 раза чаще, чем у женщин. Большинство пациентов с двустворчатым аортальным клапаном являются асимптомными и какие-либо клинические проявления у них отсутствуют. Однако данная группа больных имеет большую склонность к развитию склеротических изменений КА и ее кальцинации по сравнению с пациентами с нормальным трехстворчатым аортальным клапаном. Это особенно актуально для молодых больных. Двустворчатый аортальный клапан является причиной аортального стеноза в 50% случаев у взрослых. Морфология двустворчатого аортального клапана вариабельна [34]. Створки клапана могут быть почти одинаковыми или разными по размеру (рис. 7). 
Небольшая степень кальцинации трехстворчатого аортального клапана наиболее часто распространена у пожилых людей. Дегенеративный клапанный стеноз, вызванный кальцификацией, чаще встречается у пациентов старше 65 лет. В таких случаях комиссуральные сращения отсутствуют или минимальны, за исключением больных, с сопутствующей ревматической болезнью клапана [36]. Выходное отверстие принимает треугольную форму. Створки становятся жесткими и малоподвижными. Напротив, стеноз, возникающий на трехстворчатом аортальном клапане у младенцев и детей, часто обусловлен дисплазией соединительной ткани и поражением створок.
Одностворчатый аортальный клапан является редкой врожденной аномалией сердца. Во время эмбрионального развития аортальный клапан формируется из трех бугорков, слияние которых приводит к появлению данной патологии [37]. По данным G. Novaro и соавт. [38], частота встречаемости одностворчатого аортального клапана у взрослых составляет приблизительно 0,02%. Аномалия часто обнаруживается во время операции по поводу аортального стеноза или при вскрытии. Эта патология также может сопровождать другие сердечные аномалии, такие как аортальная недостаточность, аневризма аорты, расслоение аорты, открытый артериальный проток и коарктация аорты [39]. Одностворчатый аортальный клапан можно разделить на два морфологических типа: акомиссуральный тип с точечным отверстием в центре и уникомиссуральный тип с щелевидным отверстием [40]. Акомиссуральный тип обычно сопровождается тяжелым стенозом, симптомы которого обычно присутствуют при рождении. Многим пациентам, нуждающимся в неотложной помощи при тяжелом стенозе, выполняется аортальная вальвулопластика или хирургическое вмешательство в младенчестве, или детстве [39]. Уникомиссуральная форма клапана обычно имеет относительно большее отверстие, чем акомиссуральная, и таким образом пациент может оставаться бессимптомным и гемодинамически стабильным до зрелого возраста.
Четырехстворчатый аортальный клапан встречается также редко, как и одностворчатый и может приводить к стенозу по мере кальцификации створок (рис. 8). 
Аортальная недостаточность встречается реже, чем стеноз аорты. Наиболее широко используемая классификация, предложенная El Khoury в 2009 г., основана на концепции, что аортальный клапан аналогичен митральному клапану. Следовательно, аналогично классификации митральной недостаточности по Carpentier [41], классификация аортальной недостаточности идентифицирует следующие ее виды:
— тип I — регургитация, связанная с изменениями диаметра фиброзного кольца при нормальном движении створок. Его можно дополнительно разделить на тип IA (дилатация синотубулярного перехода и восходящей аорты), тип IB (дилатация синотубулярного перехода и синусов Вальсальвы), тип IC (дилатация вентрикулоаортального перехода) и тип ID (перфорация створок без первичного функционального поражения аортального кольца);
— тип II — регургитация, связанная с пролапсом створок;
— тип III — регургитация, связанная с ограничением подвижности створок, например, в случае утолщения, фиброза и кальциноза створок аортального клапана.
Также существует комбинированное поражение аортального клапана. Для каждого типа аортальной недостаточности существуют специфические методы реконструкции.
Заключение
КА является совершенной и очень сложной структурой. Каждый компонент КА имеет оптимальную макроскопическую и микроскопическую структуру. Это обеспечивает пульсовой однонаправленный характер кровотока, сохранение его ламинарного характера, минимальное сопротивление и наименьшее, возможно, напряжение и повреждение тканей при различных гемодинамических условиях.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare o conflict of interest.