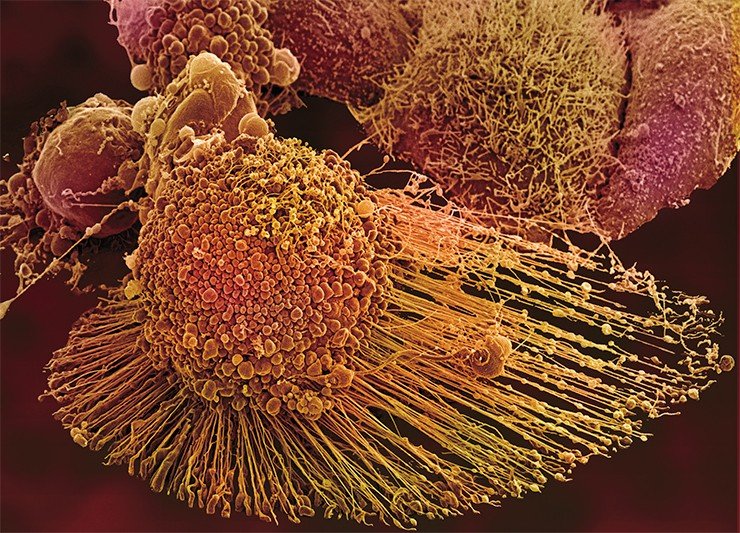
Апоптоз раковых клеток что это такое
Апоптоз: заказное самоубийство
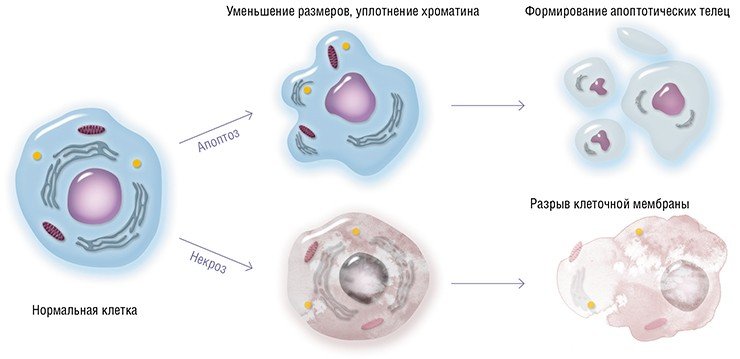
Само название этого типа клеточной смерти – апоптоз, что в переводе с греческого означает «падающие листья», говорит о том, что он является такой же естественной и неотъемлемой чертой многоклеточного организма, как сезонная смена листвы для деревьев. Апоптоз запускается, когда клетка имеет серьезные повреждения, ведущие к нарушению ее функций: в результате слаженной работы специальных систем, необратимо повреждающих основные клеточные структуры, такая клетка заканчивает жизнь «самоубийством».
Все клетки многоклеточных существ несут в себе потенциальную способность к апоптозу, так же как японские самураи всю жизнь носят с собой меч. И если по каким-то причинам тонкий механизм апоптоза разлаживается, последствия для организма могут оказаться самыми катастрофическими. Например, раковые клетки, блокируя систему апоптоза, приобретают бессмертие. Поэтому изучение механизмов клеточной самоликвидации является важнейшим направлением современных биомедицинских исследований: раскрытие тайн апоптоза поможет в разработке новых лекарств для борьбы с самыми тяжелыми и трудноизлечимыми болезнями современности
Регулярная, генетически запрограммированная гибель отдельных клеток необходима для нормального функционирования организма в целом. Все клетки многоклеточных существ обладают аппаратом апоптоза, так же как японские самураи всю жизнь носят с собой меч. Однако у этого естественного процесса есть и обратная сторона: если по каким-то причинам тонкий механизм апоптоза разлаживается, последствия для организма могут оказаться самыми катастрофическими.
Нарушения в запуске апоптоза ведут к возникновению ряда серьезных заболеваний, в том числе аутоиммунных и онкологических. Например, раковые клетки, блокируя систему апоптоза, приобретают бессмертие. Поэтому изучение механизмов клеточной самоликвидации является важнейшим направлением современных биомедицинских исследований: раскрытие тайн апоптоза поможет в разработке новых лекарств для борьбы с самыми тяжелыми и трудноизлечимыми болезнями современности.
Ферменты-киллеры
Итак, клетка выполнила свои функции, «постарела» и готова к самоуничтожению во благо всему организму. Кто же выполняет это «заказное» самоубийство?
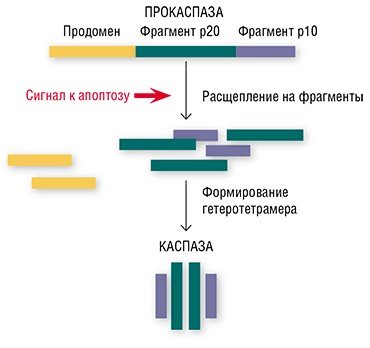
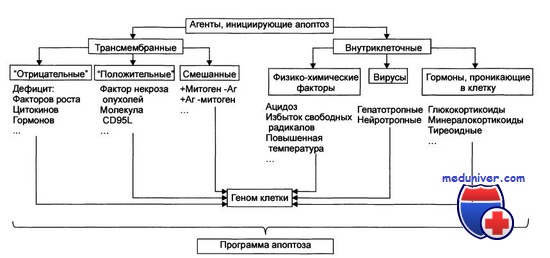
Оказывается, в этом «детективе» про апоптоз имеются и свои затаившиеся киллеры. В этой роли выступают особые ферменты – каспазы, имеющиеся в каждой клетке (Salvesen, 2002; Nicholson, 1999; Lavrik et al., 2005). Обычно каспазы присутствуют в клеточной цитоплазме в виде неактивных предшественников (прокаспаз). Прокаспазы не проявляют никакой активности, мирно сосуществуя в клетке вместе с другими белками, однако при поступлении сигнала на самоуничтожение они превращаются в настоящие белки-убийцы.
«Смена имиджа» безобидных прокаспаз происходит так: белок расщепляется на три фрагмента, один из которых (продомен) отщепляется, а остальные соединяются с двумя аналогичными фрагментами другой прокаспазы. Благодаря такой структурной перестройке образуется активный гетеротетрамер каспазы, в котором аминокислоты формируют центр фермента, выполняющий каталитическую функцию (Salvesen, 2002).
Образовавшиеся активные каспазы наконец показывают свое настоящее лицо: они начинают расщеплять все белки, которые содержат остатки аминокислоты аспарагина (при условии, что рядом располагаются определенным образом остатки еще трех других аминокислот). В результате такой «подрывной» деятельности в клетке оказываются поврежденными сотни белков. К числу наиболее известных мишеней каспаз относятся белки цитоскелета (структурного каркаса клетки); белки, отвечающие за репарацию (восстановление) поврежденной ДНК; структурные белки оболочки клеточного ядра, а также ряд других жизненно важных белков. Все это приводит к нарушению всех процессов жизнедеятельности клетки.
В то же время каспазы активируют ряд белков, которые участвуют в выполнении программы самоликвидации. Например, белка, который разрезает ДНК на большие фрагменты, – этот процесс, после которого целостность ДНК необратимо уничтожается, является характерной чертой апоптоза.
Сигнал на запуск
Но каким же образом клетка узнает, что ей пора самоликвидироваться? Кто и как дает указания киллерам-каспазам?
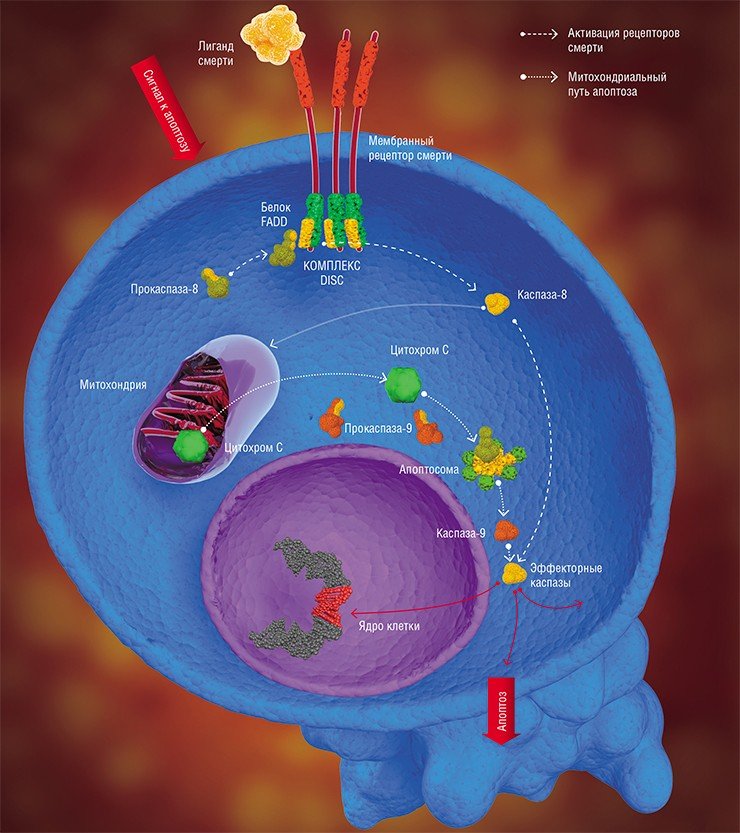
Митохондриальный путь инициируется в результате интенсивного воздействия на клетку ряда повреждающих факторов. Однако каким образом эти повреждения трансформируются в митохондриальный апоптотический сигнал, пока в деталях не установлено. Тем не менее достоверно известно, что первым шагом на этом пути является выход из митохондрий («энергетических фабрик» клетки) цитохрома С – небольшого белка, содержащего комплекс с железом, который является компонентом митохондриальной дыхательной цепи (Green et al., 2004).
Выход цитохрома С инициирует образование в цитоплазме клетки крупного белкового комплекса – апоптосомы, в которую, помимо самого митохондриального белка, входят прокаспаза-9 и белок АПАФ-1. Именно апоптосома и является настоящим «мафиозным боссом» митохондриального пути апоптоза, который дает сигнал киллерам-каспазам.
Речь идет об очень интересном явлении – самоактивации прокаспазы. Такое может произойти лишь в том случае, когда две молекулы этого белка, ориентированные определенным образом относительно друг друга, образуют димер. Именно такие уникальные пространственные условия, необходимые для димеризации и каталитической активации фермента, и предоставляет прокаспазе-9 апоптосома. Образовавшаяся в результате активная каспаза-9 расщепляет эффекторные каспазы (каспазу-3 и каспазу-7), а дальше все происходит по стандартной схеме апоптоза (Green et al., 2004).
В случае рецептор-зависимого сигнального пути инициация апоптоза начинается с другого белкового комплекса, который образуется непосредственно на самом рецепторе смерти (Krammer et al., 2007; Lavrik et al., 2005).
К настоящему времени семейство таких рецепторов включает шесть представителей, в том числе рецептор такого широко известного белка, как фактор некроза опухоли. Все рецепторы смерти имеют одинаковый фрагмент из 80 аминокислот – так называемый домен смерти, расположенный на белковом «хвостике», выходящем в цитоплазму клетки. Такой же аминокислотный фрагмент имеет и белок-адаптер FADD, находящийся в цитоплазме клетки. Домены смерти могут взаимодействовать между собой с образованием устойчивой связи; FADD, в свою очередь, способен присоединять к себе прокаспазу.
Вся цепь событий по образованию апоптотического комплекса запускается лигандом смерти – белком-агонистом, способным специфично связываться с рецептором смерти. Синтез (и, соответственно, рост концентрации) таких молекул в клетке стимулируется каскадом процессов, возникающих в ответ на повреждение клетки. В результате, благодаря посредничеству FADD, на рецепторе образуется комплекс DISC (от англ. death-inducing signaling complex), что в дословном переводе означает «сигнальный комплекс, инициирующий гибель». Именно в этом комплексе, как и в апоптосоме, происходит самоактивация прокаспазы-8, которая, в свою очередь, активирует эффекторные каспазы (каспазу-3 и каспазу-7) и инициирует клеточную гибель (Lavrik et al., 2005; Krammer et al., 2007). Собственно говоря, на этом различия между запуском двух сигнальных путей апоптоза заканчиваются.
Жить или не жить?
Нужно отметить, что любая клетка организма постоянно подвергается многочисленным повреждающим воздействиям, таким как радиационное излучение разных типов, разнообразные химические агенты, недостаток питательных веществ и т. п. К счастью для нас, для полноценной инициации клеточной гибели необходимо сравнительно сильное воздействие. На страже апоптотических путей стоят специфические механизмы, играющие роль «регулировщиков движения». Эту роль играют особые белки XIAPs и FLIP (Lavrik et al., 2005).
Белки XIAPs ингибируют каспазу-9, которая активируется вследствие развертывания митохондриального пути. Связываясь с активным центром каспазы, они не дают «киллеру» выполнять свою работу. Однако с помощью этих белков клетке удается заблокировать лишь небольшое число активных каспаз. Если же концентрация активных каспаз превышает некий пороговый уровень, то белков XIAPs становится недостаточно, и процесс апоптоза остановить уже невозможно.
В случае рецепторзависимого сигнального пути апоптоза ингибитором активации прокаспазы-8 служит близкий ей по структуре белок FLIP. Молекулы этого белка также могут связываться с апоптическим комплексом DISC, конкурируя за «место» с молекулами прокаспазы, – при повышенной концентрации в цитоплазме они блокируют все возможные «места» такого связывания (Krammer et al., 2007). В результате прокаспаза-8 не может быть активирована, и апоптоз не запускается.
Нарушения в уровне экспрессии как про- так и антиапоптотических белков может привести к серьезным отклонениям от обычного образа жизни клетки. Так, повышенный уровень экспрессии белков XIAPs и FLIP имеют многие раковые клетки. Выбрав курс на собственное бессмертие, в конечном счете они приводят к гибели все многоклеточное «сообщество» организма.
Итак, в отличие от голливудского детектива, в истории про апоптоз нет главного действующего лица: своевременное уничтожение поврежденных клеток и в итоге – жизнеспособность организма зависит от слаженной цепочки событий, в которой участвует множество различных белковых молекул.
И здесь очень важны количественные показатели, такие как концентрация. Сегодня изучением того, как влияет на инициацию и дальнейший ход апоптоза уровень содержания в клетке различных молекул, занимается одна из передовых областей современной науки – системная биология (Bentele et al., 2004). Основной ее постулат заключается в том, что протекание сложных процессов внутри клетки можно понять, лишь учитывая максимально большое число клеточных параметров. Для этого на основе экспериментальных данных создается компьютерная модель, которая учитывает действие множества факторов. Полученные таким образом предсказания о ходе основных клеточных процессов могут использоваться в борьбе с препятствиями человечества на пути к долгой и здоровой жизни.
Lavrik I. N., Golks A., Krammer P. H. Caspases: Pharmacological manipulation of cell death // J. Clin. Invest. 2005. V. 115, N 10. P. 2665—2672.
Krammer P. H., Arnold R., Lavrik I. N. Life and death in peripheral T cells // Nat. Rev. Immunol. 2007. V. 7. P. 532—542.
Green D. R. and Kroemer G. The pathophysiology of mitochondrial cell death // Science. 2004. V. 305. P. 626—629.
Апоптоз раковых клеток что это такое
В последнее десятилетие в самостоятельную форму гибели клеток выделен апоптоз. Его находят в опухоли как до, так н после лечения. Для апоптоза характерно поражение отдельных клеток, отсутствие воспалительной реакции в тканях, быстрый фагоцитоз и переваривание погибших клеток.). Изменения клеток при апоптозе заключаются в маргииации хроматина и его распаде на фрагменты, конденсации цитоплазмы, разделении клетки на части с отделением последних в виде апоптотических тел. Считают, что при апоптозе происходит активация механизмов саморазрушения вместо процессов дегенерации, как это происходит при некрозе. Факторы, вызывающие апоптоз клеток, и его механизмы исследуются, но установлено, что радиация, гипертермия и химиотерапия опухолей ускоряют процесс.
Лечебные воздействия меняют гистофизиологию опухоли, пролиферацию (деление), дифференцировку и рост клеток, их соединение и перемещение, интенсивность специфического функционирования (если оно сохранилось), способность к клеточной и тканевой регенерации, чувствительность к влияниям внешней среды и др.
Пролиферативная способность клеток опухоли не только мишень для изыскания новых лекарственных химиотерапевтических средств и совершенствования известных методов лечения злокачественных новообразований, но и достоверный непосредственный морфологический критерий эффективности терапии, а также один из ведущих показателей степени патоморфоза.
Как известно, с точки зрения пролифератнвной способности опухолевая и нормальная ткань состоят из двух субпопуляций клеток пролиферируюшей (фракция роста, пролиферативный пул) и покоящейся. Последнюю образуют клетки, временно выходящие из клеточного цикла и сохраняющие способность делиться (фаза G0), а также непролиферирующие клетки. Ионизирующее излучение, особенно лекарственные химиотерапевтические средства, действует в основном на фракцию роста, т. е. на все быстрорастущие опухоли, в которых большая часть клеток находится в состоянии пролиферации (например, лейкозы, лнмфосаркомы, хорионэпителиома матки, саркома Юинга), являются высокочувствительными к хнмиотераневтическим воздействиям и облучению.
Многочисленные исследования клегочного цикла в опухолях представляют интерес с двух точек зрения. Во-первых, информация о клеточном цикле необходима для понимания природы опухолевого роста. Во-вторых, с детальным знанием закономерностей клеточного размножения в опухолях связана выработка оптимальных схем лучевой и химио терапии опухолей. Основным методом определения параметров клеточного цикла является анализ изменения процента меченых митозов после введения Н тимиднна. Радиоавтография, как никакой другой метод, «оживила» морфологию и способствовала превращению последней из формально динамичной какой она была до сих пор в действительно динамичную. Но, вместе с тем серьезным недостатком радиоавтографин регистрируемой на уровне световой микроскопии, является то, что она относит центры интенсивного синтеза вещества целиком к ядру или к цитоплазме, а не к тем органеллам, в которых они в действительности осуществляются.
Кроме того, современные технические возможности ограничивают использование метода в клинике из-за его длительности, необходимости повторных биопсий и возможности вредной действия иютопа на больного. Несмотря на ограничения метода, удалось получить данные о длительности разных фаз клеточного цикла в некоторых опухолях человека. Большую практическую значимость приобрел метод инкубации биопсийного и операционного материала в среде с Н-тимидином in vitro, с помощью которого определяют индекс метки. равный отиош(нию меченых клеток к общему количеству клеток, умноженному на 100. Данные разных авторов для различных опухолей и даже для различных участков одною и того же новообразования часто значительно расходятся, что связывают во многом с погрешностями метода. Поэтому для получения достоверных результатов, приходится исследовать несколько кусочков ткани. Метод радиоавтографии in vitro успешно используется для контроля лечения опухолей. Приведем 2 примера.
Митотический режим аденокарцином прямой кишки при различных методах предоперационного облучения изменяется следующим образом. В необлученной высокодифференцированной аденокарциноме митотический индекс составил 25,6%, в умереннодифференцированной — 35,2%. Определялось преобладание метафаз (78,9% — в высокодифференцированной и 70,2% — в умеренно дифференцированной аденокарциноме) над другими фазами мнтоза, что является характерным для опухолей человека.
Патологические митозы составили 29,3% в высокодифференцированной и 23,2% в умеренно дифференцированной аденокарциноме (отставание хромосом в метафазе, рассеивание хромосом, трехгрупповая метафаза и др. ).
После облучения происходит достоверное уменьшение уровня митотической активности и увеличение числа патологических митозов. В высокодифференцированной аденокарциноме после облучения дозой 20 Гр митотический индекс снижен до 15%, а процент патологических митозов увеличен до 86,7, в умеренно дифференцированной аденокарциноме — до 29,4% и 61,2% соответственно. При дозе 40 Гр митотическая активность в высокодифференцированной аденокарциноме равна 46% в умеренно дифференцированной — 7,2%0, а процент патологических митозов увеличился соответственно до 91,3 и 100. Особенно резкие изменения пролиферативиой способности клеток наблюдали при комбинации лучевой и химиотерапии.
Исследован митотический режим рака гортани при лучевом лечении с применением радносенсибилизатора метроиидазола. Лучевые изменения характеризовались уменьшением численности клеточной популяции за счет некроза и апоптоза, снижением пролиферативного пула клеток, патологическими митозами и угнетением синтеза ДНК. Так, до лечения индекс метки составлял 6,05 ±0,40 (неороговевающнй рак 7,33 ±0,74, ороговевающий рак 5,0±0,44), после лечения — 2,50±0,46 (Р>0,001) (неороговевающнй рак 3,24±0,69, Р>0,01; ороговевающий рак — 1,60 ±0,06; Р>0,001). При сравнении разных суммарных очаговых доз достоверных отличий величии индекса метки ие отмечено (20 Гр — 2,70±0,70; 32 Гр — 2,35 ±0,66).
Необходимо заметить, что достоверность результатов измерений у одного больного (разные участки центра и периферии опухоли до и после лучевой терапии) и группы больных совпадали не всегда Например, низкий индекс метки можно было встретить в ороговевающем раке до лечения и в обоих гистологических типах рака после лечения. Поэтому вопрос о значимости параметров пролиферации для оценки радиочувствительности опухоли нельзя отнести к окончательно решенному.
СИСТЕМНОЕ ПРОВОЦИРОВАНИЕ АПОПТОЗА В ОНКОКЛЕТКАХ КАК СПОСОБ МАКСИМАЛЬНОГО ПОВЫШЕНИЯ ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ ОКНКОЗАБОЛЕВАНИЙ
Апоптоз – наиболее перспективное направление в лечении онкологии
На сегодняшний день верность этого утверждение не вызывает никаких сомнений у ученых. Апоптоз в природе очень распространенное явление, это самоотмирание больных и не нужных организму клеток. Для этого в каждой клетке имеются программы и механизмы для их естественного отмирания. Отработавшие клетки эпидермиса на коже постоянно слущиваются, а на их место приходят новые поколения таких же клеток. Апоптоз задуман природой и это нормальный процесс ухода одних клеток и прихода на их место новых молодых. Но онкоклетки имеют особенность не подчиняться режиму апоптоза. Онкоклетки непрерывно размножаются без отмирания предшествующих.
Рассказывался опыт его успешного применения в лабораторных условиях и на животных.
Но в условиях in vivo, то есть всего организма первые наблюдения его применения над волонтерами показали размытость его действия. Наличие положительных подвижек есть, но нет радикального, универсального, полного действия. Препарат работает, но что-то мешает ему раскрыть свои потенциальные свойства до конца. Это заставляло задуматься и предположить, что здесь он выступает в каком-то сотрудничестве, системе, а не сам по себе.
Было сделано предположение, что он переводит стволовые клетки опухолей в доброкачественные и тормозит онкопроцесс. Но наблюдения показывали, что при месячном и более курсах его приема воспалительные процессы в опухоли оставались. Значит замедленная жизнедеятельность крупной опухоли сохранялась. Но опухоль при этом не так быстро росла и меньше давала почки. Следовательно, до конца до кондиции апоптоз в опухоли не доводился. Что мешало ему?
Что за ступени, звенья, по которым надо провести линии онкоклеток, чтобы запустить в них полностью развернутый апоптоз?
Поначалу выдвинуто было предположение значения витамина Д в роли проапоптанта или обладающего апоптозоподобным действием. Но в итоге сделан вывод, что он несет функции дифферетанта.
Дальнейший анализ показал, что и этого мало, чтобы в полной мере разжечь, запустить в онкоклетках апоптоз. Здесь опять чего-то не хватает.
Оксигенанты – незаменимые компоненты запуска механизма апоптоза
В последующем было показано, что её эффективность действия в роли оксигенанта резко повышается в препарате Дихлорацетат натрия (ДХА). Механизмы их действия на активацию работы митохондрий схожи, но ДХА значительно сильнее первой. С внедрением её в практику появился значительный прогресс в онкологии и понимания её механизмов. Прошли годы, но практика все же показала, что и ДХА даже в сочетании с янтарной кислотой не решает глобально проблему и они являются лишь частью какого-то более сложного единого механизма, который предстоит еще раскрыть. К тому же чтобы достигать проявленных выраженных положительных эффектов, необходимо повышать дозы её применения, которые в свою очередь становятся не безвредными. Радикального решения проблемы это направление не смогло проявить само по себе. Но стало ясно, что оно является какой-то частью более общего механизма. Её действие надо как-то оптимизировать.
Похоже предварительно, перед форсированием митохондрий, необходимо подготовить мотор, «прогреть» его. Выдвинуто предположение, что здесь на этом подготовительном этапе поможет просто янтарная кислота и ряд интермедиатных кислот как аскорбиновая и лимонная. Это позволит запустить псевдоаэробную энергетику за пределами митохондрий, то есть вне её пределов. Такая псевдоаэробность «разогреет» митохондрии и запустит синтез ими нужных ферментов-катализаторов. Это объясняет почему дополнительно надо принимать ЯК, а также почему надо сочетать приём обычной ЯК с ДХА, причем в дозах выше чем ДХА. В данном случае ЯК будет играть роль энергетического аэробного субстрата клетки.
Интермедиатные кислоты – попутчики-усилители янтарной кислоты
Онкоклетка буквально настроена на энергетику за счет глюкозы, которой она использует в 8 раз больше чем любая здоровая клетка. При дефиците глюкозы и подмене части поступающей глюкозы на дегидроаскорбиновую кислоту, онкоклетка воспримет ее как глюкозу, так как по химической формуле они схожи. В итоге это резко поменяет гликолизный статус онкоклетки, метаболизм её начнет «штормить» и в итоге её отшатнет в сторону аэробного метаболизма вне митохондрий. В итоге такая больная онкоклетка на длительный период перейдет на псевдоаэробизм, для которого присущи свои только ферменты. Именно они и начнут запускаться, будучи отключенными до этого времени. Физиология онкоклетки на долго изменится. Это и создаст условия для более сильного форсирования стартерных механизмов по запуску митохондрий.
Запущенные вынужденно митохондрии конечно не смогут полностью вернуться в исходное состояние. Для этого надо запустить полноценные механизмы репарации. Это связано с нарушенными программами в геноме ядра клетки. Восстановить свою активность в полном объеме митохондрии не смогут быстро. «Зависшие» программы генома ядра в этих процессах не участвуют. Митохондрии так и останутся не управляемыми, то есть автономиями без взаимодействия с центром. Поэтому, благодаря предлагаемому аэробогеннному субстрату и «стартерных» веществ, в митохондриях запуститься процесс «холостого хода», чего вполне достаточно, чтобы запустить собственные митохондриальные программы и механизмы. Этого вполне достаточно, чтобы позволить запустить восстановление, репарацию в них сенсорных чувствительных механизмов и деятельность интегральных белков, позволяющих митохондриям вернуться в исходное временное состояние, положение, когда она способна запускать программы на апоптоз.
Разгадку механизма слабой эффективности апоптантов надо искать здесь.
ДХА – способ повышения энергетики онкоклеток и запуска отключенных механизмов апоптоза
В книге Гарбузова Г.А.: «РАК. ТЕХНОЛОГИЯ ИСЦЕЛЕНИЯ» подробно разбирается весь накопленный опыт значения этого вещества относительно онкологии. Из всех известных методов лечения рака, предложенная автором комбинация является одной из самых перспективных и эффективных. С учетом того, что основные из предлагаемых здесь препаратов сами по себе обеспечивают до 50% эффективности, совместный их эффект должен быть намного выше. Ничего подобного официальная медицина предложить пока не может, особенно на запущенных стадиях заболевания.
Такой ракурс всей анализируемой информации и опыта применения разных препаратов в лечении онкологии в условиях целого организма показал их неспособность проявлять в полной мере свой потенциал, но могут его проявлять в преломлении через другие механизмы и программы клеток.
Системный подход в создании технологии проявлении апоптоза в онкоклетках
Как говорится: максимум эффекта, минимум побочки. Ведь это запуск естественного механизма самоотмирания больных клеток, который предложен природой.
Ряд терминов предложены автором впервые. Такое обозначение крайне важно, чтобы обозначить как группу веществ, так и направление, в котором они работают.
Все они звенья единой интегральной системы, механизма, в котором нехватка хотя бы одного звена не позволяет запустить механизм в целом.
Но всё, что они могут в высших здоровых клетках, не проходит в онкологических, где происходит зависание или сбрасывание этих программ более первичными, устойчивыми, примитивными программами онкоклеток. Такое сбрасывание связано со структурными перестройками в механизмах клеток и вторичными хромосомными аберрациями. Онкоклетка имеет сквозную перестройку в сторону упрощения на всех её уровнях, начиная с исчезновения цилий и ряда сенсорных дисплеев на внешних мембранах, продолжая через дезинтеграцию внутренних структур, снижения ОВП (минусового биопотенциала), утраты единого внутриклеточного электроконтура, утраты интегральных систем и интегральных белков, развал системы ГЛОНАСК, исчезновения электромагнитного каркаса, отключения митохондрий, а в пределах ядра клетки «вырубания» ряда высших программ в хромосомах.
Если использовать эти методы по отдельности, то они будут чаще стимулировать, активировать пролиферацию онкоклеток, содействовать механизмам их промоуции. Но когда искусственно удерживается одновременно активация всех разрозненных механизмов в единую ударную силу, возможности онкоклеток резко ослабевают чтобы противостоять этому натиску.
Когеренторы (сихронанты)
Все органеллы в клетке замкнуты в единый электрический контур через систему интегральных белков. В онкоклетках происходит расконтуривание всех систем клетки, их дезинтеграция и автономизация. Функциональные возможности таких клеток резко ограничиваются. Но наибольшая рассинхронизация происходит на уровне генома. Мелатонин действует как синхронизатор, интегратор на всех уровнях организма, в том числе и на уровне клеток и их генома. Он проявляет заметное противодействие особенно в гормонозависимых опухолях.
Мелатонин похоже является не только носителем функции синхронизатора химических процессов, обеспечивающих здоровую энергетику клетки (тип энергетики), но и резонатором для этого. Очевидно интегральные белки (ИБ) резонируют с ним и подстраивают систему, корректируют нарушенную, сдвинутую энергетику.
Матуранты
Каротиноиды в роли матурантов
Они же предотвращают хромосомные мутации. Соучаствуют в генетических программах уничтожения раковых клеток. Проявляют тормозящее действие на механизмы деления клеток. Подавляют онкогены. Тормозят развитие воспалительных процессов, которые приводят к дегенеративным заболеваниям.
Клеточное взаимодействие
Сохранение фенотипа специализированных клеток
Однако применение самих по себе матурантов в области онкологии не эффективно, но их значимость существенно возрастает в комплексных комбинациях.
Оксигенанты
К огсигенантам, очевидно относятся и методы подачи минусовых зарядов в клетки, например, с помощью «живой» воды, люстры Чижевского. Они заряжают среду вокруг клеток и повышают биопотенциалы на мембранах клеток и тем самым способствуют повышению накачки кислорода в клетку.
Итак, нами предлагается инновационная комбинация, которая должна запустить более глубоко и быстро процесс апоптоза. Без этого такой процесс может самотормозиться или быть слабо проявленным, невыраженным или скрытым.
Витамин Д – важнейший компонент, усиливающий запуск апоптозных механизмов в опухоли
Витамин Д – дифферетант и ключ регулировки контролирующий пролиферацию на клеточном уровне, что также противодействует и самостимуляции роста опухолей
Витамин Д оказывает мощное модулирующее действие на иммунную систему, а дефицит витамина Д может вызывать системный воспалительный ответ, который является основным компонетом предрасположенности к опухолям. Он действует как на нижнем этаже регулировки, то есть на клеточном уровне, а также на верхнем этаже регулировки, в т. ч. и на уровне эпифиза. Через него он влияет на серотониновый рычаг мелатонино-серотонинового маятника. А это в свою очередь определяет состояние всего гормонального фона, а значит и весь спектр гормональных сбоев, которые определяют ведомые эпифизом гипоталамус и гипофиз. На всех уровнях он стоит заслоном к проявлению провоспалительной предонкологии, гормональных перекосов, в т.ч. эндометриоза и других опухолеподобных перерождений, да и гормонозависимых опухолей. В дальнейшем он участвует в проявлении острых провоспалительных процессов, особенно на далеко зашедших этапах развития опухоли.
Кроме того, витамин Д также регулирует процесс апоптоза. В теле человека ежедневно умирает 50-70 миллиардов клеток. Они в свою очередь должны быть поглощены макрофагами или клетками соседями. Самое главное, что при этом процесса воспаления не происходит, поскольку это естественный процесс и регулируется он системами апоптоза, в которых напрямую участвует и витамин Д. Воспаление характерно только для процессов с дегенеративным и онкологическим исходом. В случае разгорания онкологического процесса действие витамина Д становится слабее чем программы онкоклеток и ему надо мощно помогать, только тогда он запустит процесс апоптоза и в онкологических клетках.
Витамин Д в роли прогормона
Подсчитано, что повышение концентрации гормона 1,25(ОН)2D в крови на каждые 25нмоль/л снижает риск заболеть раком на 17%.
Важнейшее свойство витамина Д — это способствовать поглощению кальция через кишечник в кровь и из неё в кости. Но, как известно, при опухоли на стадии прогрессии кальций наоборот вымывается из костей в кровь и приводит к гиперкальциемии. Значит действие витамина Д и жизнедеятельность опухоли противоположно направленные.
Очевидно, сам по себе витамин Д не сможет «сбить» сверхвысокий уровень кальция. Природу опухоли ему не изменить, но несколько понизить её активность очевидно может. Возможности его при опухолях слабы. Восстановить программу ему не дано. При сломанных высших программах специализации прима-программой становится протопрограмма. Восстановить эти зависшие высшие метапрограммы ему удастся. На опухолевые клетки в качестве клеточного гормона он не проявит свои возможности через ядерные рецепторы, но в качестве витамина-фермента он будет вмешиваться в клеточный метаболизм и не выпускать кальций из клетки. При завышенных его дозах можно так сбалансировать его действие, что жизнедеятельность онкоклетки станет не совместима с жизнью, выйдет за параметры оптимального для неё существования. Ведь за кальцием в клетку потянется и кислород, а это не подходит для режима онкоклеток. Они становятся намного слабее, не устойчивыми и легче запускаются программы апоптоза с помощью ретиноидов.
Процесс апоптоза, очевидно многогранный процесс и регулируется с разных уровней
Мы ожидаем, что мощный союз предложенной комбинации веществ будет более эффективно выводить опухоль из оптимального режима для нее существования, ослабит её устойчивость и облегчит её «расстреливание» другими веществами. Ведь витамин Д тоже апоптант, но для своего действия он должен получить команду от предшествующих ему процессов. Создается впечатление, что он более универсальный апоптант для большинства типов клеток. Но он доводит до конца уже запущенный, но не законченный процесс апоптоза. То есть клетки должны быть в предапоптозе и только затем они смогут быть доведены до полного апоптоза. Такими, очевидно, могут быть крупные солидного типа опухоли, которые в большинстве случаев сами не могут пойти до конца по пути апоптоза. Жизнедеятельность их застывает, но не обрывается полностью. Их надо выключить через апотоз с помощью гормона Д.
Витамин Д и каротиноиды – единая система поддержания клеток на высоком дифференциальном уровне
Дифферетанты первого и второго уровня регулировки
Дифферетанты могут быть специфические, то есть работающие на верхнем гормональном уровне регулировки и неспецифическими, работающими на уровне клеточно-тканной регулировки. По сути это тоже гормоны, но гормоны второго порядка. Это более универсальные гормоны, действующие на большее количество видов и клеток и тканей. Возможно это гормоны предподготовки, которые обеспечивают большинство клеток и тканей к дальнейшему уровню специализации. Это первый этаж специализации и дифференциации, является платформой, почвой для возможности реализации последующих надстроек. В свою очередь если первичная база, плацдарм слабы, то ограничены возможности для вторичных этажей пирамиды строения организма. Гормоны высшего уровня регулировки действуют только на гормонозависимые органы мишени.
Напомню, что медики обычно при онкологии стараются заглушить высшие уровни гормональной регулировки, чтобы остановить стимуляцию железы подвергнутой онкологии. Но надо понимать все по-другому: необходимо усилить слабую платформу, то есть первичную гормональную регулировку. Это усилит устойчивость ткани и её предрасположенность к онкологии.
Очевидно витамин Д и каротиноиды (витамин А) не просто союзники, а рычаги одной системы регулировки на генном уровне противостояния высокоспециализированной клетки к факторам её воспаления, деспециализации, дегенеративного перерождения и онкологизации. Причем каждый из них специализируется на своей функции в клетке, обеспечивает свою сторону процесса. Витамин Д затягивает кальций в клетку и делает её более аэробно работающей, а каротиноиды отвечают за создание и сохранение специализированных структур и функций в клетке. Они два рычага одной маятниковой системы регулировки клетки: в одних случаях в первую очередь надо удерживать высокую аэробную энергетику клетки, а в другом надо поддерживать дифференциальные функции клетки. Один из этих факторов регулировки не может полноценно работать без достаточной мощи противоположного фактора. Возможно с этим связаны ограниченные возможности воздействия на онкоклетки односторонним воздействием. Можно утверждать, что действие ретиноидов многократно усилится при одновременном воздействии на онкоклетки витам. Д. Каждый из них корректирует действие другого. Таким образом, эта пара лежит в основе универсального механизма удерживающего на плаву функции специализации и функциональной работоспособности клетки.
Напомню, что витамин Д одновременно является как витамином, так и клеточным гормоном. Именно недостаточность его в роли гормона и является предрасполагающим фактором к различной предонкологии. Это является причиной резкого повышения заболеваемости раком современных людей.
Гормональная (некальцемическая) сторона действия витамина Д
Витамин Д раскодировщик генной информации
Около 3% ядерных рецепторов чувствительны к нему и реагируют на него. Это говорит о какой-то глобальной значимости его в генетических многочисленных процессах раскодировки. Кальциферол участвует в раскодировании информации, зашифрованной в ДНК и РНК, что имеет большое значение в синтезе белковых соединений и многих биологически активных веществ небелкового ряда.
Витамин Д сотрудничает с теми же ядерными рецепторами, что и ретиноиды
В итоге этот комплекс (1,25(он)2D в3-РДР-ретиноевой кислоты х рецепторный комплекс) связывается с генным локусом отзывчивости на витамин Д, связывается с ним, в результате чего проявляется действие гена отзывчивого к витамину Д.
Обращаю внимание на взаимодействие витамина Д с ретиноидом на генном уровне. Многие биологические реакции проявляются при их взаимодействии. При инкубации различных типов клеток с прогормоном витамина Д происходило не только ингибирование их пролиферации, но и стимуляция дифференциации их в зрелые макрофаги.
Исследования были продлены на людях, с целью, чтобы определить может ли это вещество (подобное витамину Д (1,25(он)2D и3) быть использовано для лечения лейкемии. Эти исследования дали неутешительный результат, поскольку препарат вызвал тяжелую гиперкальциемию (вымывание кальция в кровь) и, хотя у некоторых из пациентов отмечались ремиссии, все в конце концов умерли. Следовательно, это подтверждает, что возможности и сила онкологических клеток была сильнее, чем действие этого препарата. Очевидно он в таких условиях только усиливал вымывание кальция, хотя частично и ослаблял пролиферацию.
Вещества из группы витамина Д и их многогранный гормоноподобный спектр действия
Выявлено их лечебные возможности при псориазе, стимуляцию продукции инсулина, модуляция активированных Т-И в-лимфоцитов и их, воздействие на сократительную способность миокарда, профилактика воспалительных заболеваний кишечника и усиление секреции тиреотропного гормона.
Роль дефицита витамина Д в риске развития рака
Есть доказательства, что люди, живущие в более северных широтах, имеют более высокую смертность от рака, по сравнению с людьми, которые жили в южных широтах. Это и рак кишечника, молочной железы, простаты лейкемий, рака головного мозга, яичников и др. Их связывают с дефицитом витамина Д. Исключение только для случаев с раком кожи. Мужчины южных широт если и заболевают раком простаты, то в значительно поздние периоды, мужчин северных широт. Применение витамина Д сдерживало заболеваемость раком.
Данные показали, что в случае с раком толстой кишки каждое увеличение содержания витамина D в крови на10 нг/мл серьезно снижало риски развития этой злокачественной опухоли.
Возможные механизмы витамина D в профилактике рака, сердечно сосудистых и аутоиммунных заболеваний, в том числе рассеянного склероза
Известно, что выработка витамина Д в южных регионах намного выше, так как там больше и ультрафиолетовых лучей. Именно такой высокий уровень на юге витамина Д и объясняет на много меньшую заболеваемость здесь этими заболеваниями.
Таким образом, дефицит витамина D и снижение воздействия солнечными УФ лучами увеличивает риск многих распространенных видов рака, сахарного диабет 1 типа, ревматоидного артрита, рассеянного склероза, и возможно диабета типа 2 и шизофрении.
Соединение витамина Д с витамин-Д связывающим белком в макрофагах приводит к индуцирующему ими эффекту апоптоза раковых клетках груди.
Рекомендации и дозы применения витамина Д
Обычно врачи рекомендуют дозы витамина Д3 от 1000 до 2000 МЕ на каждые 12 килограмм веса тела. Но в случае необходимости предотвратить или замедлить рост раковых клеток уровень витамина Д3 крови поддерживают в диапазоне 80-100 Нг/мл.
Лучшие поставщики витамина Д
Казалось бы, солнечного света хватает всегда, но у большинства людей и тем более онкобольных отмечается острый дефицит витамина Д. Витамин Д вырабатывается только при прямых солнечных лучах, то есть в обеденное время. Кожа тела при этом должна быть оголена хотя бы на половину. Норму витамина можно получить за 15 минут, но онкопациентам рекомендуется ежедневно быть на свету больше, вплоть до 3-4 часов в день. Избегать солнца нельзя. Только хроническое чрезмерное пребывание на солнце не показано онкобольным.
Оксигенанты в роли веществ, препятствующих росту онкоклеток
Чем отличаются оксигенанты от антиоксидантов
Антиоксиданты несут роль больше предотвращения окисления радикаловыми окислителями. Но они в определенной форме тоже частично проявляют функции оксигенантов, но значительно слабее и поэтому почти не подменяют их.
К типичным оксигенантам относится янтарная кислота, да и ряд других интермедиатных кислот как лимонная и другие.
Возможности минусовых зарядов и катионидов в роли оксигенантов
При определенных потенциалах и в разных случаях метод почему-то действует по-разному. Чего-то в нем не хватает. Очевидно в большинстве ситуаций программы на пролиферацию (а точнее промоуторные программы самостимуляции на неограниченный рост) онкоклеток на много сильнее того, что позволяет сделать метод повышения ОВП и соответственно его возможности в роли оксигенанта и антиоксиданта. В этом случае похоже слабые ОВП и даже сильные его уровни только усиливают действие промоуторного действия онкогенов. Происходит подстегивание пролиферативного его действия, а не противоположное действие на угнетение его. Для этого нужно какое-то сочетание с дифферетантами, которые подавляют независимость, автономность онкогенов. В таком сочетании оксигенанты смогут проявить свое противоположное действие, будут активировать это крыло, но уже на уровне повышения аэробной энергетики. Любая активация энергетики онкоклеток, пусть даже с уклоном в аэробном направлении, только стимулирует рост онкоклеток. Онкоклетки способны существовать легко на двух типах энергетики: аэробной (вернее аэробоподобной) и анаэробной, то есть гликолизной. Как только аэробные условия уходят онкоклетки опять легко возвращаются на полный гликолиз. В условиях отсутствия дифферетантов оксигенанты работают на ускорение анаэробной энергетики, а в присутствии дифферетантов способствуют усилению аэробной энергетики. В обоих случаях оксигенанты не остаются безучастными.
Таким образом, такая концепция дает больше оснований рекомендовать применение метода повышения ОВП в онкоклетках, но обязательно только на фоне применения дифферетантов. Один метод позволяет проявиться скрытым возможностям другого метода.
Познакомиться с этой методикой можно подробно в моей инструкции: «Метод лечения рака путем повышения электропотенциала».
Возможности куркумина в подавлении раковых клеток
Куркумин желтое вещество находится в куркуме. Похоже, что это не просто мощный антиоксидант полифенольной группы веществ, а также противовоспалительное средство, но и способствует подавлению роста опухоли. Описан случай положительного действия его при саркоме. Делает это он за счет проявления ареста митозов в онкоклетках. Торможение клеточных циклов индуцирует апоптоз онкоклеток. Это в свою очередь тормозит колониальный рост клеток саркомы Юинга и тормозит образование с`олидного разрастания. Накоплен уже предварительный опыт исследований как в культуре ткани, так и в клинике. Это позволяет уже тоже рекомендовать этот порошок в комплексных программах лечения онкологии, например, молочной железы, лейкемии и саркомы. Куркумин участвует в запуске каспазного цикла – основного механизма апоптоза.