Ассоциированный хеликобактер пилори что это
Бактерия хеликобактер пилори
7 февраля 2018
Многие желают узнать, как передается и лечится хеликобактер пилори – опасная бактерия, живущая в желудке, виновница хронического гастрита, эрозий, язв и даже рака желудка.
Что это за бактерия?
Как же воздействует хеликобактер на желудок? Уничтожает париетальные (пристеночные) клетки слизистой (внутренней) оболочки желудка, выбрасывая ядовитые продукты – токсины. Защитные клетки крови – нейтрофилы, лимфоциты и другие, преследуют вредителя, пытаясь уничтожить и его, и измененные париетальные клетки – возникает воспаление. Количество защитной слизи на участке пребывания бактерии заметно снижается, на измененный участок стремительно воздействует соляная кислота, усугубляя неизменное воспаление слизистой. Это проявляется болью в желудке «под ложечкой», изжогой, отрыжкой, налетом на языке, неприятным запахом изо рта, постоянной тошнотой, то есть симптомами хронического гастрита. Хроническое длительное воспаление слизистой оболочки желудка приводит к изменению ее клеток, вплоть до развития рака желудка.
Так что же теперь и в кафе со своей посудой ходить? К счастью, хеликобактер не устойчивая бактерия и обработки посуды в посудомоечной машине достаточно, чтобы ее уничтожить. Хорошие рестораны и кафе конечно оборудованы такими машинами, и посещать их можно без риска заражения.
Как узнать, есть ли у меня инфекция хеликобактер пилори?
У меня выявлен хеликобактер пилори – что делать?
При выявлении положительного анализа на хеликобактер пилори нужно обратиться за консультацией к гастроэнтерологу или терапевту. В лечении инфекции используются антибиотики, и назначает их только врач.
Можно ли вылечить хеликобактер приемом препарата де-нол, как показывают в рекламе, или народными средствами? Полностью избавиться от инфекции хеликобактер пилори можно только определенными антибиотиками.
Нужно ли мне травить себя антибиотиками, если меня ничего не беспокоит, а результат анализа на хеликобактер положительный? Инфекция может и не беспокоить, в 70% случаев так и происходит, гастрит годами протекает «молча», но через несколько лет вследствие вялотекущего воспаления возникает атрофия слизистой оболочки и нельзя исключить ее переход в рак желудка. В каждом конкретном случае решение о проведении лечения принимает лечащий врач.
Инфекция хеликобактер пилори очень распространена среди населения, есть ли смысл в лечении, если потом можно повторно заразиться? Да, повторное инфицирование возможно, но происходит не часто – примерно 6 человек из 100 пролеченных приобретают инфекцию вновь при несоблюдении правил профилактики. Они очень просты – мыть руки перед едой, не пробовать чужую еду, не есть в сомнительных забегаловках, где нет уверенности в правильной обработке посуды, не целовать не очень близких людей. Важно также при выявлении инфекции хеликобактер пилори проверить на нее всех членов семьи, начиная с подросткового возраста, и в идеале – пролечиться одновременно всем инфицированным. Детей, если ничего не беспокоит, лечат с подросткового возраста – с 12-13 лет. Если ребенок жалуется на боли в животе или тошноту, то обследование и лечение проводят по показаниям в более раннем возрасте.
Люди очень часто жалуются на обострение гастрита. А ведь во многих случаях его можно вылечить, избавившись от бактерии, которая вызвала воспаление желудка. Если инфекцию оставить без внимания, со временем, гастрит перейдет в атрофический. Тогда пациенту нужно будет минимум раз в год брать биопсию в 5-7 местах желудка, чтобы не пропустить рак.
Хеликобактериоз
Тел.: 8-800-25-03-03-2
(бесплатно для звонков из регионов России)
Санкт-Петербург, наб. реки Фонтанки, д. 154
Тел.: +7 (812) 676-25-25
Санкт-Петербург, В.О., Кадетская линия, д. 13-15
Тел.: +7 (812) 676-25-25
Санкт-Петербург, ул. Циолковского, д.3
Тел.: +7 (812) 676-25-10
Основные предполагаемые механизмы передачи:
Заболевания желудка и двенадцатиперстной кишки с установленной ролью инфекции H.Pylori
К заболеваниям желудка и двенадцатиперстной кишки, с установленной ролью инфекции относятся:
Гастрит
Судить о истинной эпидемиологии хронического гастрита достаточно сложно, что связано с необходимостью морфологической верификации и частым скрытым течением заболевания.
Вопреки распространенным заблуждениям среди населения и даже среди некоторых медицинский специалистов, хронический гастрит есть не у всех и не является «безобидным» заболеванием. В некоторых случаях на фоне хронического H.Pylori-ассоциированного гастрита могут бессимптомно протекать предраковые процессы, которые невозможно диагностировать без биопсии слизистой желудка. Своевременное выявление и лечение инфекции не только предотвращает их развитие, но и может обратить эти изменения.
Предраковые изменения и заболевания желудка, риск малигнизации (по Баранской Е.К., Ивашкину В.Т. 2002 с изм.)
*- красным выделены состояния, которые нельзя достоверно диагностировать без исследования биоптатов желудка.
У H.Pylori-ассоциированного гастрита, как правило нет явных и специфических симптомов, а меры по скринингу микроорганизма не предусмотрены планом диспансеризации в учреждениях здравоохранения.
Основным методом лечения является антибактериальная терапия с обязательным последующим контролем.
Язвенная болезнь желудка и двенадцатиперстной кишки
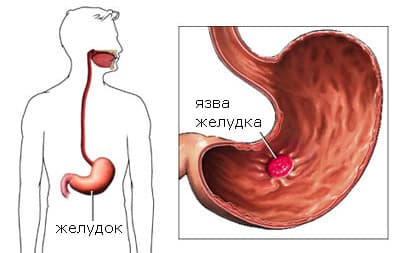
Язвенная болезнь относится к наиболее часто встречающимся заболеваниям ЖКТ. По данным клинических наблюдений, около 7-10% взрослого населения земного шара страдает или страдало этим заболеванием, при этом результаты паталогоанатомических исследований дают более высокие цифры, что свидетельствует о том, что у ряда больных заболевание протекает скрыто. Так, в клинической практике нередко бывает, что первым симптомом язвенной болезни является кровотечение, которое проявляется рвотой с примесью крови или потемнением стула. В особенности бессимптомное течение характерно для активных курильщиков.
Частота обнаружения H.Pylori на поверхности желудочного эпителия у больных язвенной болезнью ДПК довольно высока и, по данным разных авторов, колеблется на уровне 91- 100%. При этом выявляемость бактерии напрямую зависит от количества и качества применяемых диагностических методик. В тех случаях, когда формирование дефекта слизистой желудка и двенадцатиперстной кишки происходит на фоне приема нестероидных противовоспалительных препаратов (анальгетиков), также, чаще всего находят инфекцию.
Формирование язвенного дефекта обусловлено токсическим действием ферментов H.Pylori на слизистую желудка и связано с наличием у штамов фосфолипаз, муциназ, протеаз и уреазной активностью с одной стороны и особенностью иммунного ответа человеческого организма с другой, что в совокупности может привести к возникновению заболевания на фоне хронического гастрита.
Диагностика язвенной болезни:
Клиническая картина (симптомы и признаки заболевания). Главным клиническим симптомом является боль в верхней части живота характер которой зависит от размеров и локализации язвенного дефекта, сопутствующего воспаления слизистой оболочки желудка и двенадцатиперстной кишки, вовлечение в патологический процесс серозной оболочки, индивидуального порога болевой чувствительности.
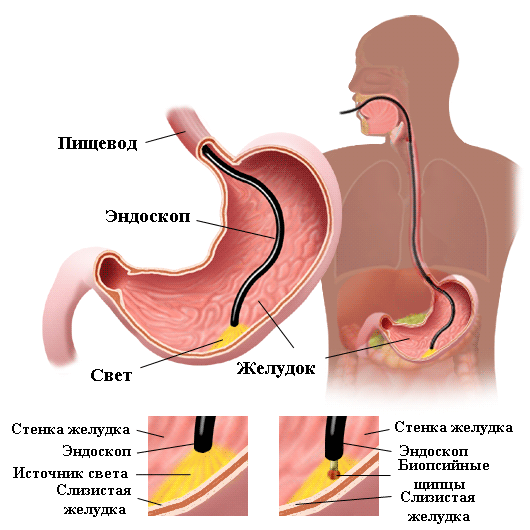
Ведущим методом диагностики наличия язвы гастродуоденальной слизистой оболочки является эндоскопическое исследование.
Анализ на H.Pylori является необходимой составляющей плана обследования больного с подозрением на язвенную болезнь или с выявленной язвой.
Аденокарцинома желудка
Аденокарцинома (рак желудка) представляет до 95% всех злокачественных новообразований желудка.
Выделяют два гистологических подтипа с различными эпидемиологическими и прогностическими характеристиками:
Эпидемиология
В настоящее время отмечается общемировой тренд снижения смертности от рака желудка. Однако не смотря на это РЖ находится на 4-м месте по частоте встречаемости среди всех злокачественных новообразований и на 2-м месте среди ведущих причин смертности от онкологических заболеваний (Parkin D.M. et al., 2001; Crew K.D. Neugut A.I. 2006). Во многом это обусловлено тем, что на ранних стадиях заболевание протекает бессимптомно, а план типовой диспансеризации в учреждениях здравоохранения не включает ни эндоскопическую диагностику, ни анализ на инфекцию H.Pylori.
Страны с высоким показателем частоты рака желудка одновременно характеризуются подобным уровнем распространения H.Pylori в популяции. При этом снижение показателя распространенности инфекции в развитых странах протекает параллельно уменьшению частоты рака желудка (Crew K.D. Neugut A.I. 2006).
*НПВП-нестероидные противовоспалительные препараты; **АСК-ацетилсалициловая кислота.
MALT-лимфома
MALT-лимфома — экстранодальная маргинальной зоны В-клеточная лимфома, ассоциированная со слизистыми оболочками представляет неходжкинскую лимфому, субстратом которой являются достаточно зрелые злокачественно трансформированные лимфоциты, происходящие из солитарных лимфоидных фолликулов слизистых оболочек.
В настоящее время H.Pylori рассматривается как основной каузативный агент заболевания, однако заболеваемость в мире невысока и составляет 1 случай на 30000-80000 инфицированных лиц.
Заболевания гастродуоденальной зоны с предположительной или аддитивной ролью инфекции
Экстрагастродуоденальные заболевания и состояния с установленной патогенетической ролью инфекции.
Согласно положению пятого Маастрихтского конценсуса, данным больным показана диагностика и лечение H.Pylori-инфекции.Прочие экстрагастродуоденальные заболевания и состояния, при которых патогенетическая роль инфекции исследуется.H. pylori имеет положительную и отрицательную связь с большим количеством других внегастродуоденальных состояний/заболеваний.
Этиология этих взаимосвязей не доказана.
Инфекция H. pylori и цитотоксин-ассоциированный продукт гена CagA(+) штаммов H. Pylori связаны с развитием атеросклероза. Выявлена взаимосвязь между H. pylori и некоторыми неврологическими заболеваниями (инсульт, болезнь Альцгеймера, болезнь Паркинсона). Однако этих данных недостаточно для установления четкой причинно-следственной связи или взаимосвязи с лечением. В ряде популяций между частотой инфекции H. pylori и распространенностью некоторых заболеваний, таких как бронхиальная астма и ожирение, выявлена обратно пропорциональная связь.
Также немалый интерес представляют данные выявившие, что корреляция между серопозитивностью к H.Pylori и преэклампсией была очень существенной с отношением шансов = 9,22. Такая ассоциация была еще более выраженной при течении беременности как с преэклампсией, так и с задержкой роста плода (ОШ=35,56). При этом наиболее высокий риск детерминировали штамы H. Pylori CagA(+) (Cardoropoli S. et al., 2011). Более того в другом исследовании было показано, что антитела против CagA могут перекрестно реагировать с бате-актином клеток цитотрофобласта, гипотетически объясняя вышеописанную клиническую ассоциацию (Franceschi F. Et al., 2012).
Диагностика инфекции H.Pylori
Методы диагностики инфекции можно условно разделить на инвазивные и неинвазивные.

Общим недостатком всех инвазивных методик является необходимость проведения эндоскопического исследования, которое показано не во всех случаях, а иногда бывает даже противопоказано. Гистологический и цитологический метод обладают абсолютной специфичностью (отсутствие ложноположительного результата), однако не самой высокой чувствительностью (вероятность истинно отрицательного результата), так как в исследуемом биологическом материале микроб может отсутствовать. Результаты бактериологического исследования (посев на питательной среде) также обладают высокой специфичностью, и позволяют проверить чувствительность микроорганизма к антибиотикам, однако чувствительность этого метода ещё ниже, так как микроорганизм требует особых условий забора транспортировки, наличия питательных сред и специально обученного персонала, что делает этот метод очень дорогостоящим.
Самое широкое распространение в нашей стране получил быстрый уреазный хелпил-тест, проводимый в время эндоскопического исследования. Согласно положению Маастрихтского соглашения V по диагностике H.Pylori инфекции его необходимо выполнять при эндоскопии и отсутствии противопоказаний к биопсии. В случае положительного теста, для уточнения характера поражения слизистой, необходимо взять биопсию из антрального отдела и тела желудка, что в условиях нашей практической медицины выполняется крайне редко. При этом хелпи-тест, выполняемый при эндоскопическом исследовании не рекомендуют для контроля после лечения, так как в этих случаях он не информативен (обладает низкой специфичностью и чувствительностью. Серологический метод основан на выявлении в крови антител к микроорганизму, обладает достаточно высокой чувствительностью для первичной диагностики. Однако не подходит для контроля эффективности лечения, так как высокий уровень антител может оставаться ещё на протяжении длительного периода после излечения. К тому же, информативность метода зависит от наличия в структуре микроорганизма того или иного антигена, который может встречаться не у всех штамов.
На практике приходится нередко встречать пациентов, у которых неправильно проводилась диагностика инфекции ввиду незнания специалистами применимости методик, что вызывает ложное мнение о невозможности излечения от инфекции не только среди обывателей, но и практических врачей.
Серологическое исследование кала на антиген к H.Pylori является высокоинформативным, однако зависит от вида циркулирующего в регионе микроорганизма, метод полимеразной цепной реакции на выявление нуклеотидных последовательностей микроорганизма в ряде наблюдений продемонстрировал много ложноположительных результатов и в настоящее время не рекомендован для применения.
Быстрый уреазный хелик-тест, который широко распространен в нашей стране, основан на регистрации прироста концентрации аммиака в выдыхаемом воздухе, при наличии уреазной активности хеликобактера, однако по ряду причин, в ряде рандомизированных клинических исследований продемонстрировал недостаточную чувствительность и специфичность (вероятность истинно положительного и истинно отрицательного результата), и в настоящее время не рекомендован для диагностики инфекции.
Согласно первому положению международных рекомендаций по диагностике H.Pylori (Маастрихт V) 13,14С-уреазный дыхательный тест является наиболее изученным и рекомендуемым неинвазивным методом в стратегии «тестируй и лечи». А согласно 10-му положению этого же соглашения данное исследование является наилучшим вариантом для подтверждения эрадикации (успешного лечения) H. Pylori. Методика активно используется в развитых странах, однако в России пока не получила широкого распространения из-за отсутствия газовых анализаторов для оценки 13СO2.
Он основан на изменении концентрации 13СO2 во выдыхаемом пациентом воздухе через 30 минут после приёма 13С-Карбамида по сравнению с базовой концентрацией 13СO2 (до приёма тест-раствора). В качестве метки используется нерадиоактивный и стабильный изотоп 13С. Меченный этим изотопом карбамид (мочевина) разлагается в желудке человека исключительно под действием уреазы – фермента, являющегося продуктом жизнедеятельности H.Pylori. 13СO2 с кровотоком попадает в легкие, откуда и эвакуируется с выдыхаемым воздухом. Концентрация 13СO2 напрямую зависит от количества бактерий Helicobacter pylori в эпителии желудка пациента.
Особенности 13С Карбамид-теста при диагностике Н.pylori-инфекции.
Основные этапы в исследовании инфекции H.Pylori
Автор статьи: Тряпицын Александр Валерьевич (врач-гастроэнтеролог, к.м.н.)
Хронический гастрит, ассоциированный с Helicobacter pylori
Хронический гастрит, ассоциированный с Helicobacter pylori (Хронический хеликобактерный гастрит) — воспаление слизистой оболочки желудка, возникающее под воздействием бактерии Helicobacter Pylori (хеликобактер пилори).
Helicobacter pylori (Н.pylori) — грамотрицательная микроаэрофильная бактерия, колонизирующая слизистую оболочку желудка и ассоциированная с атрофическим гастритом, язвенной болезнью желудка и двенадцатиперстной кишки, аденокарциномой и экстранодальной В-клеточной MALT-лимфомой желудка.
ИНСТИТУТ АЛЛЕРГОЛОГИИ И КЛИНИЧЕСКОЙ ИММУНОЛОГИИ располагает:
спектром услуг для точной диагностики заболеваний
специальными программами лечения
При выявлении сопутствующих заболеваний проводятся консультации со специалистами смежных областей (оториноларингологи, эндокринологи, неврологи, гастроэнтерологи, дерматовенерологи), консилиумы с Докторами медицинских наук.
Внимание! Helicobacter pylori является провокатором онкологических новообразований в ЖКТ.
Симптомы
Классификация
Хронический гастрит, вызванный Helicobacter pylori (К29.5)
Причины
Внимание! Helicobacter pylori может передаваться от одного человека другому при нарушениях правил личной гигиены!
Helicobacter pylori продуцируют высокоактивный фермент уреазу, каталазу, муциназу, которые приводят к изменению качественных характеристик желудочного сока. Helicobacter pylori при проникновении в пилорический отдел желудка, в котором присутствует высокое содержание мочевины, создает щелочную среду, превращая мочевину в аммиак, что приводит к запуску механизма патогенеза инфекции: деструктивные процессы на молекулярном, клеточном и тканевом уровне, цитотоксические эффекты, нарушение секреции, компенсаторные реакции желез, интенсивную воспалительную реакцию с преобладанием нейтрофильной инфильтрации и большим числом в слизистой оболочке плазматических клеток, продуцирующих IgA.
Диагностика
ИНСТИТУТ АЛЛЕРГОЛОГИИ И КЛИНИЧЕСКОЙ ИММУНОЛОГИИ располагает фундаментальной базой, позволяющей провести весь комплекс диагностических и лечебных мероприятий, соответствующих уровню международных стандартов. Многие из лечебно-диагностических методов разработаны сотрудниками нашего Института.
Диагноз устанавливается на основании клинической картины и анамнеза пациента, физикального исследования, лабораторной диагностики, эндоскопии (гастроскопия) и др. исследований.
При необходимости консультативную помощь Вам могут оказать смежные специалисты, опытные врачи, разрабатывающие новые методы диагностики и лечения в этих направлениях медицины.
Принцип действия основан на способности Хеликобактера пилори разлагать мочевину на аммиак и углекислый газ. Обследование на концентрацию аммиака в выдыхаемом воздухе позволяет определить наличие бактерий в вашем организме.
Уреазный дыхательный тест широко используется:
Уреазный дыхательный тест безвреден!
Методы диагностики инфекции H.pylori делятся на инвазивные, требующие проведения эндоскопического исследования, и неинвазивные. Объем и методы диагностики определяет врач-гастроэнтеролог.
Лечение
Лечение направлено на достижение ремиссии заболевания и предупреждение дальнейшего прогрессирования атрофии и развития осложнений
Подбор лекарственной терапии должен производиться индивидуально с учетом тяжести течения заболевания, наличия сопутствующих заболеваний, возраста пациента и риска возможных побочных эффектов.
Просим Вас не заниматься самолечением на основании данных сети Интернет!
Информационный блок для пациентов
Диета при хроническом гастрите
Данная диета носит рекомендательный характер, подбор диеты должен производиться индивидуально!
Продукты, которые можно включать в рацион питания:
Продукты, которые рекомендуется исключить из рациона питания:
Ассоциированный хеликобактер пилори что это
Хронический гастрит является наиболее распространенным заболеванием и занимает одно из первых мест в структуре заболеваний тракта. По оценке различных авторов, он встречается у 50–80% населения нашей страны [1, 2]. Открытие Н.pylori австралийскими учеными и в 1983 году явилось поистине революционным и вызвало невероятный прогресс в гастроэнтерологии. Современным интернистам это принесло «понимание того, что микроорганизм H.pylori является важным участником формирования таких патологических состояний, как острый и хронический гастрит, язвенная болезнь желудка и двенадцатиперстной кишки, рак и желудка» [3] и позволило выйти на разработку новых, более эффективных этиопатогенетических принципов лечения и профилактики этих заболеваний.
Helicobacter pylori (Н.pylori) — грамотрицательная микроаэрофильная бактерия, колонизирующая слизистую оболочку желудка и ассоциированная с атрофическим гастритом, язвенной болезнью желудка и двенадцатиперстной кишки, аденокарциномой и экстранодальной желудка. H.pylori является одним из самых распространенных возбудителей инфекционных заболеваний. Согласно некоторым оценкам, более половины населения мира инфицированы этим микроорганизмом. Инфекция H.pylori часто не имеет клинических проявлений. Только у определенной части инфицированных с течением времени развивается хронический атрофический гастрит и рак желудка. В 2005 году первооткрыватели бактерии — Робин Уоррен (Robin Warren) и Барри Маршал (Barry Marshall) — были удостоены Нобелевской премии по физиологии и медицине «за открытие бактерии Helicobacter pylori и ее роли в развитии гастрита и язвы желудка». Интенсивное изучение H.pylori показало, что у 80% больных, страдающих раком желудка, в анамнезе была зафиксирована инфекция H. pylori. Это явилось одной из причин, по которым в 1995 году Международная ассоциация по изучению рака (IARC, ВОЗ) признала H.pylori канцерогеном I класса.
Новые европейские рекомендации по инфекции H.pylori, представленные на очередном XXIV заседании Международной рабочей группы по изучению Helicobacter pylori и родственным бактериям при хронических воспалительных процессах пищеварительного тракта и раке желудка (XXIVth International Workshop on Helicobacter and related bacteria in chronic digestive inflammation and gastric cancer) 11–13 cентября 2011 года, были посвящены не только новым подходам к терапии, но и современным методам диагностики инфекции Н.pylori. Эти методы делятся на инвазивные и неинвазивные. Все инвазивные методы диагностики предусматривают проведение эндоскопического исследования с забором биопсийного материала — биоптатов слизистой оболочки желудка. Эндоскопическое исследование является одним из самых важных методов оценки слизистой оболочки желудка у пациентов с H.pylori ассоциированной патологией. Применение узкоспектральной эндоскопии в комбинации с оптическим увеличением изображения позволяет дифференцировать патологические изменения, которые при обычной эндоскопии не могут быть выявлены. Неинвазивные методы — это различного рода иммунологические исследования, позволяющие определять наличие антител в сыворотке крови или бактериального антигена Н.pylori в фекалиях, ПЦР исследование с определением ДНК Н.pylori в фекалиях и уреазный дыхательный тест с С13 или С14 меченным атомом углерода.
История открытия Helicobacter pylori
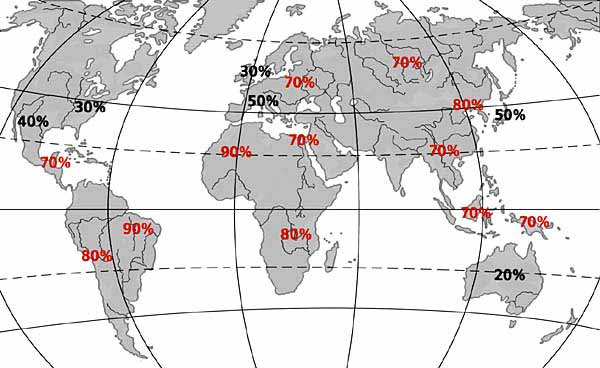
Таблица 1. Распространенность инфекции H.pylori и смертность от рака желудка в странах с различным уровнем
| Страна | Инфицированность H. pylori, % | Смертность (рак желудка) |
| Китай Россия и Япония | 80-100 60-80 | Более 30 человек на 100 000 населения |
| Алжир Коста-Рика Кот-Дивуар Нигерия Чили Эквадор | 75-95 | Более 30 человек на 100 000 населения |
| Австралия Бельгия Великобритания Израиль Канада Новая Зеландия США Франция | 4 5 9 15 13,6 5 23 20 | Менее 10 человек на 100 000 населения |
Приведенные данные свидетельствуют о более высокой заболеваемости раком желудка в тех регионах, где выше показатели заболеваемости H.pylori ассоциированным гастритом.
Современные методы лабораторной диагностики инфекции Helicobacter pylori
С момента открытия Н.pylori прошло чуть более тридцати лет. За этот период времени было разработано большое количество методов лабораторной диагностики, позволяющих выявлять и идентифицировать этот микроорганизм. Однако в настоящее время ни один из существующих методов лабораторной диагностики инфекции Н.pylori не универсален. Пределы возможностей этих методов могут быть ограничены не только их чувствительностью, но, зачастую, зависят от возраста пациента, его индивидуальных особенностей, стадии заболевания, а также индивидуальных особенностей течения инфекции. Все существующие на сегодняшний день методы лабораторной диагностики инфекции Н.pylori делятся на две большие группы: инвазивные и неинвазивные методы (табл. 2).
Таблица 2. Методы лабораторной диагностики инфекции Н.pylori
| Инвазивные методы | Неинвазивные методы |
| Бактериологический метод Гистологический метод Молекулярно-биологический метод (ПЦР) Фазово-контрастная микроскопия Быстрый Уреазный тест | Серологический метод Молекулярно-биологический метод (ПЦР) Уреазный дыхательный тест |
Принципиальное значение для практики имеет проведение диагностики Н.pylori инфекции до лечения (первичная диагностика), и после проведения противохеликобактерной терапии (контроль эффективности выбранной схемы лечения). Первичная диагностика Н.pylori инфекции должна осуществляться методами, непосредственно выявляющими бактерию или продукты ее жизнедеятельности в организме больного. Таким требованиям удовлетворяют следующие методы диагностики:
1. Бактериологический метод — посев биоптата слизистой оболочки желудка или двенадцатиперстной кишки на среду с целью выделения чистой культуры Н.pylori.
2. Дыхательный тест — определение в выдыхаемом больным воздухе изотопов С13 или С14, которые выделяются в результате расщепления в желудке больного меченой мочевины под действием фермента уреазы Н.pylori.
3. Быстрый Уреазный тест — определение уреазной активности в биоптате слизистой оболочки желудка или двенадцатиперстной кишки путем помещения его в жидкую или гелеобразную среду, содержащую субстрат, буфер и индикатор.
4. Гистологический метод — золотой стандарт диагностики Н.pylori инфекции и хронического гастрита.
Бактериологический метод является единственным методом исследования, обладающим 100% специфичностью. Он позволяет выделить чистую культуру Н.pylori, провести ее идентификацию, изучить морфологические, биохимические и биологические свойства бактерий. В эпидемиологической практике выделение чистой культуры Н.pylori необходимо для внутривидового типирования штаммов, что может быть использовано при мониторинге для дифференциации между реинфекцией новым штаммом и рецидивированием инфекции, которое может быть обусловлено тем же штаммом. В научной практике бактериологический метод важен, так как позволяет изучать факторы патогенности Н.pylori и изготовлять препараты для серологической диагностики. Как и любой метод диагностики, бактериологический метод исследования обладает не только достоинствами, но и недостатками, которые зачастую ограничивают его широкое использование в клинической практике. К недостаткам этого метода относятся, прежде всего, необходимость специального лабораторного оборудования, реактивов, специальных питательных сред, а также обученных специалистов. Все это сопряжено с большими материальными затратами. Результаты бактериологического исследования отсрочены от момента взятия биопсийного материала минимум на 3–5 дней, а при необходимости получения данных о чувствительности Н.pylori к антибактериальным препаратам длительность исследования увеличивается и составляет в среднем 6–7 дней. Кроме того, для проведения бактериологического исследования необходимо проведение эзофагогастродуоденоскопии с забором биопсийного материала.
Быстрый урезаный тест основан на определении в биоптате слизистой оболочки желудка местной уреазной активности H.pylori. Быстрота изменения окраски индикатора (с желтого цвета на красный или малиновый) зависит от уреазной активности, которая в свою очередь зависит от количества бактерий. К недостаткам теста относится его инвазивность, невозможность морфологической оценки состояния слизистой оболочки желудка, а также получение ложноотрицательных (при малом количестве микробных тел) или ложноположительных результатов (контаминирование материала другими уреазопродуцентами, например H.heilmannii — спиралевидной бактерии рода Helicobacter, которую возможно обнаружить у 0,25% пациентов при проведении гастроскопии [12]).
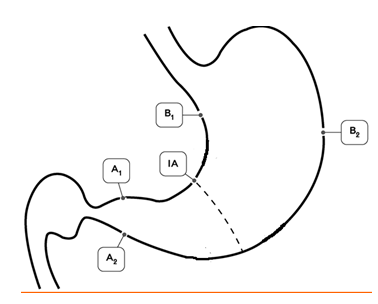
Гистологический метод — золотой стандарт диагностики инфекции H.pylori, который является наиболее объективным методом, так как позволяет обнаружить возбудитель инфекции, определить положение бактериальных тел в слизи, покрывающей слизистую оболочку желудка, наблюдать взаимоотношение Н.pylori с апикальной мембраной эпителиоцитов, а также определить пути взаимодействия бактерии с тканями макроорганизма (рис. 2). Забор биопсийного материала производится из зон слизистой оболочки желудка с признаками наиболее активного воспалительного процесса (максимально выраженная гиперемия и отeк). Биопсия и забор материала для диагностики инфекции из области дна язв и эрозий, а также из их краев, является ошибкой, так как в них нет эпителиальных клеток, обладающих свойствами, необходимыми для адгезии и колонизации Н.pylori. Поскольку бактерии Н.pylori могут быть распределены неравномерно в различных отделах желудка, для повышения чувствительности метода, а также для оценки состояния слизистой оболочки и определения типа и локализации гастрита, степени его выраженности биоптаты целесообразно брать из антрального, фундального отделов, а также области угла желудка (рис. 1).
Рисунок 1. Схема выполнения биопсии слизистой оболочки желудка с целью достоверной диагностики инфекции H.Pylori и гастрита в пяти зонах желудка: две биопсии — в антральном отделе (А1 и А2), две биопсии — в теле желудка (В1 и В2) и одна биопсия в зоне угла желудка (IА).
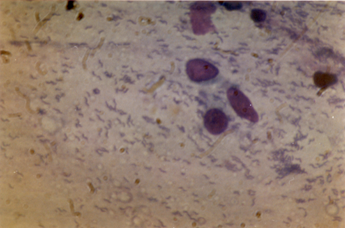
Рисунок 2. Диагностика инфекции Н.pylori при окраске гистологического препарата красителем акридиновым оранжевым, бактерии определяются в виде мелких, слегка извитых палочек, находящихся в слое слизи над поверхностью эпителия желудка в непосредственной близости от слизистой оболочки желудка и на поверхности эпителиальных клеток.
Классификация количественной и качественной оценки инфекции H. pylori, степени воспаления при гастрите, атрофии и кишечной метаплазии была предложена в Сиднейской системе и ее Хьюстонской модификации, однако эта система не позволяла оценивать прогноз повреждения. Современная классификация и оценка степени и стадии гастрита OLGA (Operative Link for Gastritis Assessment) основана на оценке стадийности и степени выраженности атрофического гастрита в фундальном и антральном отделах желудка [13, 14]. Под степенью гастрита понимается выраженность суммарной воспалительной инфильтрации (нейтрофильными лейкоцитами и мононуклеарными клетками), под стадией — выраженность атрофии. Чем выше выраженность атрофии и больше объем поражения слизистой оболочки желудка, тем выше риск развития неоплазии. Таким образом, новая система определения стадии гастрита OLGA обеспечивает определение прогноза развития предраковых изменений, позволяет клиницисту получить представление о распространенности повреждения слизистой оболочки желудка и степени риска развития рака желудка [15, 16].
В последние годы в клинической практике начал использоваться серологический скрининг заболеваний желудка, включающий определение в сыворотке крови антител класса G к H.pylori (.pylori IgG), пепсиногена I (РG1) и гастрина 17 (G17). Анти- H.pylori IgG являются наилучшим маркером наличия гастрита и обладают высокой чувствительностью и низкой специфичностью в диагностике атрофического гастрита. РG1 и G17 указывают на наличие атрофического гастрита с высокой специфичностью и низкой чувствительностью. Комбинация этих трех тестов (Гастропанель, Биохит, Финляндия) обладает высокой чувствительностью (83%) и специфичностью (95%) в диагностике атрофического гастрита [17]. В проведенном на базе Ярославской областной клинической онкологической больницы и Медицинском центре диагностики и профилактики (г. Ярославль) исследовании, заключавшемся в определении у больных ранним раком желудка и мультифокальным атрофическим гастритом, была обнаружена функциональная недостаточность слизистой оболочки тела желудка (низкий уровень PG1), полученные значения PG1 в этих группах пациентов были достоверно ниже по сравнению с группами больных антральным атрофическим и неатрофическим гастритами. Это свидетельствует о том, что сывороточный PG1 может рассматриваться в качестве маркера риска развития рака желудка. При атрофии антрального отдела желудка происходит снижение выработки постпрандиального G17. Серологический метод с определением G17, РG1 и анти H. pylori IgG может служить методом скрининга атрофического гастрита и рака желудка в крупнопопуляционных исследованиях ввиду его очевидных преимуществ — удобства и безопасности для пациента наряду с высокой эффективностью. Использование серологического теста для выявления предопухолевой патологии и рака желудка на ранних стадиях может способствовать улучшению своевременной диагностики данной патологии, что в итоге должно положительным образом сказаться на уровне заболеваемости и смертности [18].
Генотипирование Helicobacter pylori
Новые эндоскопические технологии диагностики хронического гастрита, ассоциированного с H.pylori
Эндоскопическое исследование — один из самых важных методов оценки слизистой оболочки желудка. Применение дополнительных методик и техник, таких как эндоскопия в узком спектре света, эндоскопия с оптическим увеличением изображения, хромоэндоскопия, позволяют детально изучить структурные особенности слизистой оболочки желудка.
Увеличительная эндоскопия
Первое эндоскопическое исследование с применением оптического увеличения эндоскопического изображения желудка было выполнено еще в 1967 году в Японии (Okuyama) [24]. Это послужило отправной точкой для развития новых эндоскопических технологий, направленных на изучение мельчайших структур поверхности слизистой оболочки. В настоящее время существует два способа увеличения — электронное и оптическое. Изображение, полученное при помощи электронного увеличения, имеет такое же разрешение, как и обычное эндоскопическое изображение. В то время как при применении оптического увеличения становятся видимыми мельчайшие детали, которые невозможно обнаружить при обычном исследовании. Эндоскопы с увеличением оснащены с подвижными линзами в дистальной части аппарата и по своей функциональности сопоставимы с обычными световыми микроскопами. Довольно часто эндоскопическое исследование с увеличением применяется совместно с хромоскопией. Однако применение красителей не позволяет визуализировать микрососудистую архитектонику, что очень важно в дифференциальной диагностике неопластических изменений, к тому же эта дополнительная манипуляция увеличивает время исследования.
Узкоспектральная эндоскопия (narrow band imaging — NBI) — это новая оптическая диагностическая методика, которая основана на использовании специальных оптических фильтров, суживающих спектр световой волны. Обычные эндоскопические системы используют практически весь видимый световой спектр от 400 до 800 нм. Новая система использует преимущества в основном двух световых волн длиной 415 и 445 нм в диагностике сосудистых структур слизистой оболочки пищеварительного тракта, так как эти световые волны хорошо поглощаются гемоглобином. Таким образом, световые фильтры позволяют получить детальное изображение сосудистого рисунка тканей, его изменений, характерных для патологических участков воспалительного генеза, а также для предраковых заболеваний и ранних форм рака. Кроме этого, новая эндоскопическая система повышает контрастность изображения, что создает эффект виртуальной хромоскопии. С технической точки зрения применение функции узкого спектра света в желудке без оптического увеличения нецелесообразно в связи с тем, что получаемое изображение оказывается слишком темным и «шумным». Это происходит того, что при растяжении стенок желудка воздухом во время исследования его просвет становится слишком большим. Поэтому гораздо важнее и актуальнее проводить исследование в узком спектре света совместно с увеличением [25]. Первоначально хромоскопия и эндоскопия в узком спектре света в комбинации с увеличением применялись для оценки раннего рака желудка перед эндоскопической резекцией слизистой оболочки. С дальнейшим внедрением этих технологий в клиническую практику методики оценки микрососудистой архитектоники и микроструктуры поверхности слизистой оболочки стали успешно применятся для диагностики многих других патологических состояний желудка, таких как H.pylori ассоциированный гастрит, кишечная метаплазия, атрофия [26].
Нормальная слизистая оболочка желудка
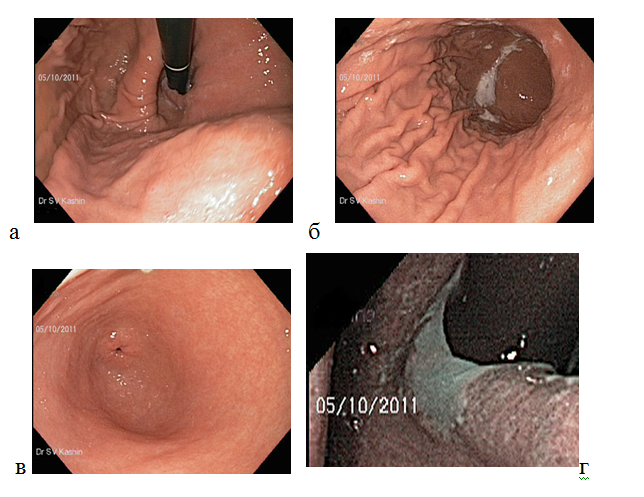
В желудке выделяют четыре анатомических зоны: кардия, фундальный отдел (дно желудка), тело желудка, пилорический (антральный) отдел. Поверхность слизистой оболочки всех отделов желудка выстлана однослойным призматическим железистым эпителием. Для рельефа внутренней поверхности желудка характерно наличие трех видов образований — продольных желудочных складок, желудочных полей и желудочных ямочек. Желудочные складки (plicae gastricae) образованы слизистой оболочкой и подслизистой основой. Желудочные поля (areae gastricae) представляют собой отграниченные друг от друга бороздками участки слизистой оболочки. Они имеют многоугольную форму и размер поперечника от 1 до 16 мм. Наличие полей объясняется тем, что железы желудка располагаются группами, отделенными друг от друга прослойками соединительной ткани. Поверхностно лежащие вены в этих прослойках просвечивают в виде красноватых линий, выделяя границы между полями. Желудочные ямочки (foveolae gastricae) — это углубления эпителия в собственной пластинке слизистой оболочки. Они встречаются по всей поверхности желудка. Число ямочек в желудке достигает почти трех миллионов. Желудочные ямочки имеют микроскопические размеры, но величина их неодинакова в различных отделах желудка. В кардиальном отделе и теле желудка их глубина составляет всего ¼ толщины слизистой оболочки. В пилорической части желудка ямочки более глубокие. Они занимают около половины толщины всей слизистой оболочки [27]. При обычном эндоскопическом исследовании нормальная слизистая оболочка желудка цвета, ее цвет зависит от степени васкуляризации и растяжения — чем больше растяжение, тем бледнее слизистая оболочка. Слизистая оболочка имеет мелкозернистую поверхность благодаря наличию желудочных полей (рис. 4) [28].
Рисунок 4. Нормальная слизистая оболочка тела желудка при стандартном осмотре в белом световом режиме. Вид тела желудка (а) при инверсии (изгибе дистального конца эндоскопа на 180о) и (б) — при прямом осмотре эндоскопом; (в) — слизистая оболочки антрального отдела желудка; (г) — осмотр в узкоспектральном режиме: более контрастное изображение поверхности слизистой оболочки кардиального и субкардиального отделов желудка, мелкозернистая структура эпителия, четкая граница с плоским эпителием пищевода (указана стрелками).
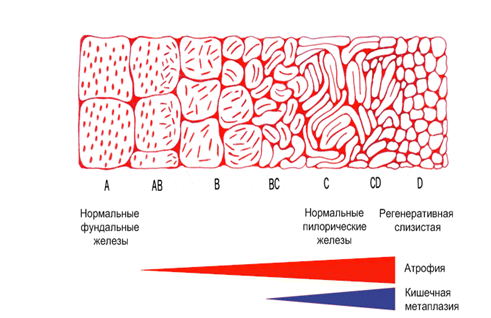
Применение узкоспектральной эндоскопии в комбинации с оптическим увеличением изображения позволяет дифференцировать патологические изменения, которые при обычной эндоскопии не могут быть выявлены. Однако следует отметить, что применение этих технологий не может полностью обеспечить различение абсолютно нормальной слизистой оболочки от гастрита с минимальными изменениями. При осмотре слизистой оболочки с увеличением оцениваются две основные характеристики — микроструктура поверхности слизистой оболочки (ямочный рисунок — pit pattern) и микрососудистая структура (рисунок субэпителиальной капиллярной сети (subepithelial capillary network — SECN). Более тридцати лет назад Sakaki предложил классификацию типов рисунка слизистой оболочки желудка при использовании фиброскопа с увеличением в 30 раз. Согласно этой классификации (рис. 5), выделяют чистые типы (А, В, С, D) и смешанные типы (АВ, ВС, CD). Типы, А и В соответствуют нормальной слизистой оболочке. Дальнейшие изменения рисунка ямок свидетельствуют о более выраженных предопухолевых изменениях, таких как атрофия и кишечная метаплазия (показаны красной и синей полосами в нижней части рисунка). Для диспластических изменений и опухолевого процесса типы рисунка могут соответствовать С (полосатый тип) и D (нерегулярный, зернистый, ячеистый рисунок) типам рисунка.
А — точечные ямки (dotted pits)
В — короткие линейные ямки (short linear pits)
С — полосатые борозды (striped grooves)
D — ячеистые борозды ( grooves)
Рисунок 5. Схема классификации типов рисунка поверхности слизистой оболочки желудка при увеличительной эндоскопии (по Sakaki).
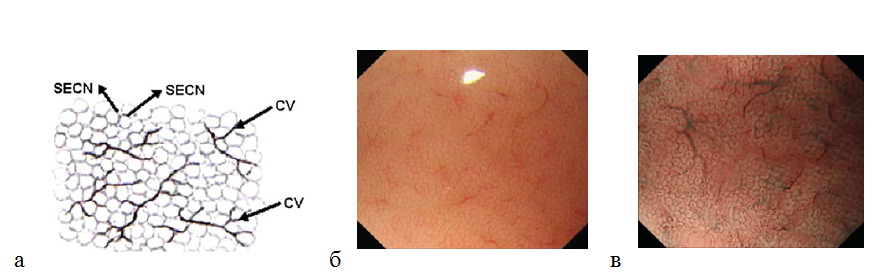
Оценивая микрососудистую архитектонику в теле желудка, можно определить рисунок субэпителиальной капиллярной сети (SECN) в виде пчелиных сот ( network) с коллекторными венулами. Полигональные петли субэпителиальных капилляров окружают каждую желудочную ямку, формируя под эпителием сеть в виде пчелиных сот. Далее ветви сосудистой сети сходятся в коллекторные венулы. При осмотре в узкоспектральном режиме с оптическим увеличением изображения микроструктура поверхности слизистой оболочки становиться более отчетливой: определяются ямки округлой или овальной формы. Ямки гистологически соответствуют желудочным железам. Коллекторные венулы (CV) располагаются глубже, чем субэпителиальная капиллярная сеть, поэтому при осмотре в узком спектре света имеют более насыщенный зеленый цвет. Так как в режиме NBI участки с большей васкуляризацией становятся темными, наблюдается специфическая картина слизистой оболочки тела желудка: светлые участки окружены темным ободком [29] (рис. 6). Правильная форма и взаиморасположение сосудов и структур слизистой оболочки являются наиболее важными ее характеристиками для дифференцировки нормальной и патологически измененной слизистой оболочкой желудка.
Рисунок 6. (а) — рисунок (схема) субэпителиальной капиллярной сети (SECN) в виде пчелиных сот с коллекторными венулами (CV); (б) — нормальная слизистая оболочка тела желудка: эндоскопическое изображение поверхности слизистой оболочки с увеличением изображения: субэпителиальный капиллярный рисунок в виде пчелиных сот с коллекторными венулами; (в) — эндоскопия с увеличением изображения в узкоспектральном световом режиме: более отчетливо видны желудочные ямки округлой или овальной формы, сосудистый рисунок.
Нормальная слизистая оболочка в антральном отделе
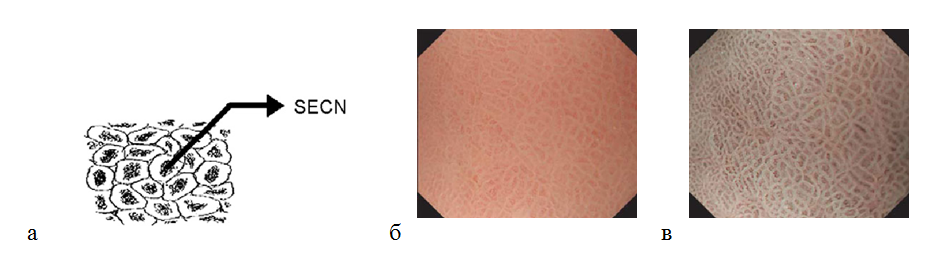
Слизистая оболочка антрального отдела желудка имеет другую картину. При исследовании микрососудистой архитектоники определяется кольцеобразная () субэпителиальная капиллярная сеть. Коллекторные венулы визуализируются реже, так как они находятся в более глубоких частях собственной пластинки, в отличие от тела желудка. Ямки имеют линейный или сетчатый рисунок. Каждый субэпителиальный капилляр расположен в апикальной части желудочной ямки в виде кольца, которое разделяется линейными или сетчатыми бороздками. В отличие от слизистой оболочки тела желудка, в антральном отделе более темные участки окружены светлым ободком (рис. 7). По размерам эти структуры в антральном отделе больше, чем в теле желудка.
Рисунок 7. (а) — кольцеобразная субэпителиальная капиллярная сеть (SECN) в антральном отделе желудка; (б) — нормальная слизистая оболочка антрального отдела желудка: эндоскопическое изображение поверхности слизистой оболочки с увеличением изображения: кольцеобразный субэпителиальный капиллярный рисунок; (в) — эндоскопия с увеличением изображения в узкоспектральном световом режиме: более отчетливо определяется кольцеобразный субэпителиальный капиллярный рисунок и сетчатая микроструктура поверхности слизистой оболочки.
 Автор статьи: Тряпицын Александр Валерьевич (врач-гастроэнтеролог, к.м.н.)
Автор статьи: Тряпицын Александр Валерьевич (врач-гастроэнтеролог, к.м.н.)