Атипическая мелкоацинарная пролиферация предстательной железы что это
Особенности ранней диагностики рака простаты
Ранняя диагностика рака предстательной железы (РПЖ) является одной из приоритетных задач современной урологии и здравоохранения в целом. В настоящее время, в большинстве экономически развитых стран Европы и Северной Америки, РПЖ выходит на второе, а в США на первое место по распространенности среди онкологических заболеваний. В России РПЖ занимает второе место после меланомы кожи и значительно превосходит злокачественные новообразования легких и желудка. Среди онкоурологической патологии РПЖ выявляется чаще, чем опухоль мочевого пузыря и почек.
Внимание исследователей к проблеме РПЖ связано не только с увеличением общего количества больных, но и с ростом смертности от этого заболевания. Причем, характерным является быстрый рост числа вновь выявленных случаев РПЖ. Столь резкий рост заболеваемости большинство урологов объясняют широким распространением программы скрининга РПЖ, усовершенствованием техники пункционной биопсии предстательной железы. Определение ПСА является обязательным для всех мужчин в возрасте от 45 лет. Сейчас пороговым значением ПСА является 2,5 нг/мл у мужчин в возрасте до 65 лет. При значении ПСА, превышающем 2,5 нг/мл, показана биопсия предстательной железы. Методика выполнения биопсии из 6 точек, так тазываемая секстантная биопсия,под контролем трансректального ультразвукового исследования (ТРУЗИ) была предложена в 1989 году (K. Hodgeetal). В последующих исследованиях было установлено, что первичная расширенная биопсия под ТРУЗИ контролем из 10 – 12 точек, картирование простаты в ходе выполнения биопсии улучшает выявляемость РПЖ на 24 – 38% по сравнению с биопсией из 6 точек. Среди показаний к повторной биопсии выделяют такие морфологические данные как: выявление в первичной биопсии ПИН высокой степени и участков атипической мелкоацинарной пролиферации (ASAP). В 80% случаев аденокарцинома простаты располагается в перефиреческой зоне и морфологически представлена железистой атипией. Железы аденокарциномы мредставлены мелкими единообразными железами, клетки которых содержат видимые ядрышки, железы не имеют слоя базальных клеток и не имеют дольчатой организации. Термин атипическая мелкоацинарная пролиферация используется в тех случаях, когда в биоптате простаты выявляются фокусы атипических желез, подозрительные на аденокарциному, но в то же время не соответствующие указанным минимальным диагностическим критериям РПЖ. Данный термин является собирательным и включает в себя как фокусы, подозрительные на аденокарциному, так и фокусы аденокарциномы, в объеме не достаточном для постановки диагноза. Выявление фокусов, подозрительных на аденокарциному, без возможности выполнения иммуногистохимического исследования, является показанием для повторной биопсии простаты. В нашей клинике всем пациентам в случае выявления фокусов мелкоацинарной пролиферации проводится иммуногистохимическое исследование (ИГХ). В клинике урологии «Московского государственного медико-стоматологического университета им. А.И. Евдокимова» МЗ РФ с декабря 2011 года по настоящее время с целью диагностики рака простаты, пациентам с атипической мелкоацинорной пролиферацией выполняется серия ИГХ исследований. Всем пациентам в неоднозначных для постановки диагноза случаях выполненяется ИГХ исследование с использованием антител Cytoceratin HMWClone 34βE12 и AMACRClone 13H4 (Dako), согласно протоколу DakoNorthAmerica. Согласно полученным результатам, атипическая мелкоацинарная пролиферация чаще всего представляет собой аденокарциному простаты. Иммуногистохимические методы окраски тканей, полученных в ходе биопсии предстательной железы, являются важным диагностическим исследованием у пациентов с подозрением на рак простаты. И позволяют повысить диагностическую значимость биопсии простаты сократив количество повторных биопсий у пациентов с подозрением на рак предстательной железы.
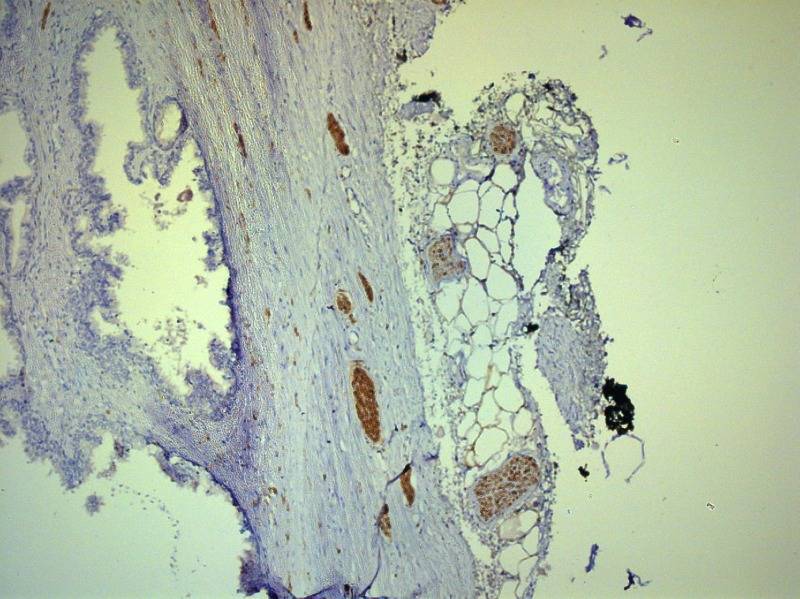
Рисунок №1 Нервные волокна в парапростатической ткани и капсуле простаты ИГХ окраска S100
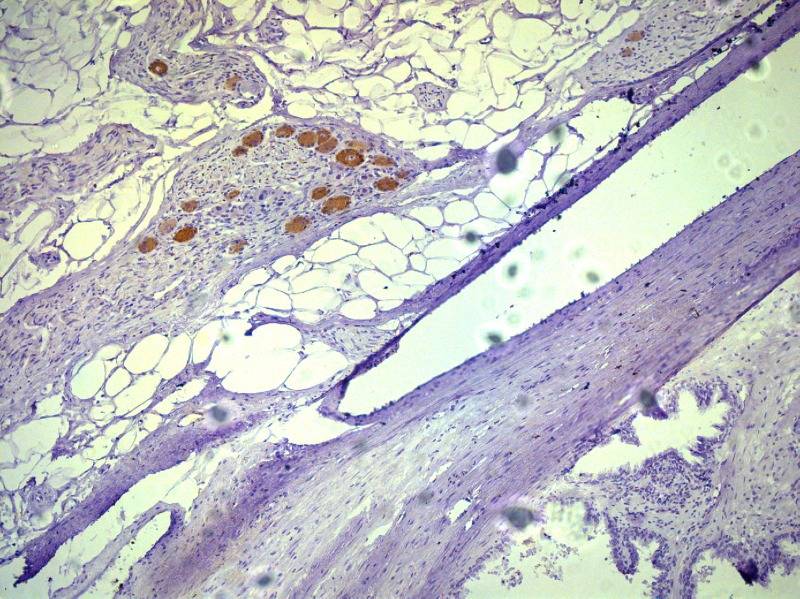
Рисунок №2 Парасимпатические нервные волокна в парапростатической ткани Окраска ИГХ Nitric oxide
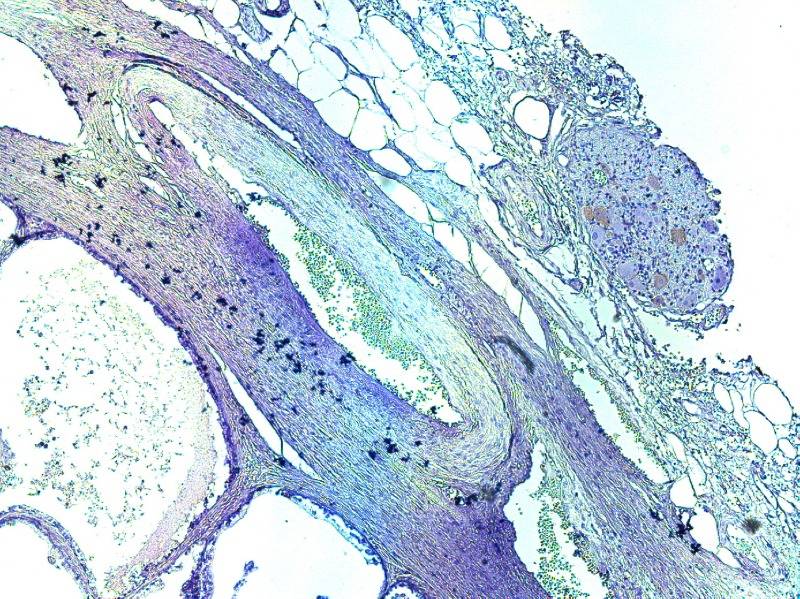
Рисунок №3 Симпатические нервные волокна в парапростатической ткани окраска ИГХ Tyrosine hydroxylase
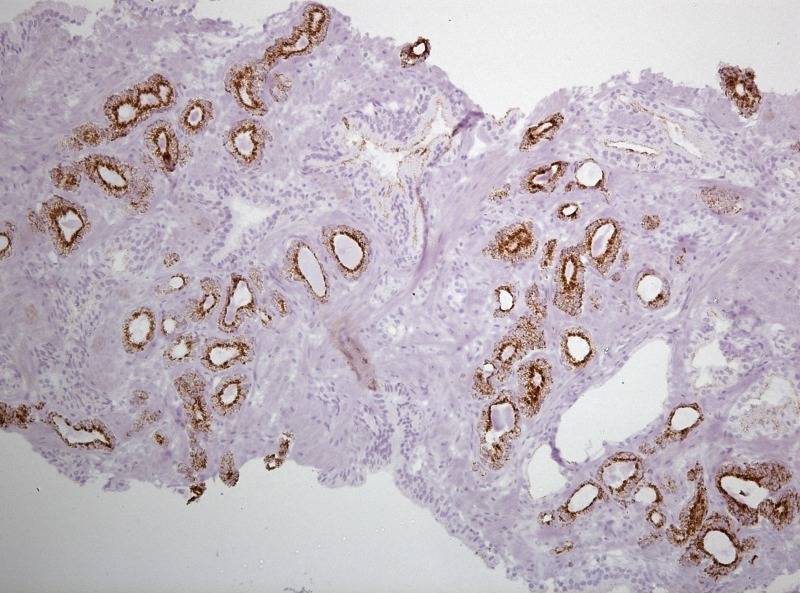
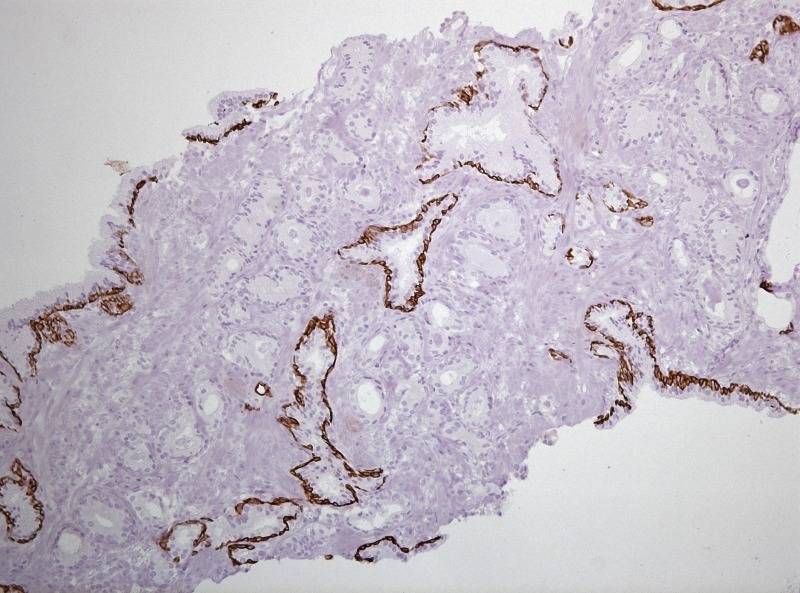
Рисунок №4 Фокус ацинарной аденокарциномы простаты Глисон 3+3 окраска ИГХ AMACR
Рисунок №5 Фокус ацинарной аденокарциномы простаты Глисон 3+3 окраска ГЭ
Рисунок №6 Фокус ацинарной аденокарциномы простаты Глисон 3+3 окраска ИГХ Cytokeratin HMW
Клиническая и морфологическая классификация рака предстательной железы
Глава 2. Клиническая и морфологическая классификация рака предстательной железы
Основными диагностическими критериями рака предстательной железы является структурный атипизм: компактное расположение опухолевых ацинусов, беспорядочный их рост с инфильтрацией стромы органа. В строме опухоли происходит гибель эластических волокон, отмечается инфильтрация опухолью прилежащей ткани, инвазия в периневральные и периваскулярные лимфатические щели.
В настоящее время наиболее широкое применение нашла гистологическая классификация Глисона, так как она во многом отвечает требованиям клиники при выборе тактики лечения и прогноза заболевания (рис. 1).
Рис. 1. Гистологическая классификация рака предстательной железы по Глисону
Классификация Глисона основана на степени дифференцировки железистых структур опухоли. Опухоль по показателю Глисона 1 образую практически нормальные железы, структура которых по мере увеличения показателя Глисона утрачивается, и при показателе 5 опухоль характеризуется недифференцированными клетками. Чем больше утрачена дифференцировка тканей, тем хуже прогноз у данного больного.
По классификации Глисона степень дифференцировки опухоли разделяется на пять градаций:
Таблица 9. Классификация по градации Глисона.
| Число баллов по Глисону | Гистологические особенности | Вероятность местного распрoстранение опухоли в течение 10 лет |
| менее 4 | Высокодифференцированный рак | 25% |
| от 5 до 7 | Умеренно дифференцированный рак | 50% |
| более 7 | Низкодифференцированный рак | 75% |
Необходимо сравнение показателя Глисона поданным биопсии и результатам, полученным после радикальной простатэктомии, чтобы знать, насколько точна наша дооперационная диагностика. По данным Epstein I (1997) на материале 499 биопсий соответствие в пределах одной суммы по Глисону встречается от 74% до 94% случаев, (см. табл. 10).
Таблица 10. Корреляция показателя Глисона по данным биопсии и радикальной простатэктомии.
| Показатель Глиссона по данным биопсии | Показатель Глисона по данным радикальной простатэктомии | |||
| 2-4 | 5-6 | 7 | 8-10 | |
| 2-4 | 0 | 5 | 1 | 0 |
| 5-6 | 3 | 225 | 125 | 4 |
| 7 | 0 | 16 | 91 | 13 |
| 8-10 | 0 | 0 | 3 | 13 |
Как указывает автор, сумма Глисона является также наиболее мощным фактором для предсказания прогрессирования после радикальной простатэктомии. Опухоли с показателем Глисона от 8 до 10 имеют мрачный прогноз. Если при этом выявляются региональные метастазы, то пропадает смысл в простатэктомии, хотя она технически выполнима. Все сказанное иллюстрируется таблицей 11. Как видно из таблицы, при показателе Глисона 8-10 в несколько раз ухудшаются все прогностические факторы.
Таблица 11. Корреляция показателя Глисона с выявленной патологией после радикальной простатэктомии.
| Выявленная патология | Показатель Глисона | |||
| 5 | 7 | 8-10 | ||
| Прорастание капсулы простаты | 16% | 24% | 62% | 85% |
| По краям простаты не удаленные раковые клетки | 20% | 29% | 48% | 59% |
| Средний объем опухоли | 2.2 | 2.7 | 5.1 | 4.0 |
| Инвазия в семенные пузырьки | 1% | 4% | 17% | 48% |
| Метастазы в лимфатических узлах | 1% | 2% | 12% | 24% |
Международная классификация рака предстательной железы по системе TNM (1997 год).
Международная классификация РПЖ по системе TNM
Атипическая мелкоацинарная пролиферация предстательной железы что это
Комплексное исследование включает в себя два метода исследования (гистологическое и иммуногистохимическое), совместно использование которых позволяет повысить точность диагностики заболевания, определить оптимальные варианты лечения и скорректировать схему терапии.
Гистологическая и ИГХ диагностика опухоли простаты.
Complex histological and immunohistochemical examination with prostate tumor detection (Ck5, P63, AMACR).
Какой биоматериал можно использовать для исследования?
Образец ткани (биоптат) опухолевого образования предстательной железы.
Общая информация об исследовании
Рак предстательной железы (РПЖ) обусловлен развитием аномальных клеток в простате, которые могут неконтролируемым образом делиться и распространяться вне органа, поражая близлежащие или отдаленные части тела. Это, как правило, медленно развивающееся заболевание, которое в большинстве случаев в течение многих лет протекает бессимптомно, поэтому часто обнаруживается уже на продвинутых стадиях. В настоящее время летальность от этой патологии составляет 4,7%.
Альфа-метилацил-КоАрацемаза участвует в бета-окислении жирных кислот и метаболизме желчных кислот и может быть обнаружена в нормальных тканях (например, гепатоцитах печени, в тубулярном эпителии почек, эпителии бронхов, желчном пузыре). Начиная с 2000 г., после установления связи между повышенной экспрессией AMACR и наличием карциномы простаты, этот белок стал рассматриваться как онкомаркер. Повышение экспрессии альфа-метилацил-КоАрацемазы возможно и при карциномах других локализаций (например, колоректальных, овариальных, груди, мочевого пузыря, легких, почечно-клеточных), тем не менее данный маркер высокоэффективен, так как позволяет провести дифференциальную диагностику рака с другими заболеваниями и более точно определить стадию процесса. AMACR позитивен как в случае наличия предракового поражения (простатической интраэпителиальной неоплазии (ПИН), так и при карциномах простаты, в том числе при ASAP. Считается, что чем выше экспрессия альфа-метилацил-КоАрацемазы, тем агрессивнее ведет себя опухоль.
Дополнительными маркерами базальных клеток для диагностики аденокарциномы являются p63, цитокератины (Ck) 5/6, цистатин А54 и кальциклин. При помощи маркера p63 можно обнаружить белок p63 в ядрах базальных клеток. Ген, кодирующий выработку этого белка, относится к семейству p53 опухолевых супрессорных генов. р63 обладает широким спектром биологических функций, включая участие в делении и дифференцировке клеток, его можно обнаружить в различных видах эпителия. Определение р63 помогает провести дифференцировку между доброкачественными и онкологическими процессами. Высокомолекулярные цитокератины также относятся к маркерам базального эпителия предстательной железы и, как правило, меньше экспрессируются или отсутствуют при раке предстательной железы.
Использование во время проведения исследования сразу нескольких маркеров повышает его чувствительность.
Для чего используется исследование?
Когда назначается исследование?
Что означают результаты?
Проводится морфологическая оценка опухоли согласно классификации ВОЗ, оценка экспрессии маркеров в атипичных клетках. Диапазон референсных значений экспрессии маркеров индивидуален и зависит от многих факторов.
Правильно интерпретировать результат исследования может только врач.
Рак предстательной железы
Рак предстательной железы (РПЖ) занимает место в структуре онкологических заболеваний у мужчин. Заболеваемость и смертность наиболее высока в индустриально развитых странах.
В США РПЖ в последние годы устойчиво занимает место по показателю заболеваемости среди всех злокачественных опухолей у мужчин и место после рака лёгкого в структуре смертности.
Наиболее высокая заболеваемость РПЖ отмечается у афро-американцев, проживающих в США (на 60% выше, чем у белых американцев); самая низкая — у китайцев, проживающих в Китае.
Факторами риска развития РПЖ также считают генетическую предрасположенность, возраст мужчины и особенности питания (употребление большого количества жиров животного происхождения), наследственность.
В настоящее время профилактика РПЖ не разработана.
Скрининг
При скрининге РПЖ определяют уровень простатспецифического антигена (ПСА) в сыворотке крови и проводят ПРИ (пальцевое ректальное исследование простаты), которое у мужчин с отсутствием симптомов приводит к выявлению заболевания только в 0,1 – 4% случаев.
Классификация
Т — первичная опухоль (Тх; Т0; Т1; Т1а; Т1b; Т1с; Т2; Т2а; Т2b; Т3; Т3а; Т3b; Т4)
N — регионарные лимфоузлы (Nx; N0; N1)
M — отдалённые метастазы (Mx; M0; M1; M1a; M1b; M1c)
pT — патоморфологическая оценка опухоли (pT 2; pT2a; pT2b; pT3; pT3a; pT3b; pT4)
Степень дифференцировки (по классификации ВОЗ):
Gx — дифференцировку невозможно определить;
G1 — высокодифференцированный рак;
G2 — умеренно дифференцированный рак;
G3 — низкодифференцированный рак;
G4 — недифференцированный рак.
Существует также классификация РПЖ по стадиям:
| Стадия | T | N | M | G |
|---|---|---|---|---|
| I | T1a | N0 | M0 | G1 |
| II | T1a | N0 | M0 | G2-3 |
| T1b | N0 | M0 | Любая G | |
| T1c | N0 | M0 | Любая G | |
| T2 | N0 | M0 | Любая G | |
| III | T3 | N0 | M0 | Любая G |
| IV | T3 | N0 | M0 | Любая G |
Морфологическая классификация РПЖ
Морфологическая классификация по шкале Глисзона
Согласно классификации Глизона (Gleason), степень дифференцировки опухоли оценивают по бальной шкале:
При опухоли с неоднородной морфологической структурой принято выделять наиболее распространённую гистологическую градацию (первичный балл) и следующую по частоте встречаемости градацию дифференцировки (вторичный балл). При сложении первичной и вторичной оценки получают сумму Глизона (от 2 до 10 баллов).
Классификация Глизона в настоящее время наиболее распространена и имеет важное прогностическое значение для предсказания патоморфологической стадии процесса и оценки результатов лечения РПЖ.
Диагностика
Жалобы и анамнез
На ранних стадиях РПЖ симптоматика отсутствует. При прогрессировании опухолевого процесса появляются симптомы, которые можно разделить на 3 группы:
Симптомы инфравезикальной обструкции:
Симптомы, связанные с местным прогрессированием опухоли:
Симптомы, связанные с отдалёнными метастазами:
Основные методы диагностики РПЖ:
Простат-специфический антиген — органо-специфический маркёр, поэтому его сывороточный уровень может повышаться не только при РПЖ, но и при АПЖ и хроническом простатите.
Средним нормальным уровнем ПСА считают 2,5 нг/мл.
В зависимости от возраста нормы ПСА следующие:
При повышении уровня ПСА показана биопсия предстательной железы.
При уровне ПСА 4-10 нг/мл у 75% мужчин диагностируют доброкачественные заболевания предстательной железы. При уровне ПСА выше 10 нг/мл наиболеее вероятен РПЖ. В то же время, у 13,2% мужчин в возрасте 50-66 лет с концентрацией ПСА 3-4 нг/мл при биопсии диагностируют клинически значимый РПЖ.
Для повышения специфичности маркёрной диагностики, при выявлении раннего РПЖ применяют следующие модификации ПСА:
Определение стадии РПЖ
Основные прогностические факторы, определяющие стадию опухолевого процесса:
На основе комбинации данных прогностических факторов разработаны таблицы и номограммы, с высокой точностью предсказывающие вероятность определённой патоморфологиеческой стадии опухоли. Наиболее популярны таблицы Partin и номограммы Kattan.
Дополнительные факторы, влияющие на прогноз стадии РПЖ:
Для определения состояния внутритазовых лимфоузлов выполняют КТ или МРТ малого таза. Пункционная биопсияилмфатических узлов под контролем КТ или УЗи повышает точность диагностики.
Наиболее точный метод (золотой стандарт) диагностики метастазов РПЖ в регионарные лимфатические узлы — двусторонняя тазовая лимаденоэктомия, которую выполняют из надлобкового (открытого) и лапароскопического доступа в случаях, когда планируется местное лечение РПЖ.
Методы диагностики отдалённых метастазов
Лечение
Динамическое наблюдение (отсроченное лечение)
показания к проведению динамического наблюдения:
Хирургическое лечение
Хирургическое вмешательство (радикальная простат-эктомия) — наиболее радикальный метод лечения и рассматривается как метод выбора при лечении локализованного РПЖ.
Лучевая терапия
Криотерапия
Брахитерапия (внутритканевая лучевая терапия)
Гормональная терапия
Цель гормональной терапии РПЖ — увеличение показателей выживаемости и улучшение качества жизни больных. Гормональную терапию как самостоятельный вариант проводят с паллиативной целью, но её можно использовать в сочетании с радикальным оперативным или лучевым лечением как комбинированную противоопухолевую терапию.
Методы гормональной терапии:
Двусторонняя орхидэктомия
Двустороння орхидэктомия (хирургическая кастрация) — основной способ (золотой стандарт) гормональной терапии РПЖ.
Агонисты лютеинизирующего гормона рилизинг-гормона
Агонисты ЛГ рилизинг-гормона — синтетические аналоги нативного гипоталамического ЛГ рилизинг-гормона. после введения этих препаратов отмечается кратковременное повышение концентрации тестостерона на день (синдром вспышки) с последующим снижением её до посткастрационного уровня на 21-28-й день. для профилактики синдроам вспышки у больных с метастатическим РПЖ перед введением агониста ЛГ рилизинг-гормона и в течение недели терапии назначают антиандрогены.
В настоящее времядля лечения РПЖ применяют следующиеагонисты ЛГ рилизинг-гормона:
Лечение агонистами ЛГ рилизинг-гормона проводят длительно.
Эстрогены
Исторически эстрогены были первой группой гормональных препаратов, которые стали применять для лечения РПЖ, однако из-за выраженных побочных эффектов в настоящее время в клинической практике применяются редко.
Антиандрогены
Препараты других классов
Лечение гормонорефрактерного РПЖ
Гормонорефрактерным приянто считать стадию опухолевого процесса, при которой происходит прогрессирование (два последовательных повышения уровня ПСА на 50% выше минимального значения) на фоне посткастрационного уровня тестостерона.
Для лечения гормонорефрактерного РПЖ применяют моно- и полихимиотерапию в различных режимах. Применяют препарат Эстрамустин.
Дальнейшее ведение
Прогноз
Прогноз РПЖ зависит от стадии, на которой выявлено заболевание, а также от степени дифференцировки опухоли и уровня ПСА. Пятилетняя безрецидивная выживаемость больных с I и II стадией РПЖ после проведения радикального лечения составляет 70 — 90%, общая выживаемость — 85 – 97 %. При выявлении заболевания на стадии метастазирования средний период до прогрессирования процесса на фоне лечения составляет 24 – 36 месяцев.
Диагностика рака простаты, его симптомы.
Диагностика рака простаты, как правило, включает:
Диагноз подтверждается при обнаружении клеток аденокарциномы в биопсийном или послеоперационном материале ткани предстательной железы (например, после ТУР простаты).
Пальцевое ректальное исследование.
Большинство новообразований предстательной железы локализуются в ее периферической зоне, и могут быть выявлены при пальцевом ректальном исследовании, если их объем достигает 0,2 см. куб. и более. Выявление подозрительных уплотнений с помощью пальцевого ректального исследования является абсолютным показанием для проведения биопсии предстательной железы.
Примерно у 18% всех больных раком предстательной железы заболевание выявляется только по подозрительным участкам, обнаруженным при пальцевом ректальном исследовании независимо от уровня ПСА. Выявление подозрительных участков при пальцевом ректальном исследовании у больных с уровнем ПСА
Диагностика рака простаты кардинально улучшилась с введением анализа на уровень простатического специфического антигена (ПСА). ПСА является протеазой сыворотки крови, которая вырабатывается преимущественно эпителиальными клетками предстательной железы. Для практических целей можно сказать, что он органоспецифический, однако не является специфическим для рака. Поэтому его уровень в сыворотке крови может быть повышенным при доброкачественной гиперплазии предстательной железы (ДГПЖ), простатите и других незлокачественных заболеваниях простаты.
Повышенный уровень ПСА при определении показаний к биопсии является более достоверным прогностическим фактором рака, чем выявление подозрительных участков методом пальцевого ректального исследования и ТРУЗИ.
Недавнее исследование по профилактике рака предстательной железы, проведенное в США, подтвердило данные о том, что у многих мужчин рак предстательной железы может присутствовать несмотря на низкий уровень ПСА в сыворотке крови. Ниже представлено соотношение между вероятным наличием рака предстательной железы и уровнем ПСА в сывортоке крови у 2950 мужчин.
Риск рака предстательной железы при низком уровне ПСА.
Уровень ПСА, нг/мл
Риск рака предстательной железы
Соотношение свободного и общего ПСА.
Соотношение свободный/общий ПСА является наиболее исследованным и широко используемым в клинической практике критерием для дифференциальной диагностики доброкачественной гиперплазии предстательной железы и рака предстательной железы. Этот показатель позволяет определить степень риска наличия рака предстательной железы у мужчин с уровнем общего ПСА от 4 до 10 нг/мл и отрицательным результатом пальцевого ректального исследования. В ходе проспективного многоцентрового исследования рак предстательной железы был выявлен при биопсии у 56% мужчин с соотношением свободный/общий ПСА 0,25.
Скорость прироста ПСА и время удвоения ПСА.
Существует два способа оценки изменений ПСА во времени:
• скорость прироста ПСА, которая определяется как абсолютный ежегодный прирост ПСА в сыворотке крови (нг/мл/год);
• время удвоения ПСА, которое выражает экспоненциальное увеличение ПСА в сыворотке крови с течением времени, отражая относительные изменения.
Эти два критерия могут иметь прогностическую ценность у пациентов, прошедших лечение по поводу рака предстательной железы. Тем не менее, их использование в диагностике рака простаты ограничено из-за влияния сопутствующих состояний (большой объем предстательной железы, хронический простатит), неодинаковых интервалов между измерениями ПСА и увеличения/снижения скорости и времени удвоения ПСА с течением времени.
Трансректальное ультразвуковое исследование (ТРУЗИ).
Далеко не всегда при ТРУЗИ можно увидеть классическое изображение гипоэхогенного участка в периферической зоне предстательной железы, характерное для рака предстательной железы. ТРУЗИ в режиме серой шкалы не позволяет определить рак предстательной железы с достаточной достоверностью.
Поэтому прицельная биопсия предполагаемых пораженных участков не является эффективной заменой систематической биопсии (т.е. биопсии из 12-18 точек). Однако дополнительная биопсия предполагаемых пораженных участков под контролем ТРУЗИ может оказаться полезной.
Биопсия при раке предстательной железы.
Первичная биопсия предстательной железы.
Показаниями для назначения биопсии предстательной железы являются повышенный (более 4 нг/мл) уровень ПСА и/или подозрительные участки, выявленные во время пальцевом ректальном исследовании или ТРУЗИ.
Высокий уровень ПСА, выявленный при однократном исследовании, не является прямым показанием к биопсии. Необходимо повторно определить уровень ПСА через несколько недель при помощи того же анализа в стандартных условиях (т.е. без эякуляции и без манипуляций, таких как катетеризация, цистоскопия или трансуретная резекция – ТУР, и при отсутствии инфекций мочевых путей) в той же диагностической лаборатории с использованием тех же методов.
В настоящее время проведение биопсии предстательной железы под контролем ультразвука является стандартным методом диагностики. Хотя при биопсии предстательной железы используется преимущественно трансректальный способ, некоторые урологи производят ее трансперинеально. Частота обнаружения рака при помощи трансперинеальной биопсии предстательной железы сопоставима с частотой обнаружения при трансректальной биопсии. Трансперинеальный способ под контролем ультразвука является полезной альтернативой в особых случаях, например, у больных после экстирпации прямой кишки.
Повторная биопсия предстательной железы.
Показаниями для назначения повторной биопсии предстательной железы являются:
• увеличивающийся или стабильно высокий уровень ПСА, подозрительные участки, выявленные при пальцевом ректальном исследовании;
• атипичная мелкоацинарная пролиферация.
Оптимальный срок проведения повторной биопсии не установлен. Его определяют на основании результатов патоморфологического исследования при первичной биопсии с учетом серьезности подозрений на рак предстательной железы (атипичная мелкоацинарная пролиферация, высокий или быстро растущий уровень ПСА, подозрительные уплотнения при пальцевом ректальном исследовании, семейный анамнез).
Чем позднее проводится повторная биопсия,тем выше частота обнаружения рака предстательной железы. Наличие ПИН высокой степени, без дополнительных исследований, больше не рассматривают в качестве показания к повторной биопсии.
Таким образом, направление на повторную биопсию предстательной железы следует выдавать на основании других клинических критериев, например, результатов пальцевого ректального исследования и уровня ПСА.
При наличии множественных очагов ПИН (выявленной в нескольких биоптатах), возможно, есть основания для ранней повторной биопсии предстательной железы, так как в таком случае риск развития рака предстательной железы несколько повышается.
Сатурационная биопсия предстательной железы.
Частота выявления рака предстательной железы при помощи повторной сатурационной биопсии, варьируется от 30 до 43% и зависит от количества столбиков, полученных при предыдущих биопсийных исследованиях.
В особых случаях сатурационную биопсию можно выполнять трансперинеально. Это позволяет выявить дополнительно рак предстательной железы в 38% случаев. Однако недостатком этого способа (3-D стереотаксическая биопсия из 24-36 точек) является высокая частота развития задержки мочеиспускания (10%).
Локализация участков забора ткани и количество столбиков.
При первичной биопсии забор ткани следует выполнять в периферических отделах предстательной железы как можно более латерально и сзади.
Дополнительные столбики нужно взять при помощи пальцевого ректального исследования/ТРУЗИ из предполагаемых пораженных участков, которые определяются индивидуально в каждом случае.
Секстантная биопсия больше не считается эффективной. При объеме предстательной железы 30–40 см. куб. необходимо взять не менее 8 столбиков. С увеличением количества столбиков более 12 точность анализа существенно не изменяется. По результатам Британского исследования по диагностике и лечению рака предстательной железы была рекомендована 10-точечная биопсия.
Диагностическая ТУР предстательной железы.
Проведение диагностической ТУР предстательной железы вместо повторных биопсий нецелесообразно. Частота обнаружения раковых клеток при этом методе не превышает 8%, что свидетельствует о его неэффективности при диагностике рака.
Биопсия семенных пузырьков.
Четкие показания для проведения биопсии семенных пузырьков пока не определены. При уровне ПСА > 15–20 нг/мл биопсия показана, только если ее результаты будут иметь решающее значение при определинии тактики лечения. При уровне ПСА > 15–20 нг/мл вероятность прорастания опухоли в семенные пузырьки составляет 20–25%.
Биопсия переходной зоны.
Первичная биопсия с забором ткани переходной зоны характеризуется очень низкой частотой обнаружения рака предстательной железы, поэтому забор ткани из переходной зоны простаты следует проводить только при повторной биопсии.
Целесообразность назначения антибиотиков при биопсии простаты.
Применение пероральных или внутривенных форм антибиотиков является самым современным методом профилактики осложнений. Оптимальная дозировка и продолжительность курса определяются индивидуально.
Предпочтительными препаратами считаются фторхинолоны, при этом ципрофлоксацин более эффективен, чем офлоксацин. Антибиотики назначаются за день до биопсии предстательной железы, и принимаются в течение 7-10 дней.
Местная анестезия при биопсии простаты.
Современным методом местной анестезии при биопсии предстательной железы является перипростатическая нервная блокада под контролем ультразвука. Расположение депо анестетика (в верхушке или основании) не имеет значения.
Интраректальное введение местного анестетика значительно уступает по эффективности перипростатическому его введению.
Тонкоигольная аспирационная биопсия простаты.
Тонкоигольная аспирационная биопсия предстательной железы менее эффективна, чем трансректальная биопсия простаты специальной биопсийной иглой под контролем ТРУЗИ.
При помощи трансректальной биопсии можно точно определить сумму баллов по Глисону и распространенность опухоли в пределах простаты.
Осложнения биопсии простаты.
Частота развития осложений после биопсии предстательной железы невысока. Среди незначительных осложнений встречаются такие, как макрогематурия (14,5%) и гематоспермия (37,4%). Серьезные инфекционные осложнения после биопсии наблюдались менее чем в 1% случаев. Частота острой задержки мочи не превышает 0,2%.
Увеличение в последнее время количества столбиков при проведении биопсии не привело к росту частоты серьезных осложнений, требующих лечения. Прием аспирина в малых дозах больше не считается абсолютным противопоказанием к проведению биопсии простаты.
Патоморфологическое исследование пункционных биоптатов предстательной железы.
Макроскопическое исследование и подготовка материала.
Материалы биопсии предстательной железы, полученные с разных участков, обычно направляются в патоморфологическую лабораторию в отдельных пробирках и должны подвергаться обработке в отдельных контейнерах. Перед обработкой регистрируют количество столбиков в каждой пробирке и длину каждого столбика.
Установлено, что длина биоптата предстательной железы в патоморфологическом препарате существенно влияет на частоту обнаружения рака предстательной железы. Чтобы отдельные столбики были плоскими и ровными, в один контейнер помещают не более 3 столбиков и используют губку и бумагу.
Для лучшего обнаружения небольших очагов опухоли блоки следует разрезать на 3 части. Рекомендуется также фиксировать промежуточные срезы на случай, если потребуется дополнительное иммуногистохимическое исследование.
Микроскопическое исследование и заключение.
Диагностика рака предстательной железы основывается на патоморфологическом исследовании. Тем не менее, иммуногистохимия также может быть эффективной. При подозрении на опухоль в биоптате, сомнения насчет диагноза,зачастую, можно разрешить с помощью консультации коллег или получения мнения специалистов сторонней организации.
В заключении по биопсии предстательной железы следует использовать четкую, ясную терминологию и избегать таких терминов, как «атипия», «атипичные железы» и «потенциально злокачественное новообразование».
Для каждого участка биопсии следует указывать процент положительных столбиков с карциномой и сумму баллов по Глисону на основании системы, принятой в 2005 г. Согласно действующему международному соглашению (модифицированная) сумма баллов по Глисону для опухолей, выявленных при биопсии предстательной железы, состоит из балла по шкале Глисона, доминантного (наиболее обширного) компонента карциномы, и наивысшего балла независимо от обширности компонента (правило 5% не применяется).
Если карцинома преимущественно состоит из компонентов с баллом 4/5, небольшой процент обнаруженных клеток (
Целью патоморфологического исследования материала радикальной простатэктомии является предоставление информации о патоморфологической стадии рака предстательной железы, степени дифференцировки и состоянии хирургического края.
В заключении должны быть отражены следующие параметры:
Сумма баллов по Глисону.
Оценка аденокарциномы предстательной железы по шкале Глисона является самым надежным прогностическим фактором клинического поведения опухоли и результатов лечения. Поэтому сумму баллов по Глисону включают как один из параметров в номограммы, оценивающие риск рецидива после простатэктомии.
Сумма баллов по Глисону – это сумма баллов 2 самых доминантных (по объему) участков по шкале Глисона. Если присутствует только 1 балл, он удваивается. Если участок занимает менее 5% объема опухоли, его балл не учитывается в сумме баллов по Глисону (правило 5%).
Кроме суммы баллов по Глисону, необходимо указывать отдельно первичный и вторичный баллы (например, сумма баллов по Глисону 7 [4 + 3]). При множественных опухолях дается общая сумма баллов по Глисону с обязательным указанием самой высокой оценки отдельного очага опухоли. Третичный балл по шкале Глисона 4 или 5, особенно если его участок превышает 5% объема опухоли предстательной железы, является неблагоприятным прогностическим фактором биохимического рецидива.
В дополнение к сумме баллов по Глисону, следует указывать наличие третичного балла и примерный процент соответствующего участка от объема опухоли.
Определение экстрапростатического распространения опухоли.
Для обозначения наличия опухоли за пределами предстательной железы рекомендуется употреблять термин «экстрапростатическое распространение».
Экстрапростатическое распространение определяют как аденокарциному, проросшую в перипростатическую клетчатку или распространившуюся за пределы предстательной железы, например в сосудисто-нервный пучок.
Инвазия в шейку мочевого пузыря также рассматривается как экстрапростатическое распространение. Рекомендуется указывать не только расположение, но и степень экстрапростатического распространения, поскольку она влияет на риск рецидива.
Не существует общепринятого международного определения терминов «очаговое», «неочаговое» и «обширное экстрапростатическое распространение». Одни исследователи к очаговому относят экстрапростатическое распространение «в нескольких железистых элементах» или распространение менее 1 поля зрения при большом увеличении микроскопа, тогда как другие измеряют глубину распротранения в мм.
В настоящее время клинически целесообразным представляется определять размер экстрапростатического распространения (например, «менее или бо-лее 1 поля зрения при большом увеличении микроскопа» или «1 мм»).
Относительно верхушки предстательной железы не существует единого мнения о способе определения экстрапростатического распространения в этой локализации. В данном случае прорастание опухоли в скелетные мышцы не рассматривается как экстрапростатическое распространение. Следует отметить, что для опухоли в верхушке предстательной железы не существует стадии pT4.
В шейке мочево гопузыря следует различать микроскопическую инвазию тонких волокон гладкой мышцы и обширную инвазию стенки мочевого пузыря, поскольку первая не является независимым прогностическим фактором биохимического рецидива и должна рассматриваться как экстрапростатическое распространение (pT3a).
Положительный хирургический край шейки мочевого пузыря должен обозначаться как экстрапростатическое распространение (pT3a) с положительным хирургическим краем, а не как стадия pT4.
Некоторые исследователи рассматривают инвазию толстых волокон гладких мышц как обширную инвазию, которая определяется урологом.
Объем опухоли при раке предстательной железы.
Мнения о прогностической ценности объема опухоли предстательной железы в материале после радикальной простатэктомии неоднозначны, учитывая несколько противоречивых исследований, которые подтверждают либо опровергают этот показатель как независимый прогностический фактор.
Тем не менее, граничный объем рака предстательной железы 0,5 см. куб. продолжают использовать как важный критерий дифференциации клинически значимых и не значимых опухолей.
Кроме того, усовершенствование рентгенографических методов позволяет более точно определить объем опухоли без хирургического вмешательства.
Таким образом, при наличии доминирующего опухолевого узла рекомендуется указывать его максимальный диаметр в миллиметрах.
Состояние хирургического края.
Состояние хирургического края является независимым фактором риска биохимического рецидива.
Как правило, можно получить точную информацию о состоянии хирургического края:
• Край является положительным, если опухолевые клетки контактируют с окрашенным краем образца;
• Край является отрицательным, если опухолевые клетки располагаются очень близко к окрашенному краю или на неокрашенной поверхности ткани.
Если на ткани имеются серьезные повреждения (как правило, в верхушке), определить состояние хирургического края не всегда возможно.
Состояние хирургического края не зависит от стадии рака, а положительный край не свидетельствует об экстрапростатическом распространении. Для подтверждения связи между размером положительного края и риском рецидива недостаточно научно обоснованных доказательств.
Однако, необходимо указывать (много) очаговость и размер положительного края, например линейный размер в миллиметрах или количество блоков с положительным краем.