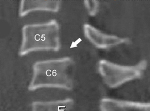
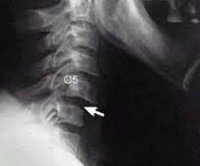
Атланто аксиальная дислокация что это
Подвывих шейного позвонка
МКБ-10
Общие сведения
Подвывих шейного позвонка – частичное смещение суставных поверхностей двух соседних позвонков. Может возникать вследствие удара, падения или резкого поворота головы. Иногда остается не диагностированным. Самым широко распространенным в травматологии и ортопедии является ротационный подвывих атланта (С1), составляющий около 30% от общего числа повреждений шейного отдела позвоночника. Как правило, подвывихи позвонков являются изолированной травмой. При адекватной терапии исход благоприятный.
В ряде случаев (обычно при падении с высоты) подвывихи II шейного и нижележащих позвонков сочетаются с другими травматическими повреждениями: переломами позвонков, ЧМТ, переломами костей конечностей, повреждением грудной клетки, тупой травмой живота и т. д. При наличии сочетанных повреждений, особенно – ЧМТ и переломов позвонков прогноз ухудшается, а вероятность возникновения неврологических осложнений увеличивается. Лечением изолированных подвывихов занимаются врачи-травматологи. При выявлении сопутствующей неврологической симптоматики больных передают в ведение нейрохирургов.
Причины
Причиной подвывиха атланта в детском возрасте обычно становится резкий нескоординированный поворот головы. Травма возникает во время уроков физкультуры, активных игр или занятий спортом, реже – при первом движении после состояния покоя (например, после сна). Кроме того, как у детей, так и у взрослых подвывих С1 может развиваться вследствие внешнего пассивного или активного воздействия на голову или шею (например, при ударе волейбольным мячом во время игры). У взрослых ротационные подвывихи атланта выявляются значительно реже, чем у детей.
Причиной подвывиха С1 у новорожденных может стать даже незначительная травма при продвижении по родовым путям. Сухожильный и связочный аппарат младенцев еще недостаточно зрелый, поэтому при значительной амплитуде движений связки могут растягиваться и разрываться. Если во время движения по родовым путям головка отклоняется от центральной оси тела, давление родовых путей может вызвать дислокацию одного позвонка относительно другого. Такие повреждения достаточно часто остаются нераспознанными.
Симптомы подвывиха
При повреждении обычно наблюдаются боли в шейном отделе позвоночника, вынужденное положение головы, болезненность при пальпации, напряжение мышц и припухлость мягких тканей шеи. Кроме того, при сдавлении нервных корешков и спинного мозга могут возникать головокружения, нарушения сна, головные боли, судороги в руках, боли в спине, плечах, нижней или верхней челюсти, шум в ушах, ощущение мурашек в пальцах, снижение объема и силы движений в верхних и нижних конечностях.
Для ротационного подвывиха С1 характерны следующие признаки: боль в верхних отделах шеи, поворот головы в сторону (при правостороннем подвывихе – влево, при левостороннем – вправо), резкое усиление боли при попытке движений, невозможность повернуть голову в больную сторону. В отдельных случаях наблюдаются головокружения и потеря сознания. При подвывихах С2-С3 возникают боли в шее, затруднение глотания и ощущение отечности языка. Подвывихи нижних шейных позвонков проявляются болями в шее, иррадиирующими в плечо. Возможно также вздутие живота, боли или неприятные ощущения за грудиной.
Врожденные подвывихи шейных позвонков в первые месяцы жизни часто протекают бессимптомно. При увеличении вертикальных нагрузок (стоянии и ходьбе) возникает необходимость выполнять сложные движения, в том числе – и в шейном отделе позвоночника, и патология нередко проявляется в нарушении выработки стереотипов походки (неправильной походке). В отдаленном периоде у таких детей могут отмечаться головные боли, дефицит внимания, ухудшение памяти, быстрая утомляемость и повышенная капризность.
Диагностика
Основным инструментальным методом диагностики подвывиха шейных позвонков является рентгенография позвоночника с использованием как стандартных (боковой и прямой), так и дополнительных проекций: косых снимков, снимков через рот, рентгенограмм в положении разгибания и сгибания шеи. Перечень дополнительных проекций, назначаемых в каждом конкретном случае, определяется с учетом предположительного уровня повреждения. Наряду с рентгенографией могут быть назначены КТ и МРТ.
На КТ позвоночника выявляется уменьшение высоты диска и смещение суставных поверхностей, а при подвывихе С1 – асимметрия между атлантом и зубом. Проведение МРТ позвоночника позволяет уточнить состояние мягких тканей. Кроме того, пациентам с подозрением на подвывих позвонков назначают консультацию невролога для выявления возможных неврологических нарушений. При застарелых подвывихах и подозрении на ухудшение кровоснабжения головного мозга показана реоэнцефалография.
Лечение подвывиха шейного позвонка
При травме шеи необходимо полностью обездвижить голову и шею пострадавшего. Если пострадавший находится в автомобиле, следует сначала надежно зафиксировать шею, а уже затем доставать его из транспортного средства. Для фиксации применяют специальные шины. При отсутствии шин можно использовать самодельный воротник из нескольких слоев ваты, завернутой в марлю, главное – чтобы он надежно фиксировал поврежденный отдел и при этом не препятствовал дыханию. Самостоятельное вправление подвывиха категорически запрещается, манипуляцию может проводить только квалифицированный специалист в условиях стационара.
Процедуру желательно осуществлять в ранние сроки, поскольку с течением времени нарастает отек мягких тканей, и вправление подвывиха становится затруднительным. Обычно применяется петля Глиссона. Пациента укладывают на спину с небольшой плоской подушкой под плечами. Возможно как постепенное вправление с использованием небольшого груза, так и одномоментная манипуляция, во время которой травматолог при помощи петли осуществляет тягу, а затем производит разворот головы.
В момент вправления слышится характерный негромкий щелчок, пациент отмечает уменьшение боли и исчезновение препятствия движениям. Из-за повреждения связочного аппарата после вправления легко может возникнуть повторный подвывих, поэтому больному запрещают двигать головой и накладывают воротник Шанца или краниоторакальную повязку на срок от 2 недель до 3 месяцев (в зависимости от уровня и характера подвывиха). После вправления обязательно выполняют контрольную рентгенографию.
В последующем используют лекарственную терапию, физиолечение, массаж и ЛФК. По показаниям для расслабления мышц шеи назначают толперизон, для нормализации деятельности нервной системы и улучшения кровообращения – витамины группы В, для улучшения микроциркуляции – пентоксифиллин. Массаж может применяться с первых дней после травмы, его цель – расслабление мышц, улучшение питания и кровоснабжения тканей. Используются преимущественно щадящие методики – поглаживания и растирания.
Занятия ЛФК начинают сразу после вправления и продолжают вплоть до выздоровления. На начальном этапе выполняют только упражнения для плеч и надплечий. После снятия воротника Шанца в комплекс добавляют движения шеей. Все упражнения необходимо делать осторожно и аккуратно, постепенно увеличивая нагрузку. Одновременно с занятиями ЛФК применяют физиотерапевтические восстановительные методики: электрофорез с новокаином, ультразвук и тепловые процедуры.
Ротационный подвывих атланта: как распознать и как вылечить?
В результате физического воздействия на шейный отдел возникает ротационный подвывих атланта. Что это за заболевание? По каким признакам его распознают врачи? Какие эффективные методы лечения предлагает нам современная медицина?
ДОСТУПНЫЕ ЦЕНЫ НА КУРС ЛЕЧЕНИЯ
Мягко, приятно, нас не боятся дети
ДОСТУПНЫЕ ЦЕНЫ НА КУРС ЛЕЧЕНИЯ
Мягко, приятно, нас не боятся дети
Первый позвонок шейного отдела называют атлантом. Поэтому при его вывихе целесообразно говорить о подвывихе атланта. Подобная травма появляется, как результат физического воздействия, как прямого, так и непрямого. Еще одна причина деформации позвонка – непроизвольное мышечное сокращение. Люди сталкиваются с подвывихом, когда неудачно ныряют в воду или после ДТП. Не только взрослые подвержены этому недугу, но и новорожденные дети. Они получают этот дефект при прохождении по тесным родовым путям. Груднички тоже могут столкнуться с такой проблемой, в основном, по причине того, что родители неправильно держат их на руках. Голова малыша должна иметь постоянную поддержку.
Какие существуют разновидности подвывиха?
В медицине выделяют несколько вариантов подвывиха. Критерий деления – степень смещения атланта (или первого позвонка в шейном отделе). В соответствии с ним выделяют следующие травмы:
Как распознать травму?
В результате сдвига атланта он принимает несвойственное позвонку положение. Это приводит к ограничению движения шеей. Голова непроизвольно наклоняется в сторону, что противоположна вывиху. Если человек захочет повернуть её в другом направлении, сделать это у него не получится. Причина состоит и в потере атлантоаксиальным суставом своей подвижности, и в постоянном напряжении мышц шеи. Они не расслабляются и в таком состоянии выглядят, как валик. Мягкие ткани отекают.
Если у вас диагностирован подвывих шейного отдела, будьте бдительны: в некоторых ситуациях это приводит к проблемам со спинным мозгом, хотя очень редко. Позвоночный канал деформируется. Основная причина – нестабильность шейных позвонков. Помимо спинного мозга может пострадать артерия, которая питает мозг. К болевым ощущениям в шейном отделе добавляются головные боли, начинает кружиться голова, возможна потеря сознания.
Что делать пациенту с подвывихом?
Если вы подозреваете, что у вас подвывих, обратитесь к врачу, причем как можно быстрее. Несвоевременное обращение за специализированной медицинской помощью приводит к негативным последствиям, в числе которых усугубление ситуации и стремительное ухудшение здоровья. Врачи диагностируют травму следующим образом:
Если на лицо ЧМТ, помимо МРТ специалист отправляет на допплерографию, ангиографию. Цель обследований – выявить повреждения сосудов или их отсутствие.
Как лечат подвывих?
Существует несколько способов вернуть позвонок в шейном отделе в исходную позицию. Основными методами восстановления сустава являются тракция (вытягивание) и деротация (возвращение сустава в первоначальное положение).
Сколько времени займет лечение, зависит от степени смещения. Поставить позвонок на место можно за 1 раз – такая терапия называется одномоментной. Иногда требуется несколько сеансов – вытягивание шеи будет постепенным. Некоторые врачи в рамках терапии используют петлю Глиссона.
По окончании подобных манипуляций больного вторично отправляют делать рентген. Нужно быть уверенным, что все суставы встали на место. Кроме физического воздействия для лечения подвывиха используют медикаменты (анальгетики, миорелаксанты).
Если врач диагностировал черепно-мозговую травму, чтоб снизить давление внутри черепа и нормализовать кровообращение в мозгу, он выписывает все витамины группы В.
Атланто аксиальная дислокация что это
ГБУЗ МО «Московский областной научно-исследовательский клинический институт им. М.Ф. Владимирского», ул. Щепкина, 61/2, Москва, Россия, 129110
ГБУЗ МО «Московский областной научно-исследовательский клинический институт им. М.Ф. Владимирского», ул. Щепкина, 61/2, Москва, Россия, 129110
ГБУЗ МО «Долгопрудненская ЦГБ», ул. Павлова, 2, Долгопрудный, Московская область, Россия, 141704
Атлантоаксиальные дислокации ревматоидного генеза: хирургическая тактика
Журнал: Журнал «Вопросы нейрохирургии» имени Н.Н. Бурденко. 2018;82(1): 41-47
Лисицкий И. Ю., Киселев А. М., Киселев С. Е. Атлантоаксиальные дислокации ревматоидного генеза: хирургическая тактика. Журнал «Вопросы нейрохирургии» имени Н.Н. Бурденко. 2018;82(1):41-47.
Lisitskiy I Yu, Kiselev A M, Kiselev S E. Rheumatoid atlanto-axial dislocation: a surgical approach. Zhurnal Voprosy Neirokhirurgii Imeni N.N. Burdenko. 2018;82(1):41-47.
https://doi.org/10.17116/neiro201882141-47
ГБУЗ МО «Московский областной научно-исследовательский клинический институт им. М.Ф. Владимирского», ул. Щепкина, 61/2, Москва, Россия, 129110
ГБУЗ МО «Московский областной научно-исследовательский клинический институт им. М.Ф. Владимирского», ул. Щепкина, 61/2, Москва, Россия, 129110
ГБУЗ МО «Московский областной научно-исследовательский клинический институт им. М.Ф. Владимирского», ул. Щепкина, 61/2, Москва, Россия, 129110
ГБУЗ МО «Долгопрудненская ЦГБ», ул. Павлова, 2, Долгопрудный, Московская область, Россия, 141704
Атлантоаксиальная дислокация (ААД) не является самостоятельной нозологической единицей и представляет собой патоморфологический субстрат ряда травм и заболеваний краниовертебральной области (КВО). Наряду с травматическим, воспалительным, опухолевым генезом, причиной ААД нередко является ревматоидный артрит [1—3].
Ревматоидный артрит — хроническое системное заболевание соединительной ткани, имеющее аутоиммунный характер, затрагивающее преимущественно мелкие суставы. Распространенность заболевания в популяции составляет от 0,8 до 2% [4]. Женщины болеют в 3 раза чаще мужчин [1, 4]. Заболевание манифестирует на 4—6-й декаде жизни [5, 6]. По данным разных авторов [5—7], от 40 до 80% больных с ревматоидным артритом имеют клинические симптомы поражения шейного отдела позвоночника. У большинства из них находят рентгенологические признаки заболевания. При этом у 65% пациентов с подвывихами и деформациями шейного отдела позвоночника ревматоидный артрит разрушает атлантоаксиальное сочленение и приводит к ААД.
КВО представляет собой уникальный анатомический комплекс, осуществляющий, наряду с защитой жизненно важных структур мозга и его магистральных сосудов, разнообразные двигательные функции. Сложная биомеханика КВО обеспечивается атлантозатылочным и атлантоаксиальным суставами и их связочным аппаратом. В то время как парный атлантозатылочный сустав является достаточно стабильным, атланто-аксиальное сочленение, представленное парным латеральным атлантоаксиальным и срединным атлантоаксиальным суставом (сустав Крювелье), представляет собой более мобильный комплекс, который обеспечивает 60% движений головой [8]. Мобильность комплекса делает его более уязвимим, что обусловливает дислокационные осложнения при травмах и патологических процессах КВО, в том числе ревматоидного генеза. Патогенез ААД при ревматоидном артрите связан с деструкцией капсульно-связочного аппарата и костных структур атлантоаксиального сочленения, приводящей к нестабильности. Неврологические осложнения обусловлены компрессией ствола мозга дислоцированным зубовидным отростком или ревматоидной гранулемой (паннусом) [9].
Дислокации при ревматоидном поражении КВО делятся на передние (49%), боковые (20%), задние (7%) и ротационные (крайне редкие). Они могут быть нефиксированными или ригидными. Ригидность дислокации обусловлена стадией артрита. В поздней стадии заболевания формируется фиброзно-костный анкилоз и деформация становится ригидной. В 38% случаев ААД сочетаются с базилярной инвагинацией, что связано с деструкцией латеральных атлантоаксиальных суставов [10].
Не всегда ревматоидное поражение шейного отдела позвоночника проявляет себя клинически. Так, по данным ряда авторов [11, 12], у 40—88% пациентов с рентгенологически подтвержденным ревматоидным поражением шейного отдела позвоночника клиника представлена только болевым синдромом, и лишь у 7—34% из них имеются неврологические нарушения. Клиническая картина при ААД проявляется целой гаммой неврологических расстройств, связанных с компрессией ствола мозга, верхних отделов спинного мозга и с нарушением кровотока в вертебробазилярном бассейне.
Материал и методы
В 2015—2016 гг. нами оперированы 5 пациентов с ААД ревматоидного генеза — 4 женщины и 1 мужчина в возрасте от 54 до 73 лет. У всех больных был диагностирован ревматоидный артрит. Длительность заболевания составляла более 20 лет. Все дислокации были передними. У 3 пациентов была дислокация паннуса. В 2 случаях нефиксированной, с наличием ААД была ригидной и сочеталась с инвагинацией зубовидного отростка в большое затылочное отверстие (БЗО). Величина ААД определялась передним атлантодентальным интервалом и варьировала от 6 до 10 мм.
Всем пациентам с ревматоидным поражением КВО, помимо стандартных методов предоперационного обследования, проводилась функциональная спондилография для оценки степени ригидности деформации, что имело ключевое значение для выбора тактики хирургического лечения.
Клиническая картина, кроме болевого синдрома, спастического тетрапареза и проводниковых расстройств чувствительности, в отдельных случаях была представлена атаксией, нейрогенной дисфункцией тазовых органов, бульбарными расстройствами, преходящими ишемическими нарушениями кровообращения в вертебробазилярном бассейне. Мотивом обращения больных в стационар был, как правило, не болевой синдром, а прогрессирующий неврологический дефицит.
Выраженность неврологических расстройств находилась в прямой зависимости от величины ААД. Показанием для оперативного лечения являлось увеличение переднего атлантодентального интервала до 6 мм и более.
Алгоритм принятия клинических решений о выборе метода хирургического лечения определялся стабильностью деформации. Мобильные ААД являлись показанием для непрямой декомпрессии путем проведения инструментальной коррекции дислокации и атлантоаксиальной фиксации из заднего доступа. При фиксированных ААД задняя фиксация дополнялась передней декомпрессией из транс-орального доступа.
Для анализа результатов хирургического лечения использованы шкалы C. Ranawat (табл. 1 и 2), 

Инструментальная коррекция деформации и атлантоаксиальная фиксация винтовыми металлоконструкциями выполнена 3 больным с нефиксированными дислокациями. Винты вводились в боковые массы С1 позвонка и транспедикулярно в тело С2 позвонка по методу J. Harms, после чего проводились инструментальное устранение дислокации и монтаж металлоконструкции. В одном случае, когда коррекция ААД была недостаточной, с целью увеличения подвижности осуществлен артролиз боковых атлантоаксиальных суставов, для доступа к которым проводилась мобилизация С2 корешка с двух сторон.
При ригидных ААД, сочетавшихся с базилярной инвагинацией, проведены комбинированные одномоментные оперативные вмешательства. Первым этапом в одном случае выполнен окципитоспондилодез С0—С2—С3, в другом — задняя фиксация С1—С2 позвонков по методу Harms. Вторым этапом произведена трансоральная декомпрессия мозга (резекция передней дужки атланта и зубовидного отростка С2 позвонка).
Наблюдение № 1
Больная А., 54 лет. Клинический диагноз: ревматоидное поражение КВО. Нефиксированная ААД. Спастический тетрапарез. Нейрогенная дисфункция тазовых органов. Транзиторные ишемические нарушения в вертебробазилярной системе.
В течение 20 лет страдает ревматоидным артритом с поражением суставов кистей и стоп, коленных суставов с их вторичной деформацией. Клиническая картина представлена болевым синдромом, грубым спастическим тетрапарезом со снижением силы в руках и ногах до 3 баллов, мозжечковой и сенситивной атаксией, нейрогенной дисфункцией тазовых органов по центральному типу, преходящими нарушениями мозгового кровообращения по типу «дроп-атак» при резкой смене положения головы (Ranawat III B, боль 2 балла). Наблюдался симптом Лермитта. Неврологическая симптоматика манифестировала за 2 года до госпитализации и постепенно прогрессировала.
При функциональной спондилографии выявлен нефиксированный характер деформации (рис. 1, а, 
Операция: в положении больной на животе с фиксированной в скобе Mayfield головой осуществлена установка винтов в боковые массы С1 позвонка и транспедикулярно в тело С2 позвонка, произведены инструментальная редукция дислокации и монтаж металлоконструкции.
Течение послеоперационного периода гладкое. В неврологическом статусе отмечены увеличение силы в руках и ногах до 4—5 баллов, купирование болевого синдрома, регресс чувствительных расстройств и нормализация мышечного тонуса в конечностях, отсутствие симптомов нарушения кровообращения в вертебробазилярном бассейне (Ranawat I, боль 0 баллов).
Контрольные РКТ и спондилография подтвердили воссоздание правильных анатомических взаимоотношений в КВО, в том числе при функциональных пробах, отсутствие компрессии ствола мозга (рис. 2, а‒г). 
Наблюдение № 2
Больная А., 68 лет. Клинический диагноз: ревматоидное поражение КВО. Ригидная ААД. Спастический тетрапарез.
Страдает ревматоидным артритом более 20 лет, с вторичной деформацией суставов кистей и стоп. Неврологический статус представлен грубым спастическим тетрапарезом со снижением силы в руках и ногах до 3 баллов, бульбарными нарушениями (Ranawat III B, боль 0 баллов). Неврологические расстройства появились за несколько месяцев до госпитализации.
При РКТ и функциональной спондилографии выявлена фиксированная ААД со смещением зубовидного отростка в БЗО и грубой компрессией ствола мозга (рис. 3, а—г). 
Операция: первым этапом в положении больной на животе произведена резекция края БЗО и задней полудужки атланта, артролиз боковых атлантоаксиальных суставов, окципитоспондилодез винтовой металлоконструкцией с коррекцией деформации. После поворота на спину выполнена трансоральная резекция нижних отделов ската, передней полудужки атланта, зубовидного отростка до твердой мозговой оболочки.
Послеоперационный период протекал без осложнений. В неврологическом статусе отмечены положительная динамика в виде увеличения силы в руках до 4 баллов и в ногах до 3 баллов, регресс чувствительных расстройств и нормализация мышечного тонуса в конечностях (Ranawat III А, боль 0 баллов).
Контрольная РКТ подтвердила отсутствие сдавления ствола мозга как за счет проведенной декомпрессии, так и за счет инструментальной коррекции деформации КВО (рис. 4). 
Результаты
Обсуждение
Раннее формирование ААД характерно для ревматоидного поражения КВО. Тяжелые неврологические осложнения, а также риск их развития, определяют показания к оперативному лечению. Учитывая неблагоприятный прогноз, оперативное лечение в этих случаях должно проводиться как можно раньше.
Цель хирургического лечения ААД ревматоидного генеза — устранение сдавления ствола мозга и надежная фиксация пораженной области. Использование декомпрессивной ляминэктомии, протяженных задних фиксаций в настоящее время необходимо признать избыточными при лечении ревматоидного поражения КВО. Возможность проведения инструментальной коррекции ААД и надежной «короткой» фиксации из заднего доступа позволяет выполнить декомпрессию ствола мозга, восстановив правильные анатомические взаимоотношения в КВО, минимизировать операционную травму и значительно улучшить функциональные исходы лечения. Эта возможность определяется не только современными техническими средствами, но и особенностями ААД. К таким особенностям относится, в частности, стабильность деформации, которая определяет тактику хирургического лечения ААД.
Ригидность ААД зависит от длительности течения ревматоидного артрита. При манифестации ревматоидного поражения дислокационные осложнения имеют нефиксированный характер. Неврологические осложнения обусловлены дислоцированным зубовидным отростком и ревматоидной гранулемой. В этих случаях устранение деформации возможно с помощью задней фиксации по методу Harms. Эта техника позволяет избежать протяженной фиксации и обеспечивает оптимальные функциональные исходы лечения. Более того, фиксация С1—С2 позвонков приводит к купированию воспалительного процесса и самопроизвольному рассасыванию паннуса.
На поздней стадии заболевания вследствие фиброзно-костного анкилоза ААД становятся фиксированными. Показания к операции в этих случаях определяются наличием неврологических расстройств.
Кажущаяся очевидной необходимость транс-оральной декомпрессии будет неоправданной в случае сохранения даже минимальной мобильности ААД. В данной ситуации проведение артролиза атлантоаксиальных суставов, задней фиксации С1—С2 позвонков по методу Harms и инструментальной коррекции ААД позволяет выполнить непрямую декомпрессию ствола мозга, избежав трансорального вмешательства.
Трансоральная декомпрессия при ревматоидном поражении КВО показана только в случаях ригидных ААД после проведения окципитоспондилодеза или задней фиксации С1—С2 позвонков по методу Harms.
Выводы
Все пациенты с ревматоидным артритом должны быть целенаправленно обследованы для ранней диагностики поражения КВО. Учитывая риск развития неврологического дефицита, наличие дислокационных осложнений является абсолютным показанием к проведению хирургического лечения.
Диагностика стабильности деформации является ключевым фактором, определяющим тактику хирургического лечения.
При нефиксированных ААД, даже при наличии неврологического дефицита, показана инструментальная коррекция деформации и атлантоаксиального спондилодеза из заднего доступа.
Ригидные ААД являются показанием к хирургическому лечению при наличии неврологических расстройств. В этих случаях требуется выполнение окципитоспондилодеза или задней фиксации С1—С2 позвонков и трансоральной декомпрессии.
Авторы заявляют об отсутствии конфликта интересов.
Комментарий
Вработеописано 5 клиническихслучаевхирургическоголечениянестабильностиватлантоаксиальном сочленении на фоне ревматоидного артрита. Авторы используют общепринятую тактику лечения пациентов в зависимости от характера нестабильности (передняя, задняя) и давности процесса. Применяются все варианты хирургических доступов (в том числе трансоральный), а также различные варианты ограниченной и распространенной стабилизации.
Статья представляет интерес в связи с редкостью описываемой патологии.