Единичные макрофаги в щитовидной железе что это
Макрофаги в молочной и щитовидной железе
Осмотр и пальпация (ощупывание) щитовидной железы 
В молочной и щитовидной железе при этом можно определить уплотнения и другие изменения, которые могут быть признаком растущей опухоли. Однако не всегда узел в тканях говорит о раке. Также это может быть киста, доброкачественное новообразование и т.д. Чтобы сделать предположение о диагнозе и запланировать лечение, делают биопсию желез – добывают кусочек ткани и под микроскопом изучают его клеточный состав. Если речь идет о молочной железе, то женщинам также могут провести исследование выделений из соска. В зависимости от результатов микроскопии устанавливают, что у человека за болезнь и как ее лечить. Наличие определенных клеток во взятой пробе указывает на наличие конкретного заболевания.
В этом посте мы не будем детально описывать разные картины биоптата щитовидной и молочных желез, разберем лишь частный вопрос: присутствие в этих органах клеток-макрофагов.
Макрофаги в молочной железе:

Совершенно правильная логическая цепочка. Если в ткани молочной железы и выделениях из соска много фагоцитов, это говорит о патологии. Так, когда в препарате присутствуют нейтрофилы, макрофаги и гистиоциты (это разновидность макрофагов, находящаяся в норме в соединительной ткани), то это прямо указывает на наличие воспалительного процесса.
Перед лаборантом, изучающим добытый от пациента образец, стоит задача не только обнаружить, но и изучить строение найденных макрофагов. В них всегда немало всякого «мусора», который представляет собой остатки и фрагменты перевариваемых или уже переваренных ими агрессоров. Если удается распознать, что именно находится внутри макрофагов, это помогает понять, против чего боролись эти фагоциты, а значит, сделать вывод, что за болезнь у пациента.
Так, иногда встречаются макрофаги в молочной железе с включениями «обломков» эритроцитов и гемосидерина (гемосидерин – один из конечных продуктов разрушения гемоглобина). Если макрофаги с гемосидерином находят в препарате, это говорит о присутствии в железе полости, внутри которой находится кровь. Последнее встречается при посттравматических изменениях, при некоторых формах мастопатии.
Макрофаги в щитовидной железе:
Макрофаги и нейтрофилы в щитовидной железе также в большом количестве обнаруживаются при заболеваниях. Довольно распространена такая патология этого органа как киста. Сделав пункцию (прокол) кисты, специалисты получают жидкость. В ней мало клеток, среди них преобладают макрофаги с гемосидерином – их еще называют сидерофагами.
Также макрофаги в щитовидной железе могут встречаться при других заболеваниях, например, при воспалительном процессе. Однако при аутоиммунном тиреоидите, который является основным воспалительным заболеванием этого органа, таких фагоцитов в биоптате немного – в железе преобладают лимфоциты, а другие иммунные клетки встречаются реже.
Итак, присутствие большого количества макрофагов в описанных 
Кстати, когда речь идет о выздоровлении, важно не только непосредственно воздействовать на причину болезни (онкологический, воспалительный, дисгормональный процесс), но и уделять внимание поддержке иммунной системы, частью которой являются пресловутые макрофаги. Прием препарата Трансфер Фактор позволяет нормализовать деятельность иммунитета и помочь макрофагам в осуществлении их благого дела – борьбы с возбудителями заболеваний и другими вредоносными факторами.
Регулярная терапия этим средством может помочь выздороветь от большинства заболеваний молочной и щитовидной желез, а при профилактическом приеме предупредить их появление. При устойчивой и слаженной работе всех звеньев иммунитета, что достигается благодаря Трансфер Фактору, риск заболеть аутоиммунными, воспалительными и даже онкологическими процессами этих органов многократно уменьшается.
Цитологическая диагностика заболеваний щитовидной железы
Щитовидная железа – обильно кровоснабжаемый орган и в связи с возможными осложнениями трепанобиопсию с целью дооперационной гистологической диагностики не используют. Цитологическое исследование материала, полученного методом тонкоигольной аспирационной пункции щитовидной железы – простой, безопасный, дешевый, безболезненный дооперационный метод морфологической верификации патологического процесса, который при необходимости можно повторить. Кроме того, цитологическое исследование можно применять при срочной интраоперационной диагностике, обычно параллельно с гистологическим.
Цель цитологического исследования при заболеваниях щитовидной железы – уменьшение количества неоправданных хирургических вмешательств у пациентов с неопухолевыми процессами и выявление больных с опухолями для своевременного оперативного лечения и предотвращения или ранней диагностики злокачественных поражений.
Основным показанием к ТАБ является узловой зоб: все солитарные или доминантные узлы диаметром более 1 см, выявленные у эутиреоидных пациентов (при нормальном уровне ТТГ), необходимо пунктировать, желательно под контролем УЗИ. При эутиреозе ТАБ более предпочтительна в качестве начального диагностического исследования тиреоидного узла, чем сканирование. При тиреотоксикозе исследование оптимально начать со сканирования, однако результат сканирования не должен исключать необходимость ТАБ. Одиночные “холодные” узлы нужно пунктировать обязательно.
Контроль УЗИ при выполнении ТАБ необходим при узловых образованиях размером менее 1,5 см, кистозных (сложных) узлах для гарантированной аспирации тканевого компонента; узлах, локализованных по задней стенке или имеющих верхнегрудинное расположение и любых других узловых образований размером более 1 см, которые трудны для пальпации, особенно у пациентов крупного телосложения, с развитым мышечным слоем или с избыточно развитой подкожно-жировой клетчаткой. Естественно, что под контролем УЗИ необходимо проводить ТАБ при многоузловом зобе: при этом выбирают главные (доминантное) узлы (наиболее крупные или “неблагоприятные” с точки зрения лечащего врача или специалиста по ультразвуковой диагностике).
Однако цитологическое исследование способно помочь уточнить план ведения больных и при диффузном нетоксическом зобе, так как позволяет провести дифференциальный диагноз между коллоидным или паренхиматозным зобом и аутоиммунным тиреоидитом.
При четких клинических признаках злокачественного процесса морфологическая верификация также необходима для уточнения плана лечения. В частности, при анаплазированном раке и злокачественной лимфоме оперативное вмешательство не показано, а лечебная тактика различна.
Получение материала
Очень важно, чтобы эндокринологи, хирурги, врачи-радиологи и цитологи работали сообща. Целью их совместной работы должен быть обмен информацией, полученной на разных этапах обследования и лечения, для оптимальной лечебной тактики и непрерывности наблюдения.
Первым этапом обследования является пальпация шеи для исключения образований, не связанных со щитовидной железой. ТАБ должен выполнять опытный врач (хирург или врач ультразвуковой диагностики). Пункция под контролем УЗИ позволяет уменьшить вероятность ошибочных, и, что наиболее важно, ложноотрицательных заключений, связанных с тем, что игла не попадает в патологический очаг. Сведения о результатах УЗИ помогают цитологу правильно трактовать клеточный состав мазков.
Пункцию ЩЖ выполняют в положении больного лежа на спине с небольшой подушкой под шеей и плечами, мышцы шеи расслаблены. Такое положение позволяет обеспечить оптимальный доступ к пунктируемому участку. Пациента нужно предупредить о том, что он во время процедуры не должен разговаривать или глотать. Используют иглы 23 калибра (с наружным диаметром 0,8 мм). Можно использовать местную анестезию лидокаином. Обычно достаточно уколов иглы в двух-трех направлениях, в редких случаях для получения полноценного материала необходимы множественные “пассы”. Значительно улучшаются результаты исследования, если пунктат сразу оценивается цитологом (срочная цитологическая диагностика на наличие клеточного материала); при получении неполноценного материала сразу же выполняется повторная пункция.
Для исключения злокачественного характера поражения считают необходимым не менее двух пункций – при первичном осмотре и в динамике. Материал распределяют на стеклах тонким слоем. Если при пункции щитовидной железы получают обильный кровянистый материал (что бывает достаточно часто), его распределяют на нескольких стеклах, готовя тонкие препараты, как мазки крови. Материал, содержащий жидкость, необходимо центрифугировать и готовить препараты из осадка. Значительно улучшается качество мазков при использовании цитоцентрифуги типа Cytospin, Сellspin, Rotorfix и др.
Приготовление препаратов
Следует помнить о том, что, как правило, при пункции щитовидной железы получается достаточно обильный кровянистый материал, и, если не предполагается использование жидкостной цитологии, следует весь материал распределить на стеклах возможно более тонким слоем, помещая на каждое стекло небольшую каплю и готовя препараты с помощью шпателя или стекла со шлифованным краем, как мазки крови.
Оптимальными методами окрашивания препаратов из щитовидной железы являются модификации метода Романовского: Мая-Грюнвальда-Гимзы, Лейшмана и другие, а если используется жидкостная цитология, до помещения материала в контейнер со стабилизирующим раствором желательно сделать один-два мазка и высушить их на воздухе для последующего окрашивания по Романовскому.
Интерпретация результатов
Цитолог должен интересоваться вопросами тиреоидной цитологии и иметь опыт в этой области. Если опытного в области тиреоидологии цитолога в пределах медицинского учреждения нет, микропрепараты должны быть отосланы опытному врачу, практикующему за пределами данного учреждения. Цитолог должен с готовностью пересматривать микропрепараты вместе с лечащим врачом пациента при возникновении такой необходимости.
Цитологическое исследование материала из щитовидной железы представляет значительные сложности в связи с тем, что критерии диагностики тех или иных доброкачественных и злокачественных патологических процессов отличаются от критериев, используемых при исследовании материала из других органов и тканей. Для того, чтобы освоить цитологическую диагностику поражений щитовидной железы, необходимо иметь достаточный опыт (не менее трех лет) полноценной работы в других разделах клинической цитологии, обучение в специализированных лабораториях, а также накопить опыт самостоятельной работы, консультируя сложные диагностические наблюдения у опытных коллег.
Трактовка цитологического заключения
В настоящее время во многих медицинских учреждениях мира при цитологическом исследовании щитовидной железы используется терминология Bethesda: The Bethesda System for Reporting Thyroid Cytopathology (BSRTS), принятая на конференции Национального Института Рака, 22–23 октября 2007 в г. Бетесда (США, Мэриланд). В соответствии с этой терминологией описание каждой ТАБ начинают с основных диагностических категорий, каждая из которых имеет определенный риск злокачественности и в зависимости от степени риска каждая категория связана с дальнейшей клинически обоснованной тактикой:
I. Недиагностический или неудовлетворительный материал.
II. Доброкачественные изменения.
III. Атипия неясного значения или фолликулярные поражения неясного значения.
IV. Фолликулярная опухоль или подозрение на фолликулярную опухоль.
V. Подозрение на злокачественную опухоль.
VI. Злокачественная опухоль.
При получении полноценного материала и возможности более точно интерпретировать полученный клеточный состав, можно ожидать от врача-цитолога более точное заключение в уверенной или предположительной форме в соответствии с цитологическими и гистологическими (МКБ-О) классификациями (при доброкачественных неопухолевых поражениях – тиреоидит (аутоиммунный, гранулематозный, фиброзный), клеточный или коллоидный зоб и другие поражения, при злокачественных поражениях – уточнение формы рака (папиллярный, фолликулярный, медуллярный, недифференцированный, анапластический), по возможности с результатами молекулярно-биологических и молекулярно-генетических исследований. Заключения цитолога “материал получен из участка кистозной дегенерации” или “лимфоидной инфильтрации” обычно связаны с доброкачественными поражениями (зоб с кистозной дегенерацией, лимфоматозный тиреоидит и др.), однако не исключают опухолевого процесса, поэтому для уточнения диагноза необходима повторная пункция с более тщательным ее выполнением.
Если ТАБ проведена неадекватно или не обладает диагностической ценностью, повторная ТАБ с более тщательным соблюдением правил пункции часто позволяет получить клеточный материал для постановки диагноза. Предпочтительно, чтобы повторная ТАБ проводилась под контролем УЗИ.
Интеграция различных лабораторных методов
При установлении цитологического диагноза большое значение имеют данные исследования гормонального статуса щитовидной железы. Для уточнения морфологического диагноза используют иммуноцитохимические или другие молекулярные, в том числе молекулярно-генетические исследования. Резко выраженная иммуноцитохимическая реакция опухолевых клеток на мезотелин (HBME) и галектин подтверждает злокачественный характер опухоли. При подозрении на метастазы папиллярного или фолликулярного рака щитовидной железы возможно уточнение природы с помощью определения тиреоглобулина.
Генетическая предрасположенность, нестабильность генома RET/PTC способны “запустить” механизм возникновения злокачественной трансформации, дальнейшие повреждения в геноме (ТР53, CTNNB1 и другие генетические изменения способствуют прогрессии опухоли). В зависимости от молекулярно-генетических находок можно определять фенотипические особенности опухоли и прогноз заболевания.
Одураченные макрофаги, или Несколько слов о том, как злокачественные опухоли обманывают иммунитет
Макрофаг атакует раковую клетку
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Иммунная система — это мощная многослойная защита нашего организма, которая потрясающе эффективна против вирусов, бактерий, грибов и других патогенов извне. Кроме того, иммунитет способен эффективно распознавать и уничтожать трансформированные собственные клетки, которые могут перерождаться в злокачественные опухоли. Однако сбои в работе иммунной системы (по генетическим либо другим причинам) приводят к тому, что однажды злокачественные клетки берут верх. Разросшаяся опухоль становится нечувствительной к атакам организма и не только успешно избегает уничтожения, но и активно «перепрограммирует» защитные клетки для обеспечения собственных нужд. Поняв механизмы, которые опухоль использует для подавления иммунного ответа, мы сможем разработать контрмеры и попытаться сдвинуть баланс в сторону активации собственных защитных сил организма для борьбы с болезнью.
Конкурс «био/мол/текст»-2014
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2014 в номинации «Лучший обзор».
Главный спонсор конкурса — дальновидная компания Генотек.
Конкурс поддержан ОАО «РВК».
Спонсором номинации «Биоинформатика» является Институт биоинформатики.
Спонсором приза зрительских симпатий выступила фирма Helicon.
Свой приз также вручает Фонд поддержки передовых биотехнологий.
Опухоль и иммунитет — драматический диалог в трех частях с прологом
Долгое время считалось, что причина низкой эффективности иммунного ответа при раке — то, что опухолевые клетки слишком похожи на нормальные, здоровые, чтобы иммунная система, настроенная на поиск «чужаков», могла их как следует распознавать. Этим как раз и объясняется тот факт, что иммунная система успешнее всего противостоит опухолям вирусной природы (их частота резко возрастает у людей, страдающих иммунодефицитом). Однако позже стало ясно, что это не единственная причина.
Если в этой статье речь идет про иммунные аспекты рака, то в работе «Страшней клешней на свете нет. » [1] можно прочесть про особенности ракового метаболизма. — Ред.
Оказалось, что взаимодействие раковых клеток с иммунной системой носит гораздо более разносторонний характер. Опухоль не просто «прячется» от атак, она умеет активно подавлять местный иммунный ответ и перепрограммировать иммунные клетки, заставляя их обслуживать собственные злокачественные нужды.
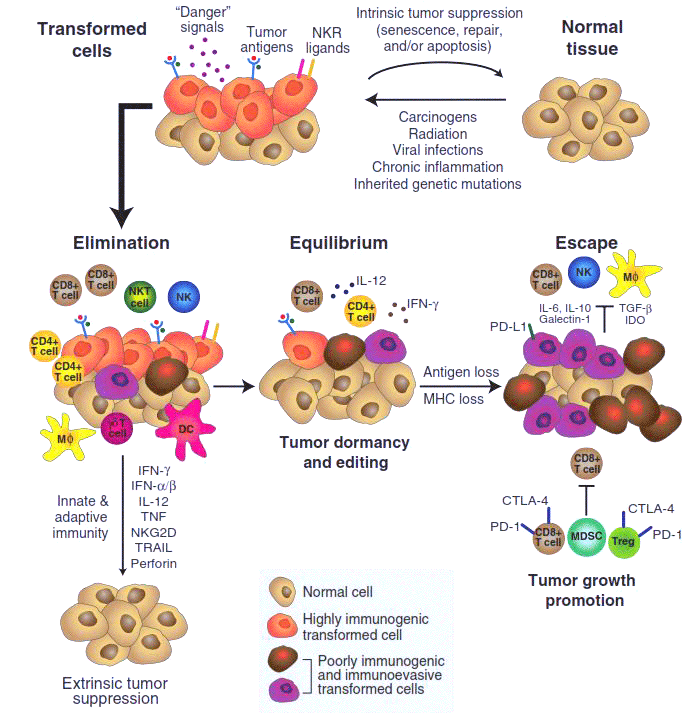
«Диалог» между переродившейся, вышедшей из-под контроля клеткой с ее потомством (то есть будущей опухолью) и организмом развивается в несколько стадий, и если вначале инициатива почти всецело находится на стороне защитных сил организма, то в конце (в случае развития болезни) — переходит на сторону опухоли. Несколько лет назад учеными-онкоиммунологами была сформулирована концепция «иммуноредактирования» (immunoediting), описывающая основные этапы этого процесса (рис. 1) [2].
Рисунок 1. Иммуноредактирование (immunoediting) в процессе развития злокачественной опухоли.
Первая стадия иммуноредактирования — процесс устранения (elimination). Под действием внешних канцерогенных факторов или в результате мутаций нормальная клетка «трансформируется» — приобретает способность неограниченно делиться и не отвечать на регуляторные сигналы организма. Но при этом она, как правило, начинает синтезировать на своей поверхности особые «опухолевые антигены» и «сигналы опасности». Эти сигналы привлекают клетки иммунной системы, прежде всего макрофаги, натуральные киллеры и Т-клетки. В большинстве случаев они успешно уничтожают «испортившиеся» клетки, прерывая развитие опухоли. Однако иногда среди таких «предраковых» клеток оказывается несколько таких, у которых иммунореактивность — способность вызывать иммунный ответ — по каким-то причинам оказывается ослабленной, они синтезируют меньше опухолевых антигенов, хуже распознаются иммунной системой и, пережив первую волну иммунного ответа, продолжают делиться.
В этом случае взаимодействие опухоли с организмом выходит на вторую стадию, стадию равновесия (equilibrium). Здесь иммунная система уже не может полностью уничтожить опухоль, но еще в состоянии эффективно ограничивать ее рост. В таком «равновесном» (и не обнаруживаемом обычными методами диагностики) состоянии микроопухоли могут существовать в организме годами. Однако такие затаившиеся опухоли не статичны — свойства составляющих их клеток постепенно меняются под действием мутаций и последующего отбора: преимущество среди делящихся опухолевых клеток получают такие, которые способны лучше противостоять иммунной системе, и в конце концов в опухоли появляются клетки-иммуносупрессоры. Они в состоянии не только пассивно избегать уничтожения, но и активно подавлять иммунный ответ. По сути, это эволюционный процесс, в котором организм невольно «выводит» именно тот вид рака, который его убьет.
Этот драматический момент знаменует собой переход опухоли к третьей стадии развития — избегания (escape), — на которой опухоль уже малочувствительна к активности клеток иммунной системы, более того — обращает их активность себе на пользу. Она принимается расти и метастазировать. Именно такая опухоль обычно диагностируется медиками и изучается учеными — две предыдущие стадии протекают скрыто, и наши представления о них основаны главным образом на интерпретации целого ряда косвенных данных.
Дуализм иммунного ответа и его значение в канцерогенезе
Существует множество научных статей, описывающих, как иммунная система борется с опухолевыми клетками, но не меньшее количество публикаций демонстрирует, что присутствие клеток иммунной системы в ближайшем опухолевом окружении является негативным фактором, коррелирующим с ускоренным ростом и метастазированием рака [2], [3]. В рамках концепции иммуноредактирования, описывающей, как изменяется характер иммунного ответа по мере развития опухоли, подобное двойственное поведение наших защитников получило, наконец, свое объяснение.
Переориентирование иммунной системы от борьбы с опухолью на ее защиту возможно благодаря пластичности клеток этой системы. Говоря об иммунном ответе, мы, как правило, используем «воинственные» метафоры — «борьба», «уничтожение», «подавление». Но мало уничтожить врага, будь то вирус, бактерия или другой паразит. Организм должен еще и исправить причиненные им повреждения. Регенерация поврежденных тканей и заживление ран тоже находятся под контролем клеток иммунной системы: она не только «воин», но еще и «целитель». Коварство рака заключается в том, что, будучи по сути «чужеродным агентом» в организме, он выделяет специальные вещества, которые подавляют активный иммунный ответ и побуждают лейкоциты воспринимать опухоль не как врага, требующего уничтожения, а как рану, требующую помощи, защиты и исцеления.
Мы рассмотрим некоторые механизмы того, как это происходит, на примере макрофагов. Похожие приемы опухоль использует и для того, чтобы обманывать другие клетки врожденного и приобретенного иммунитета.
Макрофаги — «клетки-воины» и «клетки-целители»
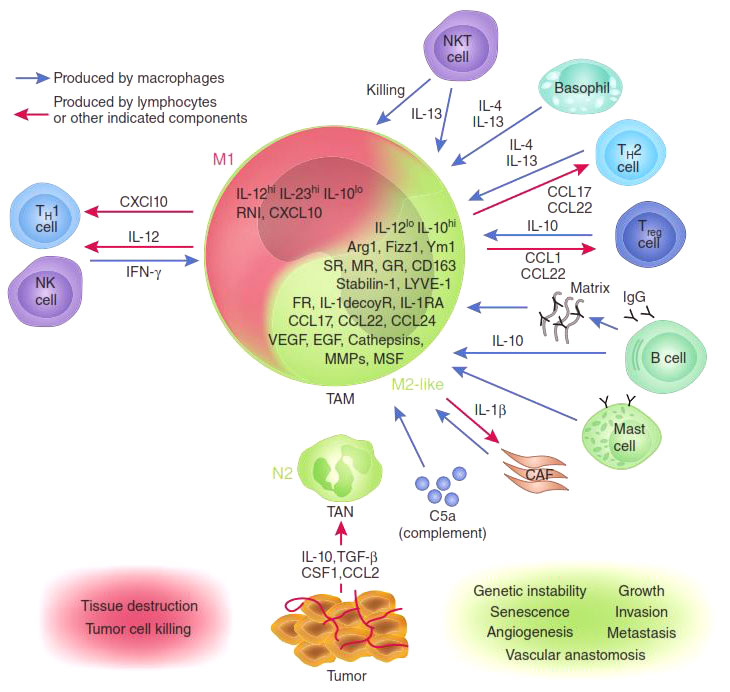
В зависимости от преобладающей активности различают две группы макрофагов: М1 и М2. М1-макрофаги (их еще называют классически активированными макрофагами) — «воины» — отвечают за уничтожение чужеродных агентов (в том числе и опухолевых клеток), как напрямую, так и за счет привлечения и активации других клеток иммунной системы (например, Т-киллеров). М2 макрофаги — «целители» — ускоряют регенерацию тканей и обеспечивают заживление ран [4], [8].
Присутствие в опухоли большого количества М1-макрофагов тормозит ее рост [5], а в некоторых случаях может вызвать даже практически полную ремиссию (уничтожение). И наоборот: М2-макрофаги выделяют молекулы — факторы роста, которые дополнительно стимулируют деление опухолевых клеток, то есть благоприятствуют развитию злокачественного образования. Экспериментально было показано, что в опухолевом окружении обычно преобладают именно М2-клетки («целители»). Хуже того: под действием веществ, выделяемых опухолевыми клетками, активные М1-макрофаги «перепрограммируются» в М2-тип [6], перестают синтезировать антиопухолевые цитокины, такие как интерлейкин-12 (IL12) или фактор некроза опухолей (TNF) и начинают выделять в окружающую среду молекулы, ускоряющие рост опухоли и прорастание кровеносных сосудов, которые будут обеспечивать ее питание, например фактор роста опухолей (TGFb) и фактор роста сосудов (VGF). Они перестают привлекать и инициировать другие клетки иммунной системы и начинают блокировать местный (противоопухолевый) иммунный ответ (рис. 2).
Рисунок 2. М1- и М2-макрофаги: их взаимодействие с опухолью и другими клетками иммунной системы.
Ключевую роль в этом перепрограммировании играют белки семейства NF-kB [7]. Эти белки являются транскрипционными факторами, контролирующими активность множества генов, необходимых для М1 активации макрофагов. Наиболее важные представители этого семейства — р65 и р50, вместе образующие гетеродимер р65/р50, который в макрофагах активирует множество генов, связанных с острым воспалительным ответом, таких как TNF, многие интерлейкины, хемокины и цитокины. Экспрессия этих генов привлекает все новые и новые иммунные клетки, «подсвечивая» для них район воспаления. В то же время другой гомодимер семейства NF-kB — р50/р50 — обладает противоположной активностью: связываясь с теми же самыми промоторами, он блокирует их экспрессию, снижая градус воспаления.
И та, и другая активность NF-kB транскрипционных факторов очень важна, но еще важнее равновесие между ними. Было показано, что опухоли целенаправленно выделяют вещества, которые нарушают синтез p65 белка в макрофагах и стимулируют накопление ингибиторного комплекса р50/р50 [7]. Таким способом (помимо еще ряда других) опухоль превращает агрессивных М1-макрофагов в невольных пособников своего собственного развития: М2-тип макрофагов, воспринимая опухоль как поврежденный участок ткани, включают программу восстановления, однако секретируемые ими факторы роста только добавляют ресурсы для роста опухоли. На этом цикл замыкается — растущая опухоль привлекает новые макрофаги, которые перепрограммируются и стимулируют ее рост вместо уничтожения.
Реактивация иммунного ответа — актуальное направление антираковой терапии
Таким образом, в ближайшем окружении опухолей присутствует сложная смесь молекул: как активирующих, так и ингибирующих иммунный ответ. Перспективы развития опухоли (а значит, перспективы выживания организма) зависят от баланса ингредиентов этого «коктейля». Если будут преобладать иммуноактиваторы — значит, опухоль не справилась с задачей и будет уничтожена или ее рост сильно затормозится. Если же преобладают иммуносупрессорные молекулы — это значит, что опухоль смогла подобрать ключ и начнет быстро прогрессировать. Понимая механизмы, которые позволяют опухолям подавлять наш иммунитет, мы сможем разработать контрмеры и сдвинуть баланс в сторону уничтожения опухолей [8].
Как показывают эксперименты, «перепрограммирование» макрофагов (и других клеток иммунной системы) обратимо. Поэтому одним из перспективных направлений онко-иммунологии на сегодняшний день является идея «реактивации» собственных клеток иммунной системы пациента с целью усиления эффективности других методов лечения. Для некоторых разновидностей опухолей (например, меланом) это позволяет добиться впечатляющих результатов. Другой пример, обнаруженный группой Меджитова [9], — обычный лактат, молекула, которая производится при недостатке кислорода в быстрорастущих опухолях за счет эффекта Варбурга [10]. Эта простая молекула стимулирует перепрограммирование макрофагов, заставляя их поддерживать рост опухоли. Лактат транспортируется внутрь макрофагов через мембранные каналы, и потенциальная терапия заключается в блокировке этих каналов.
Биомаркеры [11] и биоинформатический анализ [12] — лишь некоторые из таких методов. — Ред.