Если потерял много крови чем восстановить
Как донорство влияет на здоровье донора
«Максимум пользы пациенту – никакого вреда донору» – этот принцип неукоснительно соблюдается работниками Службы крови.
Донорство не наносит вреда организму, если человек здоров. Заготовка крови от донора допустима только при условии, что его здоровью не будет причинен вред. При этом объем одной донации не должен превышать 12 % объема циркулирующей крови, который в норме составляет 6,5-7 % от массы тела. Стандартный объем заготовки крови (донации) 450 ± 50 мл без учета количества крови, взятой для анализов (до 40 мл), у лиц с массой тела не менее 55 кг обеспечивает безопасность здоровья донора крови.
Каждая кровопотеря в стандартном объеме вызывает ряд изменений в организме донора: снижается уровень гемоглобина (в течение 5 дней после донации на 2-10% по сравнению с исходным показателем), уменьшается число эритроцитов (с первых часов после взятия крови и в течение последующих 5 дней).
Полное восстановление состава крови происходит в течение 40-50 дней. Скорость восстановления разных компонентов крови (плазмы и клеток крови) различна. Эритроциты восстанавливаются в организме донора в течение 4-6 недель, а лейкоциты и тромбоциты – к концу первой недели, состав плазмы – в течение 1-2 дней, уровень гемоглобина – в течение месяца. Доказано, что у лиц, дававших кровь многократно, восстановление показателей периферической крови происходит быстрее, чем у первичных (впервые сдающих) доноров. Это объясняется «тренировкой» кроветворных органов повторными кровопусканиями.
Чтобы состав крови быстрее восстановился, рекомендуется пить больше жидкости – соки, чай. В рационе донора всегда должен присутствовать белок, от которого зависит уровень гемоглобина в крови (продукты, содержащие белок: мясо, свекла, гречка, чечевица, фасоль и все бобовые, рыба и др.).
Реакция на взятие крови индивидуальная. Она зависит от многих факторов: психоэмоционального состояния, физической нагрузки, питания, бытовых условий доноров, погодных условий.
Потеря стандартного объема крови сопровождается изменениями, имеющими двоякое происхождение. Сразу после дачи крови или же в ближайшие часы развивается так называемая стрессовая реакция на обстановку и процедуру взятия крови, зависящая от типа нервной системы и гормональных особенностей донора, и реакция на потерю клеток и веществ, содержащихся в крови. Непосредственно после взятия крови у доноров отмечается изменения некоторых гемодинамических показателей: снижение венозного и артериального давления, ускорение тока крови, незначительное учащение пульса. Реакция на кровопотерю непродолжительная, нормализация сердечно-сосудистой деятельности наступает в течение 30-60 минут. В этот период донорам рекомендуется отдых.
После донации у некоторых доноров может наблюдаться некоторое снижение мышечной силы, а также увеличение процента ошибок при решении проверочных математических и логических задач. Это указывает на изменения регулирующих механизмов нервной системы, что сказывается на трудовой деятельности. В связи с этим донорам, работа которых связана с большим эмоциональным напряжением и требует быстрых и точных реакций (например: водители транспорта, крановщики, высотники и др.), не рекомендуется приступать к ней непосредственно после дачи крови.
Для любого здорового взрослого человека процесс донации крови безопасен и не наносит вреда организму. Повторные взятия крови благоприятно влияют на центральную нервную систему, а через нее на обменные процессы всего организма. По данным исследования финских ученых, мужчины, сдающие кровь, в десятки раз меньше подвержены инфаркту миокарда, ишемической болезни сердца; данные американских исследователей подтверждают, что мужчины-доноры на 30% меньше страдают заболеваниями сердечно-сосудистой системы; регулярная донация крови поддерживает на должном уровне содержание холестерина, что, в свою очередь, обеспечивает профилактику (предупреждение развития) атеросклероза.
У тех, кто сдает кровь регулярно, больше шансов выжить в экстремальных ситуациях, таких как дорожно-транспортные происшествия, ожоги, тяжелые операции. Организм донора, регулярно сдающего кровь и ее компоненты, при кровопотере быстро активизирует систему кроветворения, что способствует скорейшему выздоровлению. Кроме того, кровь доноров чаще обновляется, выводятся «старые» клетки крови, и доноры, по данным Всемирной организации здравоохранения (ВОЗ), живут в среднем на 5 лет дольше тех, кто кровь не сдает.
Донация крови и ее компонентов полезна для профилактики заболеваний органов желудочно-кишечного тракта (желудка, кишечника, поджелудочной железы, печени), обмена веществ и болезней иммунной системы, что связано с обновлением организма и активацией иммунной защиты.
Что такое маточное кровотечение? Причины возникновения, диагностику и методы лечения разберем в статье доктора Гончарова Е. Ю., гинеколога со стажем в 6 лет.
Определение болезни. Причины заболевания
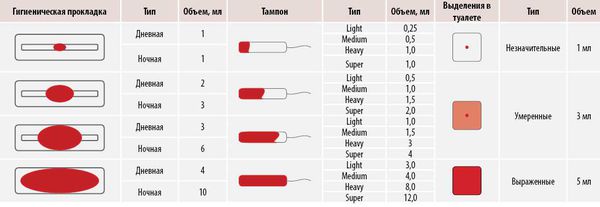
Виды аномального маточного кровотечения (АМК):
Для расчёта объёма менструации следует просуммировать все кровопотери за цикл.
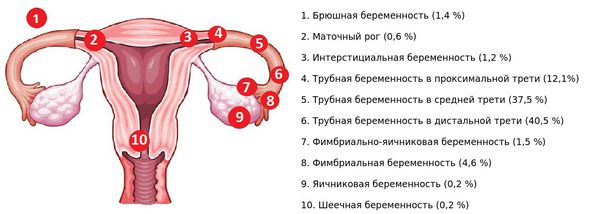
Маточное кровотечение может возникнуть на ранних или поздних сроках беременности. Кровотечение на любом сроке беременности требует срочной медицинской помощи.
К возникновению маточного кровотечения следует быть особенно внимательным при подозрении на злокачественный процесс в матке.
К органическим причинам относят:
К неорганическим причинам относят:
К ятрогенным причинам АМК также относятся:
На ранних сроках беременности (до 20 недель включительно) причинами маточного кровотечения могут быть:
На поздних сроках беременности (с 20 недель) причиной маточного кровотечения могут быть:
Симптомы маточного кровотечения
Небеременной женщине следует обращаться к врачу при следующих симптомах:
При беременности не должно быть кровянистых выделений. Если они появились, то нужно немедленно обратиться к врачу.
Патогенез маточного кровотечения
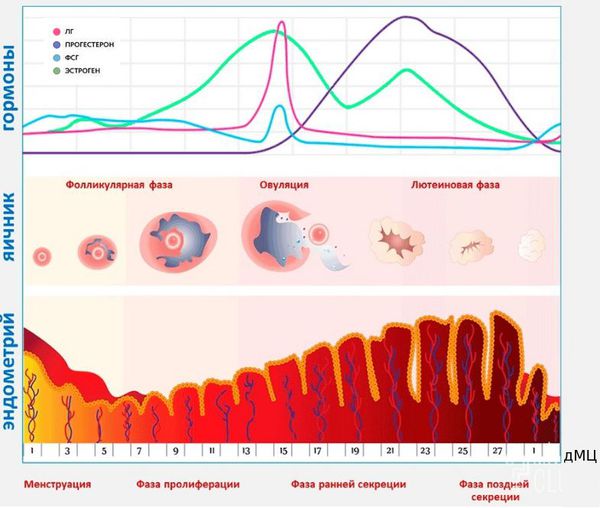
Менструация — это периодические кровянистые выделения с отторжением эндометрия из матки через влагалище. Менструации происходят в течение всего репродуктивного периода жизни женщины при отсутствии беременности.
Основываясь на функции яичников и эндометрия, нормальный менструальный цикл можно разделить на три фазы:
Патогенез аномального маточного кровотечения различается в зависимости от причин возникновения:
Эндометриальные факторы:
Классификация и стадии развития маточного кровотечения
Различают острое и хроническое маточное кровотечение:
Также маточные кровотечения различаются по возрасту пациенток:
Осложнения маточного кровотечения
На фоне маточного кровотечения возможны:
Диагностика маточного кровотечения
При маточном кровотечении следует:
Лечение маточного кровотечения
При остром маточном кровотечении и для женщин от 35 лет предпочтительно хирургическое лечение:
Негормональное медикаментозное лечение (для молодых девушек до 35 лет) включает:
Комбинированные оральные контрацептивы:
Принимать по одной таблетке каждые 3-4 часа (до шести таблеток в сутки) до полного прекращения кровотечения. Затем приём следует продолжить, уменьшая количество таблеток на одну в день. Когда останется одна таблетка в день, следует принимать их до 21 дня с начала приёма. Затем сделать перерыв в 7 дней (появятся кровянистые менструальноподобные выделения). После продолжить по одной таблетке в день 21 день, потом снова 7 дней перерыв. Курс составляет шесть и более месяцев.
Гестагенные препараты:
Подводя итог:
Если после гистологического исследования биоптата из матки обнаруживают злокачественные изменения, то применяют гистерэктомию (удаление матки) с возможным удалением придатков и региональных лимфоузлов. Если стоит вопрос о репродуктивной функции женщины, а яичники сохранить невозможно, рекомендована криоконсервация ооцитов.
Прогноз. Профилактика
Прогноз при своевременном лечении для жизни благоприятный. В зависимости от причин и способов терапии прогноз для репродуктивной функции положительный за исключением проведения гистерэктомии и абляции эндометрия. После отмены гормональных препаратов прогноз для репродуктивной функции также благоприятный.
Профилактика маточного кровотечения:
Оценка тяжести кровопотери в хирургической практике. Часть II
Клиническая оценка тяжести кровопотери является исторически самым ранним способом определения нарушений постгеморрагических нарушений гомеостаза, но в настоящее время – самым распространенным способом. Описание основополагающих клинических признаков травматического повреждения с острой кровопотерей мы находим уже в дневниках Н. И. Пирогова, относящихся к периоду Крымской кампании 1854 года: «Лежит такой окоченелый на перевязочном пункте неподвижно; он не кричит, не вопит, не жалуется, не принимает ни в чем участия и ничего не требует; тело его холодно, лицо бледно, как у трупа; взгляд неподвижен и обращен вдаль; пульс как нитка, едва заметен под пальцем и с частыми перемежками. На вопросы окоченелый или вовсе не отвечает, или только про себя, чуть слышным шепотом; дыхание тоже едва приметно. ». Клиническая характеристика кровопотери, основанная на оценке уровня сознания, окраски и температуры кожных покровов, тонуса периферических вен, частоты пульса и дыхания, актуальна и в настоящее время.
Скрининговым методом оценки тяжести кровопотери является предложенный в 1967 году Алговером и Бури шоковый индекс, представляющий собой отношение частоты сердечных сокращений к систоличекому артериальному давлению. Чем выше индекс, тем массивнее кровопотеряе и хуже прогноз. В норме индекс равен 0, 5. Нарастание индекса Альговера свидетельствует о прогрессировании тяжести кровопотери:
Величина
шокового индекса
Ориентировочный
дефицит ОЦК
0, 9 – 1, 2
1, 3 – 1, 4
В связи с этим, все большему числу клиницистов представляются более физиологически обоснованными и клинически значимыми классификации кровопотери, основанные на клинически определяемой степени резистентности к ней организма. Именно уровень компенсации перенесенной кровопотери представляет несомненный практический интерес, ведь все последующие лечебные мероприятия направлены на стабилизацию функций организма, в той или иной степени нарушенных при кровотечении. Несомненно, к тому же, что в экстренной ситуации целесообразной и практически применимой является такая система оценки кровопотери, которая бы на основании минимального количества параметров позволяла адекватно и быстро определять тяжесть кровопотери не только в стационаре, но уже и на догоспитальных этапах медицинской помощи. Так, Н. А. Яицкий и соавт. (2002) разделяют острую кровопотерю на три степени только на основании величин АДсист и ЧСС (табл. 1)
Степень кровопотери
Лежа на спине
Сидя
АДсист, мм Hg
ЧСС, в мин
АДсист, мм Hg
ЧСС, в мин
Легкая
Средняя
Тяжелая
Являясь отражением состояния макроциркуляции и, весьма ориентировочно, состояния микроциркуляции, измерение АД может служит быстрым методом оценки гемодинамики и проведения простого ее мониторинга.
В современной клинической практике наибольшее распространение получили методы оценки тяжести кровопотери, имеющие в своей основе анализ комплекса клинических и рутинных лабораторных критериев.
В 1982 году Американская коллегия хирургов на основании интегрального анализа десятков тысяч случаев острых кровотечений различной этиологии, предложила дифференцировать кровопотерю на 4 класса кровотечений в зависимости от клинической симптоматики (по P. L. Marino, 1998):
класс I – при этом клинические симптомы отсутствуют или имеется тахикардия в покое, прежде всего в положении стоя; ортостатической тахикардия считается тогда, когда ЧСС увеличивается не менее, чем 20 ударов в 1 минуту, при переходе из горизонтального положения в вертикальное (соответствует потере 15% объема циркулирующей крови или менее) ;
класс II – основным клиническим признаком его является ортостатическая гипотензия или снижение АД не менее, чем на 15 мм. рт. ст при переходе из горизонтального положения в вертикальное, в положении лежа АД нормальное или несколько снижено, диурез сохранен (соответствует потере от 20 до 25% ОЦК) ;
класс III – проявляется гипотензией в положении лежа на спине, олигурией менее 400 мл/сутки (соответствует потере от 30 до 40% ОЦК) ;
класс IV – проявляется коллапсом и нарушением сознания до комы (потеря более 40% ОЦК).
В современной рациональной трансфузиологии основными ориентирами оценки тяжести кровопотери также являются адекватное сознание, достаточный диурез (> 0, 5 мл/кг/час), отсутствие гипервентиляции, показатели гемокоагуляции, динамика центрального венозного, пульсового и среднего динамического давления, изменение артерио-венозной разницы по кислороду (А. П. Зильбер, 1999; В. С. Ярочкин 1997, 2004).
Одной из последних отечественных классификаций острой кровопотери предложена А. И. Воробьевым (2002). Автор подчеркивает, что именно клинические, а не лабораторные показатели должны являться определяющими в оценке тяжести кровопотери (табл. 2).
Показатель
Степень тяжести
Пульс, в мин.
Пульсовое давление
Нормальное или повышено
ЧДД, в мин.
Почасовой диурез, мл
Состояние ЦНС
Объем кровопотери, мл
(% ОЦК)
В повседневной клинической практике мы используем классификацию тяжести кровопотери, основанную как на оценке клинических критериев (уровень сознания, признаки периферической дисциркуляции, АД, ЧСС, ЧДД, ортостатическая гипотензия, диурез), так и на оценке основополагающих показателей картины красной крови – величин гемоглобина и гематокрита (В. К. Гостищев, М. А. Евсеев, 2005). Классификация различает четыре степени тяжести острой кровопотери:
I степень (легкая кровопотеря) – характерные клинические симптомы отсутствуют, может иметь место ортостатическая тахикардия, уровень гемоглобина выше 100 г/л, гематокрит – не менее 40%. Отражает величину дефицита ОЦК до 15%.
II степень (кровопотеря средней тяжести) – из клинических симптомов определяется ортостатическая гипотензия со снижением АД более чем на 15 мм рт. ст. и ортостатическая тахикардия с увеличением ЧСС более чем на 20 ударов в минуту, уровень гемоглобина в пределах 80 – 100 г/л, гематокрит – в пределах 30 – 40%. Отражает величину дефицита ОЦК 15 – 25%.
III степень (тяжелая кровопотеря) – клинически определяются признаки периферической дисциркуляции (дистальные отделы конечностей холодные наощупь, выраженная бледность кожи и слизистых), гипотония (АДсист находится в пределах 80 – 100 мм рт. ст. ), тахикардия (ЧСС более 100 в минуту), тахипноэ (ЧДД более 25 в минуту), явления ортостатического коллапса, диурез снижен (менее 20 мл/час), уровень гемоглобина находится в пределах 60 – 80 г/л, гематокрит – в пределах 20 – 30%. Отражает величину дефицита ОЦК 25 – 35%.
IV степень (кровопотеря крайней степени тяжести) – из клинических симптомов характерными являются нарушение сознания, глубокая гипотония (АДсист менее 80 мм рт. ст. ), выраженные тахикардия (ЧСС более 120 в минуту) и тахипноэ (ЧДД более 30 в минуту), признаки периферической дисциркуляции, анурия; уровень гемоглобина находится ниже 60 г/л, гематокрита – 20%. Отражает величину дефицита ОЦК больше 35%.
В основу данной классификации положена оценка наиболее значимых клинических симптомов, отражающих реакцию организма на кровопотерю. Определение уровня гемоглобина и гематокрита представляется также весьма важным в оценке тяжести кровопотери, особенно при III и IV степени тяжести, поскольку в данной ситуации гемический компонент постгеморрагической гипоксии становится весьма существенным. Кроме того, уровень гемоглобина по-прежнему является решающим критерием для определения показаний для трансфузии эритроцитарной массы.
Следует заметить, что срок от появления первых симптомов кровотечения и тем более от его действительного начала, составляющий, как правило, не менее суток, делает показатели гемоглобина и гематокрита вполне реальными в силу успевшей развивиться за данный период гемодилюции. В случае несоответствия клинических критериев показателям гемоглобина и гематокрита оценку тяжести кровопотери следует проводить, учитывая показатели, в наибольшей степени отличающиеся от нормальных значений.
Предложенная классификация тяжести кровопотери представляется нам приемлемой и удобной именно для клиники ургентной хирургии, как минимум, по двум причинам. Во-первых, оценка кровопотери не требует проведения сложных специальных исследований. Во-вторых, возможность определения степени кровопотери сразу же в приемном отделении позволяет решить вопрос о необходимости начала инфузионной терапии и госпитализации пациента в отделение интенсивной терапии.
По нашим наблюдениям из 1204 пациентов с ОГДЯК у большей части (35, 1%) пациентов при госпитализации была диагностирована кровопотеря II степени. С кровопотерей III и I степеней были госпитализированы соответственно 31, 2% и 24, 8% пациентов. Доля пациентов с кровопотерей IV степени составила 8, 9%. Доля пациентов с кровопотерей I степени с увеличением возраста пациентов имела тенденцию к снижению с 33, 5% у больных моложе 45 лет до 2, 3% у больных старческого возраста, что может быть объяснено уменьшающейся с возрастом резистентностью организма к кровопотере и возникновением выраженной клинической манифестации при сравнительно меньших темпах геморрагии. Напротив, массивная кровопотеря для больных пожилого и старческого возраста приобретает характер фатальной уже на догоспитальном этапе, о чем свидетельствует снижение доли больных с кровопотерей III и IV степеней в возрастных группах 60 – 74 лет и старше 75 лет.
Среди больных с кровопотерей I и II ст. наибольший удельный вес имели пациенты моложе 45 лет. Доля больных в возрасте 45 – 59 лет, составлявшая при кровопотере I ст. 31, 4%, достигает 40, 3% при кровопотере III ст. Данный возрастной контингент составлял практически половину больных с кровопотерей IV ст. Доля больных 60 – 74 лет достигает максимума при кровопотере II степени и уменьшается при усугублении тяжести кровопотери. Аналогичная картина распределения отмечается и у больных старческого возраста: 15, 9% среди больных со II ст. кровопотери и совсем незначительная среди больных с III (7, 5%) и IV (5, 5%) ст.
Оценка нарушений системы гемостаза у больных с ОГДЯК. Помимо определения тяжести кровопотери принципиально важной задачей диагностики у пациентов с гастродуоденальными язвенными кровотечениями является количественная и качественная оценка нарушений системы гемостаза, поскольку расстройства гемокоагуляции являются важнейшим патогенетическим звеном синдрома острой массивной кровопотери, а их адекватная и своевременная коррекция – обязательным компонентом заместительной терапии. А. И. Воробьев и соавт. (2001) подчеркивают, что очень часто острая массивная кровопотеря происходит у больных с исходно существующими нарушениями в системе свертывания крови. Наиболее часто эти нарушения проявляются формированием гиперкоагуляционного синдрома, нередко определяющего тяжесть течения синдрома острой массивной кровопотери, трансфузиологическую тактику ее восполнения и предупреждения развития острого ДВС-синдрома.
Гиперкоагуляционный синдром характеризуется определенными клиническими проявлениями и лабораторными признаками повышенной готовности крови к свертыванию при отсутствии тромбозов. Общее состояние при гиперкоагуляционном синдроме чаще удовлетворительное, больные могут отмечать чувство «тяжести в голове» и головную боль, быструю утомляемость, слабость. Кровь при заборе из вены сворачивается прямо в игле, места венепункции легко тромбируются. Несмотря на то, что кровяной сгусток в пробирке формируется быстро, он рыхлый и нестойкий; отмечаются укорочение времени свертывания крови по Ли-Уайту и АЧТВ, повышены агрегационные показатели тромбоцитов, удлинен фибринолиз.
Принято считать, что массивная кровопотеря, сопровождающаяся выраженными нарушениями гемодинамики с расстройствами периферического кровотока, практически всегда сопровождается появлением гиперкоагуляционной фазы ДВС-синдрома. Гиперкоагуляционная фаза ДВС-синдрома часто бывает весьма скоротечной и не диагностируется. Тем не менее, при данной фазе ДВС-синдрома признаки гиперкоагуляции выражены весьма отчетливо: укорочены АЧТВ, протромбиновое время, снижены уровень фибриногена и число тромбоцитов. Скорость образования кровяного сгустка в пробирке по-прежнему ускорено, но он остается рыхлым и нестойким.
Для гипокоагуляционной фазы ДВС-синдрома характерны с одной стороны лабораторные маркеры коагулопатии потребления а с другой – наличием признаков гипокоагуляции и диффузного геморрагического диатеза (кровоточивость гематомно-петехиального типа). Приводим основные лабораторные и клинические признаки гиперкоагуляционного синдрома и фаз ДВС-синдрома (табл. 3).
Форма нарушения гемокоагуляции
Лабораторные и клинические признаки
Гиперкоагуляционный синдром
Лабораторные признаки: укорочение АЧТВ, протромбинового времени; повышение активности тромбоцитов; снижение активности фибринолиза.
Клинические проявления: тромбирование иглы при венепункции, быстрое формирование рыхлого и нестойкого кровяного сгустка в пробирке.
Гиперкоагуляционная фаза ДВС-синдрома
Лабораторные признаки: укорочение АЧТВ, протромбинового времени; повышение активности тромбоцитов при сниженном их количестве; снижение уровня фибриногена, АТ III, протеина С, активности фибринолиза.
Клинические проявления: быстрое тромбирование иглы при венепункции, появлене признаков полиорганной недостаточности.
Гипокоагуляционная фаза ДВС-синдрома
Лабораторные признаки: удлинение АЧТВ, протромбинового времени, снижение количества и активности тромбоцитов; снижение уровня фибриногена, факторов свертывания, АТ III, протеина С; ускорение фибринолиза; резкое повышение уровня продуктов деградации фибрина, D-димеров.
Клинические проявления: трудноконтролируемая диффузная кровоточивость, развернутая картина полиорганной недостаточности.
Статья добавлена 2 апреля 2016 г.
Если потерял много крови чем восстановить
АД — артериальное давление
АЧТВ — активированное частичное тромбопластиновое время
ИВЛ — искусственная вентиляция легких
КПК — концентрат протромбинового комплекса
КТ — компьютерная томография
ОРИТ — отделение реанимации и интенсивной терапии
ОМК — острая массивная кровопотеря
ОЦК — объем циркулирующей крови
ПОН — полиорганная недостаточность
ПТВ — протромбиновое время
СЗП — свежезамороженная плазма
УЗИ — ультразвуковое исследование
ЧМТ — черепно-мозговая травма
СаО2 — содержание кислорода в артериальной крови
СvО2 — содержание кислорода в венозной крови
DO2 — доставка кислорода
VO2 — потребление кислорода
Массивная кровопотеря определяется как потеря одного и более объема циркулирующей крови (ОЦК) в течение 24 часов, либо потеря 50% ОЦК в течение 3 часов, либо кровотечение со скоростью более 150 мл/мин.
Клинически такая кровопотеря проявляется снижением уровня систолического артериального давления (АД) менее 90 мм рт.ст. и повышение частоты сердечных сокращений более 110 ударов в минуту [1].
Острая массивная кровопотеря (ОМК) на фоне проведения интенсивной терапии с позиции патофизиологии может быть рассмотрена как совокупность шока, острой коагулопатии и синдрома массивных трансфузий, что в окончательном варианте приводит к формированию полиорганной недостаточности (ПОН) у пациента, находящегося в критическом состоянии [2—6].
Массивная кровопотеря продолжает оставаться одной из наиболее актуальных проблем для всей сферы медицины критических состояний: для работы бригад скорой медицинской помощи, для врачей ургентной хирургии различного профиля, для специалистов службы крови и для врачей отделений анестезиологии, реанимации и интенсивной терапии [7—9]. Данная когорта пациентов представляет сложность в отношении риска развития коагулопатии на фоне продолжающегося кровотечения, что в конечном итоге приводит на фоне лечения к формированию синдрома массивных трансфузий и независимому от других факторов риску ПОН [10, 11]. Причины ОМК, приводящей к шоку, широко варьируют: акушерско-гинекологическая патология, кровотечения из желудочно-кишечного тракта, периоперационные кровотечения, разрывы аневризмы, эрозивные кровотечения, сосудистая патология и т. д. [11, 12].
В основе неблагоприятных последствий ОМК лежит ряд патофизиологических механизмов, основным из которых является геморрагический шок, связанный с недостаточной доставкой кислорода. Доказано, что независимыми предикторами летального исхода являются острая гиповолемия, гипофибриногенемия, ацидоз и гипотермия [11, 12].
Во многих современных зарубежных рекомендациях по проблеме массивной кровопотери обращается принципиальное внимание на то, что данная проблема является мультидисциплинарной. Для высокопрофессиональной работы по оказанию помощи пациентам с ОМК необходимо тесное сотрудничество анестезиолого-реанимационной команды со специалистами хирургического профиля, трансфузиологами, гемостазиологами и гематологами. В каждом лечебном учреждении, в котором оказывается медицинская помощь пациентам с ОМК, должны быть разработаны и внедрены в клиническую практику протоколы ОМК на основе стандартов с доказательной базой и с обязательным внедрением контроля качества выполнения данных протоколов. Своевременно начатый адекватный комплекс противошоковых мероприятий при ОМК имеет огромное влияние на выживаемость пациентов. Поэтому протокол ОМК своевременного и адекватного мультидисциплинарного подхода является ключом к улучшению результатов лечения пациентов с ОМК. В ряде крупных зарубежных исследований и в рекомендациях по ведению пациентов с кровопотерей отмечается, что несоблюдение данного протокола приводит к снижению выживаемости таких пациентов [1, 12—13].
Этиология, эпидемиология и патофизиология острой кровопотери
ОЦК у взрослого человека рассчитывается как 7% от массы тела. Расчетный ОЦК составляет, таким образом, около 5 л у человека массой 70 кг. ОЦК варьирует в зависимости от возраста, пола, телосложения, физиологического состояния. Кроме того, на исходный ОЦК оказывает влияние ряд таких факторов, как потери из организма во внешнюю среду (диурез, гипертермия) или перемещение воды между водными пространствами организма (отеки).
Ведущими последствиями острой кровопотери являются нарушение периферической перфузии, критическое снижение системной доставки кислорода, снижение доставки нутриентов и, как результат, формирование шока. Доставка кислорода (DO2, млО2/мин/м 2 ) является производным сердечного индекса (СИ, л/мин/м 2 ) и содержания кислорода в артериальной крови (СаО2, млО2/л крови, показатель рассчитывается как 1,34 × концентрация гемоглобина, г/л×SаО2+0,03×РаО2, в котором SaO2 — насыщение гемоглобина кислородом, выраженное в долях единицы, РаО2 — парциальное давление кислорода в артериальной крови). В условиях нормального аэробного обмена потребление кислорода (VO2) будет меняться в соответствии с метаболическими потребностями. Показатель потребления кислорода рассчитывается как СИ×(СаО2–СvО2), в котором СаО2 и СvО2— содержание кислорода в артериальной крови и смешанной венозной крови соответственно, СИ — сердечный индекс.
Производным из данных уравнений показателем, который показывает фракцию кислорода, доставленную к тканям, является коэффициент экстракции кислорода, определяемый как ErO2=(CaO2–CvO2)/CaO2.
В условиях кровопотери и геморрагического шока быстрое снижение ОЦК ведет к уменьшению сердечного выброса и пропорциональному снижению DO2 с сохранением практически нормальных показателей потребления кислорода из-за перераспределения крови в область с повышенной потребностью в кислороде. В условиях кровопотери наблюдается увеличение экстракции кислорода из крови в периферических тканях, что усиливает эффективность утилизации кислорода при начинающейся циркуляторной и гемической гипоксии. Наблюдается гипоксическое перераспределение крови, вследствие специфической для отдельных органов реакции микроциркуляции в «периферических» органах (за исключением сердца, головного мозга и надпочечников) органный кровоток снижается [11, 14]. Одновременно с этим отмечается увеличение числа «эффективных капилляров». Возобновление кровотока через подобные капилляры усиливает возможность микроциркуляторного кровотока в «шоковых» органах. Интенсивность данного процесса пропорциональна уровню гипоксии [15].
В условиях декомпенсации острой кровопотери и снижения уровня DO2 ниже критического происходит переключение метаболизма клеток и тканей на анаэробный тип. Функционирование клеток зависит от того, насколько аэробный и анаэробный тип метаболизма смогут поддерживать достаточный уровень аденозинтрифосфата для мембранного потенциала и синтеза белков. Считается, что некоторые ткани более резистентны к гипоксии (например, клетки скелетной и гладкой мускулатуры, гепатоциты, способные без значительного повреждения переживать 2,5-часовую гипоксию), в отличие от клеток головного мозга, фатальные расстройства в которых наблюдаются спустя несколько минут аноксии. Гипоксия приводит к нарушению функционирования мембранных ионных насосов, что в дальнейшем вызывает нарушение целостности мембраны и разрыв клетки. Следствиями гипоксии являются отсутствие энергии, внутриклеточный ацидоз, высвобождение свободных радикалов кислорода и потеря адениновых нуклеотидов из клетки [18, 19].
Механизмы компенсации острой кровопотери можно подразделить на гемодинамические и волемические. К первым относят сокращение венозной емкости, тахикардию и централизацию кровообращения, ко вторым — резорбцию жидкости из интерстиция в капилляры и активацию ренин-ангиотензин-альдостероновой системы.
Острая коагулопатия. Имеются сведения, что кровопотеря, особенно кровопотеря при тяжелой травме, обладает времязависимым влиянием на тяжесть нарушения свертывания крови [11, 20—23].
Первично комбинация травматического повреждения и нарушения перфузии тканей вызывает коагулопатию, связанную со снижением уровня протеина С. Активированный протеин С реализует свой антикоагулянтный эффект за счет необратимой инактивации факторов Vа и VIIIа [24]. Дальнейшая антикоагуляционная активность реализуется за счет деактивации ингибитора активатора плазминогена, что приводит к усилению фибринолиза [25]. В дополнение протеин С активирует рецептор клеточной поверхности, активируемый протеиназами-1 (PAR-1), тем самым реализуя ряд защитных клеточных эффектов за счет усиления противовоспалительной активности, антиапоптотической активности, защитной функции в отношении эндотелия, что повышает вероятность выживания организма при шоке [26]. Суммарно коагулопатия характеризуется системной коагулопатией/гипокоагуляцией в сочетании с гиперфибринолизом.
Повреждение гликокаликса. Эндотелий играет ключевую роль в патофизиологии острой массивной кровопотери, шока и коагулопатии [11, 21]. Повышенная сосудистая проницаемость при шоке характеризуется деградацией апикального слоя гликокаликса эндотелиоцитов, включая синдекан-1, который может быть использован как один из маркеров данного процесса деградации [27—29]. Симпатоадреналовая активация в ходе шока является одним из факторов, вызывающих патологию эндотелия и деградацию гликокаликса. Индуцированная травмой коагулопатия при ОМК ассоциируется с разрушением гликокаликса, что подтверждается корреляцией маркеров эндотелиопатии; по данным вязкоэластических методов отмечаются характерные расстройства [11, 21, 30, 31].
Ацидоз. Анаэробный метаболизм в условиях шока и избыточное вынужденное переливание больших объемов несбалансированных кристаллоидных растворов ведут к метаболическому ацидозу [11, 32]. Причины нарушений свертывания на фоне острых расстройств рН обусловлены угнетением ферментной активности на фоне снижения рН ниже физиологических величин, угнетением функции тромбоцитов с формированием их сферической конфигурации без внешних псевдоподий, ингибирование генерации тромбина, усилению деградации фибриногена [11, 33, 34]. Вероятным вариантом стратегии инфузионной терапии с позиции измененного рН при шоке и кровопотере является прежде всего предпочтение компонентам крови, отказ от несбалансированных кристаллоидов или резкое ограничение их введения и/или переход к сбалансированным инфузионным кристаллоидным средам. Гипокальциемия является фактором, усугубляющим формирование коагулопатии на фоне метаболического ацидоза. Содержание свободного ионизированного кальция, необходимого для сборки факторов свертывания на поверхности тромбоцитов и эндотелия, коррелирует с уровнем рН [35]. Кальций необходим не только для полимеризации фибрина и функции тромбоцитов, но и для фибринолиза и активации системы протеина С [36]. Содержащие цитрат компоненты в донорской крови и коллоидные растворы усугубляют дефицит кальция в крови, равно как и накапливающийся при шоке лактат [11, 37].
Гипотермия — еще один важный фактор формирования коагулопатии. Снижение температуры ведет к нарушению функции ферментов, в том числе ферментов свертывания [7, 11, 13, 36]. Нарушается клеточный компонент гемостаза из-за снижения интенсивности агрегации и адгезии. Следует отметить и тот факт, что in vivo измерения гемостазиологических тестов могут отличаться от реальных условий организма, когда при ОМК свертывание происходит в условиях гипотермии [37]. Известно, что морфология тромбоцитов нарушается в условиях гипотермии, на каждый 1 °C гипотермии функция свертывания снижается на 10% от нормального потенциала [11].
Классификация острой кровопотери
Существует клиническая классификация острой кровопотери (табл. 1); 
Диагностика и лечение острой массивной кровопотери
Первичное восстановление, диагностика и мониторинг кровотечения
Рекомендация 1. Необходима минимизация времени между травмой и операцией по остановке кровотечения у пациентов, нуждающихся в срочной хирургической остановке кровотечения (уровень убедительности рекомендаций I, уровень достоверности доказательств — А).
Рекомендация 2. Пациентов с тяжелой травмой необходимо транспортировать в учреждение, «подходящее» для лечения политравмы (уровень убедительности рекомендаций I, уровень достоверности доказательств — В).
Комментарии. Данная рекомендация является основополагающей с точки зрения протокола ATLS (Advanced Trauma Life Support) и ряда официальных документов Министерства здравоохранения Российской Федерации. Приоритетным считают раннее оказание помощи пострадавшим с тяжелой травмой в специализированных многопрофильных лечебных учреждениях — центрах политравмы.
Несмотря на отсутствие рандомизированных клинических исследований, хорошо организованные ретроспективные исследования приводят доказательства необходимости раннего хирургического вмешательства у пациентов с травматическим или геморрагическим шоком [38, 39].
Рекомендация 3. До момента возможности выполнения окончательного оперативного гемостаза необходимо использовать жгут для остановки жизнеугрожающих кровотечений из открытых повреждений конечностей (уровень убедительности рекомендаций I, уровень достоверности доказательств — В).
Комментарии. Кровоостанавливающие жгуты следует оставлять наложенными до выполнения хирургической остановки кровотечения, однако этот отрезок времени должен быть как можно короче. Неправильное или длительное наложение кровоостанавливающего жгута может привести к таким осложнениям, как паралич нерва и ишемия конечности, однако подобные осложнения возникают редко. В большинстве публикаций указано, что 2 ч — максимальное безопасное время наложения жгута. В военно-полевых условиях описаны случаи, в которых кровоостанавливающий жгут оставался наложенным в течение 6 часов с последующим полноценным восстановлением конечности.
Рекомендация 4. Рекомендуется избегать гипоксемии (уровень убедительности рекомендаций I, уровень достоверности доказательств — А).
Рекомендация 5. Рекомендуется нормовентиляция у пациентов с травмой и ОМК (уровень убедительности рекомендаций I, уровень достоверности доказательств — В).
Рекомендация 6. Предлагается гипервентиляция при наличии признаков нарастающей церебральной грыжи (смещение структур головного мозга) (уровень убедительности рекомендаций II, уровень достоверности доказательств — С).
Комментарии. Основными целями интубации трахеи и перевода пациента на искусственную вентиляцию легких (ИВЛ) являются обеспечение адекватной вентиляции и оксигенации, а также проходимости дыхательных путей. Ситуации, при которых интубация является обязательной: обструкция дыхательных путей, измененное сознание (оценка по шкале ком Глазго ≤8 баллов), геморрагический шок, гиповентиляция или гипоксия [40]. Следует рассмотреть возможность использования анестезии с быстрой последовательной индукцией [41].
Отрицательные эффекты гипоксии хорошо известны, особенно у пациентов с травматическим повреждением головного мозга [42, 43]. Некоторые исследователи, однако, предположили, что достижение существенной гипероксии (PaO2 выше 200—300 мм рт.ст.) связано с повышенной смертностью [44].
Адекватная вентиляция может повлиять на исход у пациентов с тяжелой травмой. Существует тенденция к применению гипервентиляции у пациентов во время начальной помощи [45, 46], но у пациентов с травмой, особенно при наличии черепно-мозговой травмы (ЧМТ), гипервентиляция, по-видимому, повышает риск смерти по сравнению с пациентами, которые не подвергаются гипервентиляции [44]. Вазоконстрикция с уменьшением мозгового кровотока и нарушением перфузии тканей — потенциальный механизм отрицательного эффекта гипервентиляции и гипокапнии. Рекомендуемый показатель артериального PaCO2 должен составлять 35—40 мм рт.ст. Рекомендуют раннее применение малого объема вдоха (6—7 мл на 1 кг массы тела) с умеренным положительным давлением конца выдоха (до 5 мбар), особенно у пациентов с травматическим кровотечением, из-за опасности развития респираторного дистресс-синдрома.
Единственная ситуация, в которой индуцированная гипервентиляцией гипокапния может играть положительную роль, — это нарастание церебральной грыжи. Снижение мозгового кровотока острой гипокапнией во время гипервентиляции вызывает снижение внутричерепного давления, которое может быть использовано в течение короткого периода времени до тех пор, пока другие терапевтические меры не станут эффективными [47, 48]. На практике подобное состояние сложно определить (вероятно нарастание брадикардии в отсутствие иных причин) и сложно контролировать (вероятно, использование капнографического мониторинга).
Рекомендация 7. Врач должен оценить степень кровопотери, учитывая физиологию пациента, анатомическую структуру повреждения, механизм травмы и ответ на начальную терапию (уровень убедительности рекомендаций I, уровень достоверности доказательств — С).
Комментарии. При принятии решения о начале немедленного хирургического гемостаза, согласно протоколу ATLS, следует учитывать механизм травмы в сочетании с тяжестью травмы. Индекс Альговера (отношение значения пульса к значению систолического АД) малочувствителен для исключения массивной кровопотери при тяжелой травме. В балльной шкале TASH (Trauma Associated Severe Hemorrhage) для оценки массивного кровотечения, связанного с травмой, использованы 7 параметров (уровень систолического АД, уровень гемоглобина, наличие внутрибрюшной жидкости, сложный перелом трубчатых костей и/или таза, частота сердечных сокращений, избыток оснований (ВЕ) и пол пациента), что позволяет прогнозировать вероятность массивного переливания крови.
Рекомендация 8. У пациентов с геморрагическим шоком и известным источником кровотечения необходимо немедленно остановить кровотечение хирургическим путем, если первоначальные меры реанимации и консервативные методы остановки кровотечения безуспешны (уровень убедительности рекомендаций I, уровень достоверности доказательств — В).
Рекомендация 9. Пациентов с геморрагическим шоком и неизвестным источником кровотечения необходимо немедленно дообследовать (уровень убедительности рекомендаций I, уровень достоверности доказательств — В).
Комментарии. У пациента с геморрагическим шоком и с невыявленным явным источником кровотечения необходимо немедленно (непосредственно в реанимационном зале) обследовать состояние грудной клетки, брюшной полости и тазового кольца, которые представляют собой основные источники острой кровопотери при травме. Кроме клинического обследования, при первичной оценке рекомендуется выполнять рентгенографию грудной клетки и таза в сочетании с ультразвуковым исследованием (УЗИ) брюшной полости, иногда лапароцентез. Спиральная компьютерная томография (КТ) может заменить традиционное рентгенографическое исследование.
Рекомендация 10. Рекомендуется раннее выполнение методов визуализации (УЗИ и/или КТ) для выявления свободной жидкости при подозрении на травму туловища (уровень убедительности рекомендаций I, уровень достоверности доказательств — В).
Рекомендация 11. Пациентам с массивным внутригрудным, внутрибрюшным или забрюшинным кровотечениями и шоком рекомендуется срочное хирургическое вмешательство (уровень убедительности рекомендаций I, уровень достоверности доказательств — А).
Рекомендация 12. У гемодинамически стабильных пациентов рекомендуется дальнейшее обследование с помощью компьютерной томографии (уровень убедительности рекомендаций I, уровень достоверности доказательств — В).
Комментарии. Ряд проспективных наблюдательных исследований определили высокую специфичность, точность и чувствительность первично проведенного УЗИ для обнаружения травмы живота у взрослых и детей. Положительный результат УЗИ предполагает наличие крови в брюшной полости, а отрицательный требует дальнейших диагностических исследований [49, 50]. Хотя считается, что КТ и лапароцентез более чувствительные методы, чем УЗИ для выявления крови в брюшной полости, эти диагностические методы отнимают больше времени и более инвазивны (лапароцентез).
В последние годы визуальная диагностика пациентов с травмами сместилась в сторону К.Т. Более быстрая постановка диагноза с использованием КТ обеспечивает меньшее время пребывания пациента в отделении неотложной помощи, операционной и отделении реанимации и интенсивной терапии (ОРИТ). Диагноз, установленный по результатам КТ, значительно увеличивает вероятность выживания у пациентов с политравмой. КТ всего тела в качестве стандартного диагностического метода в самой ранней фазе реанимации у пациентов с политравмой обеспечивает дополнительную возможность диагностики травм головы, грудной клетки и возможных источников кровотечения. Некоторые авторы продемонстрировали пользу КТ с введением контрастного вещества [51].
Если КТ недоступна в приемном отделении или отделении неотложной помощи, проведение КТ-сканирования подразумевает транспортировку пациента в помещение, где проводится КТ, поэтому клиницист должен оценить значимость, потенциальный риск развития осложнений и предполагаемую пользу процедуры. Во время транспортировки необходимо контролировать все жизненно важные показатели и продолжать осуществлять инфузионную терапию и противошоковые мероприятия. У пациентов, гемодинамическая стабильность которых сомнительна, могут быть эффективными такие методы визуального обследования, как УЗИ и рентгенологическое исследование грудной клетки и таза. Следует тщательно контролировать время транспортировки до любого диагностического оборудования и от него у всех пациентов, которые являются гемодинамически нестабильными. В дополнение к начальной клинической оценке должно быть доступно лабораторное обследование пациента, включая общий анализ крови, уровни газов крови и лактата.
Пациенты с артериальной гипотензией (уровень систолического АД ниже 90 мм рт. ст.) и свободной жидкостью в брюшной полости по результатам УЗИ или КТ являются кандидатами для неотложной хирургической операции, если стабилизация состояния не достигается при первичной реанимации и инфузионной терапии [52].
Рекомендация 13. Изначально при поступлении пациента с ОМК необходимо определить группу крови, резус-фактор, уровень гемоглобина и гематокрита (уровень убедительности рекомендаций I, уровень достоверности доказательств — А).
Рекомендация 14. Рекомендуется повторно измерять уровень гемоглобина в качестве лабораторного маркера кровотечения. Исходные нормальные значения гемоглобина могут маскировать кровотечение (уровень убедительности рекомендаций I, уровень достоверности доказательств — В).
Рекомендация 15. Определение уровней лактата и дефицита оснований рекомендуется в качестве чувствительных тестов для оценки и мониторинга степени кровопотери и шока (уровень убедительности рекомендаций I, уровень достоверности доказательств — В).
Комментарии. Количество лактата, произведенного в ходе анаэробного гликолиза клетками, является косвенным маркером недостатка кислорода, гипоперфузии тканей и тяжести шока. Точно так же показатели дефицита оснований, полученные на основании анализа газов артериальной крови, дают косвенную оценку глобального ацидоза тканей из-за ухудшения перфузии. Доказана польза повторных измерений уровня лактата для прогнозирования выживания пациентов при шоке. Пациенты, у которых уровень лактата возвращается к нормальному диапазону (≤2 ммоль/л) в пределах 24 часов, имеют высокую вероятность выживания. Выживаемость снижается до 77%, если нормализация происходит в пределах 48 часов, и до 13% — у пациентов, у которых уровень лактата сохраняется выше 2 ммоль/л более 48 часов. Продолжительность периода нормализации уровня лактата связана с развитием посттравматической ПОН [53—55]. Польза определения уровня лактата у пациентов с травмой хорошо известна, однако специфичность метода снижается на фоне употребления алкоголя, поскольку алкоголь сам по себе может увеличивать уровень лактата в крови. При травме, связанной с употреблением алкоголя, дефицит оснований может быть лучшим прогностическим показателем, чем уровень лактата. Дефицит оснований артериальной или периферической венозной крови считается мощным независимым прогностическим маркером летальности у пациентов с травматическим геморрагическим шоком. Выделяют 3 степени дефицита оснований: слабая (от –3 до –5 мЭкв/л), умеренная (от –6 до –9 мЭкв/л) и тяжелая ( 500 мл на КТ и продолжающаяся гемодинамическая нестабильность, несмотря на адекватную стабилизацию перелома [79].
Некоторые учреждения используют преимущественно внешние фиксаторы для остановки кровотечения вследствие тазовых переломов, но можно достигать укрепления тазового кольца, используя простыню, тазовый фиксатор или тазовый C-зажим. В дополнение к стабилизации тазового кольца, стабилизации перелома и «тампонадному эффекту» гематомы тампонада предбрюшинного, внебрюшинного и заднебрюшинного пространств уменьшает или останавливает венозное кровотечение. Наружная тампонада брюшной полости уменьшает потребность в эмболизации сосудов таза и может выполняться одновременно или сразу после первичной стабилизации тазового перелома. Тампонирование таза может помочь в быстрейшей остановке кровотечения и обеспечить необходимое время для вероятного использования методов селективного эндоваскулярного гемостаза. Этими методами можно снизить высокую смертность, наблюдаемую у пациентов с тяжелыми травмами таза, которые подвергаются лапаротомии в качестве первичного вмешательства.
Ангиографию и эмболизацию в настоящее время считают очень эффективными методами остановки артериального кровотечения, которое не устраняется посредством стабилизации перелома [80]. Многие авторы подчеркивают, что допустимая гипотензия при стабилизации и/или ангиографии таза помогает достичь лучшей выживаемости. Существуют противоречивые мнения о показаниях и оптимальном выборе времени для выполнения ангиографии у гемодинамически нестабильных пациентов. Различия каждого учреждения в возможностях для своевременного выполнения ангиографии и эмболизации могут объяснять алгоритмы лечения, предложенные разными авторами [81]. Однако общее мнение состоит в том, что необходим многопрофильный подход к подобным тяжелым травмам.
Имеется широкий диапазон местных кровоостанавливающих средств, применяемых в качестве дополнения к традиционным хирургическим методам с целью остановки кровотечения [82, 83]. Эти местные средства могут быть особенно полезными в случае сложного доступа к участку кровотечения. Местные кровоостанавливающие средства включают коллаген, желатин или продукты на основе целлюлозы, фибрин и синтетические клеи или пластыри, которые могут быть использованы как при наружном, так и при внутреннем кровотечении, в то время как гемостатические средства на основе полисахаридов и неорганические гемостатики все еще часто используются при наружном кровотечении.
Коррекция коагулопатии
Рекомендация 34. Рекомендуется как можно раньше начинать мероприятия по поддержанию нормального соотношения факторов про- и антикоагуляции (уровень убедительности рекомендаций I, уровень достоверности доказательств — В).
Рекомендация 35. Рекомендуется при интенсивной терапии использовать целенаправленную стратегию, основанную на мониторинге стандартных лабораторных тестов коагуляции и/или ТЭГ (уровень убедительности рекомендаций I, уровень достоверности доказательств — С).
Комментарии. Примерно у 30% всех пациентов с травматическими кровотечениями при госпитализации диагностируют коагулопатию. Эта группа пациентов демонстрирует значительное увеличение частоты развития ПОН и смерти по сравнению с пациентами с похожими травмами в отсутствие коагулопатии. Ранняя острая коагулопатия, связанная с травматическим поражением, признана многофакторным первичным состоянием, которое является результатом сочетания шока, вызванного кровотечением, образования комплекса тромбин-тромбомодулин в травмированной ткани и активации фибринолитических и антикоагулянтных механизмов (рис. 1). 
Оценка состояния гемостаза является обязательной для обнаружения коагулопатии, вызванной травмой, и определения основных причин, включая гиперфибринолиз. Ранняя коррекция улучшает параметры коагуляции, уменьшает потребность в переливании эритроцитов, СЗП и тромбоцитов, уменьшает уровень посттравматической ПОН, сокращая длительность пребывания в стационаре, и может улучшать выживаемость.
В нескольких проспективных рандомизированных исследованиях доказано, что применение алгоритма целенаправленного управления системой гемостаза уменьшает частоту гемотрансфузий и улучшает результаты лечения, снижая летальность при кровопотере [84—90].
Рекомендация 36. На начальном этапе лечения больных с массивной кровопотерей рекомендуется рассмотреть трансфузию СЗП в соотношении с эритроцитами 1:2 (уровень убедительности рекомендаций I, уровень достоверности доказательств — В).
Рекомендация 37. Рекомендуется введение СЗП для поддержания уровня ПТВ и АЧТВ не выше полуторного увеличения от нормального диапазона на фоне кровотечения (уровень убедительности рекомендаций I, уровень достоверности доказательств — С).
Рекомендация 38. Рекомендуется избегать переливания плазмы у больных без значительного кровотечения (уровень убедительности рекомендаций I, уровень достоверности доказательств — В).
Комментарии. Реанимация в рамках концепции damage control нацелена на быстрое подавление острой травматической коагулопатии посредством раннего восполнения факторов свертывания крови. Подходящим для этого средством является свежезамороженная плазма, которая содержит приблизительно 70% нормального уровня всех факторов свертывания крови.
Предлагается начинать трансфузию препаратов крови у пациентов с массивной кровопотерей немедленно, не дожидаясь результатов коагуляционных тестов (АЧТВ, ПТВ, уровень фибриногена и/или ТЭГ). Международная экспертная конференция по массивному переливанию в Американском военном институте рекомендовала немедленное введение компонентов коагуляции в соотношении 1:1:1 (эритроциты, плазма и тромбоциты) [91—93]. В следующие несколько лет ретроспективные данные как военных, так и гражданских практик показали улучшение результатов лечения пациентов с массивным кровотечением после принятия и применения данного протокола, использующего раннее введение большой дозы плазмы [94—96]. Необходимо помнить, что осложнения, связанные с применением СЗП, как и других продуктов, полученных из человеческой крови, включают перегрузку объемом, иммунную несовместимость, передачу инфекционных заболеваний и аллергические реакции. Острое повреждение легких (TRALI) является серьезным побочным эффектом трансфузии СЗП [97, 98].
Рекомендация 39. Целесообразно как можно раньше применять транексамовую кислоту у пациентов с травматическим кровотечением или при риске тяжелого кровотечения в нагрузочной дозе 1 г, которую вводят в течение 10 минут, с последующим внутривенным введением 1 г в течение 8 часов (уровень убедительности рекомендаций I, уровень достоверности доказательств — А).
Рекомендация 40. Применять транексамовую кислоту у пациентов с травматическим кровотечением в течение первых трех часов с момента получения травмы (уровень убедительности рекомендаций I, уровень достоверности доказательств — В).
Рекомендация 41. Протоколы по тактике ведения пациентов с кровотечением должны учитывать введение первой дозы транексамовой кислоты на догоспитальном этапе (уровень убедительности рекомендаций II, уровень достоверности доказательств — С).
Примечания. Транексамовая кислота — синтетический аналог лизина, который является конкурирующим ингибитором профибринолизина; ε-аминокапроновая кислота также является синтетическим аналогом лизина, активность которого в 10 раз слабее, чем транексамовой кислоты. Апротинин противопоказан пациентам с кровотечением вследствие травмы.
Рандомизированное клиническое исследование эффективности антифибринолитической терапии при ОМК (CRASH-2) оценивало влияние транексамовой кислоты на летальность, тромбоз сосудов и частоту переливания компонентов донорской крови у пациентов с кровотечением или риском кровотечения при травме [99]. В исследование включено 20 211 взрослых пациентов, рандомизированных на группы в зависимости от введения транексамовой кислоты (нагрузочная доза транексамовой кислоты 1 г в течение 10 мин с последующей инфузией внутривенно 1 г в течение 8 ч) или приема плацебо. Отмечено снижение показателя госпитальной летальности на 28-й день госпитализации: 1463 (14,5%) летальных исхода среди пациентов, у которых применялась транексамовая кислота, по сравнению с 1613 (16,0%) среди пациентов группы плацебо; относительный риск (ОР) 0,91; 95% доверительный интервал (ДИ) 0,85—0,97; p=0,0035 [100, 101]. Раннее назначение транексамовой кислоты (в пределах одного часа с момента травмы) значительно уменьшало риск смерти из-за кровотечения. При назначении препарата в интервале от 1 до 3 часов с момента получения травмы риск смерти из-за кровотечения уменьшался на 1,3% [102]. I. Roberts и соавт. также показали, что назначение транексамовой кислоты спустя более 3 часов с момента начала кровотечения повышает риск смерти на 1,3%. Авторы данной работы считают, что раннее введение транексамовой кислоты у пациентов с ОМК должно начинаться еще на догоспитальном этапе. Они рекомендуют включать в протокол ведения больных с кровотечением при травме введение транексамовой кислоты на месте получения травмы [103]. Для достижения максимального эффекта от применения транексамой кислоты ее следует назначать всем пациентам с травмой и массивными кровопотерями. Таким образом, внутривенное введение транексамовой кислоты должно быть частью госпитального протокола по ведению больных с травмой, а не только протокола собственно «тяжелой кровопотери» [103—106].
В 2018 г. А. Gayet-Ageron и соавт. в своей работе отметили, что назначение транексамовой кислоты эффективно снижает кровопотерю, объем гемотрансфузии и предотвращает летальные исходы у пациентов после кардиохирургических операций, при тяжелой травме и у пациенток с послеродовыми кровотечениями. В ряде исследований, в частности у пациентов с травмой, показано, что раннее введение транексамовой кислоты (в первые 3—6 часов после начала кровотечения) наиболее эффективно. В метаанализе рандомизированных контролируемых исследований с включением суммарно более 40 000 пациентов с ОМК в послеродовом периоде и пациентов с тяжелыми травмами отмечено, что раннее внутривенное введение транексамовой кислоты у пациентов с ОМК связано с большей выживаемостью в группе вмешательства. В группе пациентов зафиксировано 3558 смертей, из которых 40% вызваны кровотечением, транексамовая кислота значительно увеличивала общую выживаемость (отношение шансов (ОШ) 1,2, 95% ДИ 1,1—1,3). Немедленное внутривенное введение транексамовой кислоты (в первый час после начала кровотечения) связано с увеличением выживаемости более чем на 70% (ОШ 1,7, 95% доверительный интервал 1,4—2,1). Авторы данного исследования подсчитали, что эффективность профилактики смерти с использованием внутривенного введения транексамовой кислоты снижалась на 10% на каждые 15 мин задержки лечения в течение 3 часов. У пациентов, получавших антифибринолитическое лечение, не наблюдалось увеличения частоты тромбоэмболических осложнений [107].
Рекомендация 42. Рекомендуется применение криопреципитата для лечения пациентов, у которых кровотечение сопровождается тромбоэластометрическими признаками функционального дефицита фибриногена или плазменным уровнем фибриногена менее 1,5—2,0 г/л (уровень убедительности рекомендаций I, уровень достоверности доказательств— С).
Рекомендация 43. Рекомендуемая стартовая доза криопреципитата — 50 мг на 1 кг массы тела, что приблизительно эквивалентно 15—20 дозам препарата. Необходимость повторных доз регулируется тромбоэластометрическим контролем и лабораторной оценкой уровня фибриногена (уровень убедительности рекомендаций II, уровень достоверности доказательств — С).
Комментарии. Фибриноген — конечный компонент в каскаде коагуляции, лиганд агрегации тромбоцитов, поэтому является важным фактором эффективной коагуляции и функции тромбоцитов.
Гипофибриногенемия — обычный компонент комплексных коагулопатий, связанный с массивным кровотечением.
Применение концентрата фибриногена (рекомендуемое пока только в Европе и США) под контролем ТЭГ в сочетании с другими продуктами крови уменьшало смертность по сравнению с предполагаемой, снижало потребность в аллогенных продуктах крови и увеличивало 30-дневную выживаемость. Следует отметить, что в настоящее время концентрат фибриногена не зарегистрирован в Российской Федерации. Альтернативой ему является донорский криопреципитат; 3—4 г концентрата фибриногена эквивалентно 15—20 единицам донорского криопреципитата [104, 105].
Доказано, что концентрация фибриногена снижается у многих пациентов, которые перенесли тяжелую кровопотерю, низкий уровень фибриногена связан с более высокой потребностью в гемотрансфузионной терапии и увеличением летальности [108]. В случае послеродового кровотечения низкая концентрация фибриногена в плазме крови является главным предиктором неблагоприятного исхода [109].
Исследование, выполненное H. Stinger и соавт., показало, что возмещение дефицита фибриногена при массивной кровопотере может улучшить выживаемость пациентов при боевых ранениях [110]. В гражданской обстановке коррекция уровня фибриногена на основе данных ТЭГ уменьшила объем трансфузии аллогенных донорских компонентов крови [90, 111, 112]. Ретроспективные обзоры исследований H. Schöchl и соавт. и B. Shaz и соавт. по ведению массивной кровопотери у пациентов с травмой также показали снижение летальности [112] и увеличение 30-дневной выживаемости [113].
Рекомендация 44. Рекомендуется трансфузия тромбоцитов для поддержания их уровня выше 50·10 9 /л и при вероятности продолжающегося кровотечения, связанного с тромбоцитопенией (уровень убедительности рекомендаций I, уровень достоверности доказательств — С).
Рекомендация 45. У пациентов с продолжающимся кровотечением и/или ЧМТ рекомендуется поддерживать уровень тромбоцитов выше 100·10 9 /л (уровень убедительности рекомендаций II, уровень достоверности доказательств — С).
Рекомендация 46. Стартовая дозировка тромбоцитов — 4—8 единиц или один пакет, если он получен методом афереза (уровень убедительности рекомендаций II, уровень достоверности доказательств — С).
Рекомендация 47. Рекомендуется трансфузия тромбоцитов пациентам с массивным кровотечением или внутричерепным кровоизлиянием, которые получали антитромбоцитарные средства (уровень убедительности рекомендаций II, уровень достоверности доказательств — С).
Рекомендация 48. Трансфузия тромбоцитов рекомендуется, если у пациента зарегистрирована дисфункция тромбоцитов (уровень убедительности рекомендаций II, уровень достоверности доказательств — С).
Комментарии. Исторически сложилось так, что трансфузия донорских тромбоцитов основана на критическом пороговом количестве тромбоцитов. R. Counts и соавт. в проспективном исследовании, включающем пациентов с массивной гемотрансфузией, выявили, что количество тромбоцитов 9 /л является пороговым маркером диффузного кровотечения [114]. А. Ciavarella и соавт. в своем исследовании показали, что количество тромбоцитов 9 /л является наиболее чувствительным лабораторным предиктором кровотечения [115] L. Stansbury и соавт. показали в своем исследовании, что низкий уровень тромбоцитов у пациентов с травмой является предиктором увеличения летальности [116]. P. Johansson и соавт. обнаружили, что назначение донорских тромбоцитов у пациентов с массивным кровотечением из-за разрыва аневризмы брюшной аорты увеличило выживаемость с 30 до 45%, а если количество тромбоцитов было менее 50·10 9 /л, то летальность пациентов увеличивалась до 69% [117].
Ряд исследовательских работ посвящен изучению корреляции количества тромбоцитов и тяжести внутримозговых кровоизлияний у пациентов с ЧМТ. Выявлено, что у больных с закрытыми ЧМТ количество тромбоцитов менее 100·10 9 /л является независимым предиктором прогрессирования внутричерепных кровоизлияний по данным КТ головного мозга, необходимости нейрохирургического вмешательства и увеличения летальности [118].
Дозы от 4 до 8 единиц донорских тромбоцитов, как правило, достаточно, чтобы обеспечить гемостаз у пациентов с тромбоцитопенией при кровотечении и увеличить количество тромбоцитов на 30—50·10 9 /л [119].
Проведены исследования значения роли дисфункции тромбоцитов в патофизиологии травматической коагулопатии [120, 121]. M. Wohlauer и соавт. обнаружили при помощи анализа ТЭГ, что дисфункция тромбоцитов присутствует у пациентов после травмы еще до существенной инфузионной терапии или переливания компонентов донорской крови, что указывает на потенциальную роль ранней трансфузии донорских тромбоцитов при проведении противошоковых мероприятий у пациентов с коагулопатией при травматическом кровотечении [121].
Раннее «профилактическое» введение тромбоцитов у больных с массивным кровотечением, у которых еще нет тромбоцитопении, является спорным. S. Hiippala и соавт. доказали, что уровень тромбоцитов 50·10 9 /л можно ожидать, когда приблизительно два ОЦК будут замещены инфузионными растворами или компонентами донорской крови [108]. Следует отметить, что в ряде исследований показано снижение летальности и тяжести ПОН благодаря агрессивному использованию СЗП и донорских тромбоцитов [122, 123]. Однако доказательства для включения раннего профилактического переливания донорских тромбоцитов в протокол массивной трансфузии являются слабыми [124].
Рекомендация 49. Рекомендуется контролировать уровень ионизированного кальция и поддерживать его в пределах нормального диапазона во время массивной гемотрансфузии (уровень убедительности рекомендаций I, уровень достоверности доказательств — С).
Комментарии. Низкий уровень ионизированного кальция связан с увеличенной летальностью, а также повышенной необходимостью в массивной гемотрансфузии. Кроме того, гипокальциемия в первые 24 часа — прогностически более значимый неблагоприятный фактор летальности и необходимости многократных переливаний, чем самые низкие концентрации фибриногена, ацидоз и тромбоцитопения [125].
Кальций в плазме крови существует или в свободном ионизированном состоянии (45%), или связан с белками и другими молекулами в биологически неактивном состоянии (55%). Нормальная концентрация ионизированной формы колеблется от 1,1 до 1,3 ммоль/л и зависит от уровня pH плазмы. Увеличение уровня pH на 0,1 уменьшает концентрацию ионизированного кальция приблизительно на 0,05 ммоль/л [36]. Доступность ионизированного кальция важна для своевременного образования и стабилизации участков полимеризации фибрина, а уменьшение концентрации кальция в цитозоле ускоряет снижение всех видов тромбоцитарной активности. Кроме того, при низких уровнях ионизированного кальция снижаются сократимость сердца и системное сосудистое сопротивление. С целью сохранения благоприятного влияния на сердечно-сосудистую систему и коагуляцию концентрация ионизированного кальция должна поддерживаться на уровне >0,9 ммоль/л.
Гипокальциемия развивается во время массивного переливания в результате использования цитрата в качестве антикоагулянта в продуктах крови. Цитрат проявляет антикоагулянтное действие, связывая ионизированный кальций. Гипокальциемия больше всего распространена на фоне переливания СЗП и тромбоцитарной массы, так как эти продукты содержат высокие концентрации цитрата. Цитрат подвергается быстрому печеночному метаболизму, и гипокальциемия, как правило, характерное транзиторное явление во время стандартных процедур переливания крови. Метаболизм цитрата может значительно ослабевать вследствие гипоперфузии, гипотермии и печеночной недостаточности [126].
Рекомендация 50. У пациентов с массивным кровотечением рекомендуется использовать концентрат протромбинового комплекса (КПК) для срочного прерывания действия пероральных антикоагулянтов — антагонистов витамина K (уровень убедительности рекомендаций I, уровень достоверности доказательств — А).
Рекомендация 51. Пациентам с массивным кровотечением, получавшим пероральные ингибиторы фактора Xa (ривароксабан, апиксабан или эдоксабан), рекомендуется введение транексамовой кислоты в дозе 15 мг на 1 кг массы тела внутривенно и высоких доз (25—50 ед на 1 кг массы тела) КПК (уровень убедительности рекомендаций II, уровень достоверности доказательств — С).
Рекомендация 52. Пациентам с массивным кровотечением, получавшим дабигатрана этиксилат, рекомендуется введение транексамовой кислоты в дозе 15 мг на 1 кг массы тела внутривенно и КПК в высоких дозах (25—50 ед/кг) (уровень убедительности рекомендаций II, уровень достоверности доказательств — С).
Примечания. Важную роль при оказании медицинской помощи пациентам с ОМК в исследованиях и зарубежных рекомендациях уделяется КПК. В настоящее время на российском фармакологическом рынке имеется несколько вариантов КПК [104—106].
В ряде выполненных исследований по изучению КПК у пациентов с ЧМТ показано, что внутривенное введение КПК превосходит по эффективности трансфузию СЗП по быстроте инактивации антагонистов витамина К [127—129] и снижает частоту развития внутричерепных гематом [130, 131]. На основании результатов ряда исследований в клинической практике, доказывающих превосходство и более высокую эффективность по сравнению с трансфузией СЗП, КПК стали препаратами выбора для инактивации эффектов антагонистов витамина К [132].
В последнее время в клинической практике широко используются прямые пероральные антикоагулянты для предотвращения венозных тромбоэмболических осложнений, профилактики развития инсульта при фибрилляции предсердий, острого коронарного синдрома, а также для лечения тромбоэмболии легочной артерии и тромбоза глубоких вен. Основным действием прямых пероральных антикоагулянтов является прямое ингибирование фактора Xa (ривароксабан, апиксабан или эдоксабан) или ингибирование тромбина (дабигатран). В настоящее время врачи все чаще сталкиваются с пациентами, которые принимают вышеуказанные препараты на фоне травм или острой кровопотери. В настоящее время имеются опубликованные исследования, подтверждающие, что трех- и четырехфакторные КПК, нейтрализуя действие прямых антикоагулянтов, влияют на улучшение системы гемостаза, уменьшают объем кровотечения [104—106].
Рекомендация 53. Рекомендуется рассмотреть применение рекомбинантного активированного фактора коагуляции VII (rFVIIa), если массивное кровотечение и травматическая коагулопатия сохраняются, несмотря на применение стандартных методик гемостаз-корригирующей терапии (уровень убедительности рекомендаций II, уровень достоверности доказательств — С).
Примечания. rFVIIa не является терапией первой линии для остановки кровотечения и может быть эффективным только при верификации массивного кровотечения. Как только массивное кровотечение из поврежденных сосудов остановлено, rFVIIa может быть полезен для индукции коагуляции в местах диффузного коагулопатического кровотечения из малых сосудов. Следует рассматривать применение rFVIIa только если терапия первой линии в сочетании с хирургическими методами и использованием трансфузии продуктов крови (эритроцитов, тромбоцитов, СЗП и криопреципитата/фибриногена, вызывающих увеличение уровней гематокрита выше 24%, тромбоцитов выше 50·10 9 /л и фибриногена выше 1,5—2,0 г/л), а также применение антифибринолитиков и коррекция тяжелого ацидоза, тяжелой гипотермии и гипокальциемии неэффективны для остановки кровотечения [104—106].
Поскольку rFVIIa действует на собственную систему коагуляции пациента, необходимы достаточные уровни тромбоцитов и фибриногена, чтобы мог возникнуть выброс тромбина в результате применения фармакологических доз выше физиологических уровней rFVIIa через прямое связывание с активированными тромбоцитами. Необходимо восстановить уровни pH и температуры тела по возможности приблизительно до физиологических значений, поскольку даже небольшое снижение уровней pH и температуры приводит к замедлению кинетики коагуляции. Прогностическими факторами неблагоприятного ответа на rFVIIa были уровень pH 9 /л, и уровень АД ≤90 мм рт.ст. во время введения rFVIIa [133—135]. Кроме того, у пациентов с тяжелыми травмами часто развивается гипокальциемия; поэтому необходим контроль уровня ионизированного кальция и может потребоваться введение ионов кальция внутривенно.
Рекомендация 54. После остановки кровотечения следует использовать механическую профилактику тромбообразования посредством прерывистой пневматической компрессии и/или использования компрессионного трикотажа нижних конечностей (уровень убедительности рекомендаций I, уровень достоверности доказательств — С).
Рекомендация 55. Фармакологическая профилактика тромбообразования начинает использоваться в пределах 24 часов после достижения окончательного гемостаза (уровень убедительности рекомендаций I, уровень достоверности доказательств — В).
Примечания. У пациентов с риском развития кровотечения предпочтительны механические методы. Противопоказания к фармакологической профилактике тромбообразования: тяжелая тромбоцитопения (число тромбоцитов 9 /л), коагулопатия, наличие продолжающегося кровотечения, неконтролируемой гипертензии (уровень АД >230/120 мм рт.ст.), спинномозговая пункция/спинальная анестезия, планируемые в течение ближайших 12 часов или выполненные за последние 4 часа (24 часа при травме), процедуры с высоким риском развития кровотечения или нового геморрагического инсульта [136].
Выбор оптимального времени начала фармакологической профилактики тромбообразования часто является трудным решением. Рекомендуют начинать тромбопрофилактику в первые 24 часа. Это отражает беспокойство о том, что у пациентов с кровотечением выше риск венозной тромбоэмболии, чем у пациентов без кровотечения [137—139].
На основании вышеизложенных клинических рекомендаций авторским составом предложены алгоритмы: «Первичная стабилизация, диагностика и мониторинг» (рис. 2), «Интенсивная терапия и хирургические вмешательства» (рис. 3)