какие факторы определяют строение сосудов
Чурсин В.В. Клиническая физиология кровообращения (методические материалы к лекциям и практическим занятиям)
Информация
Содержит информацию о физиологии кровообращения, нарушениях кровообращения и их вариантах. Также представлена информация о методах клинической и инструментальной диагностики нарушений кровообращения.
Предназначается для врачей всех специальностей, курсантов ФПК и студентов медвузов.
Введение
Более образно это можно представить в следующем виде (рисунок 1).
Кровообращение – определение, классификация
Объем циркулирующей крови (ОЦК)
Основные свойства и резервы крови
Сердечно-сосудистая система
Сердце
Поскольку q и Q величины постоянные, можно пользоваться их произведением, вычисленным один раз и навсегда, что равно 2,05 кг * м/мл.
Функциональные резервы сердца и сердечная недостаточность
Факторы, определяющие нагрузку на сердце
Здесь также важен вопрос: можно ли усилить эффект закона Г. Анрепа и А. Хилла? Исследования E.H. Sonnenblick (1962-1965 г.г.) показали, что при чрезмерной постнагрузке миокард способен увеличивать мощность, скорость и силу сокращения под воздействием положительно инотропных средств.
Уменьшение постнагрузки.
Каппиляры
Реология крови
Регуляция кровообращения
Определение показателей центральной гемодинамики
Клиническая диагностика вариантов кровообращения
Клинические признаки дисфункции сердечно-сосудистой системы:
— Предположить наличие сердечно-сосудистой дисфункции можно, в первую очередь, на основании ненормальных АД, ЧСС, ЦВД. Однако нормальные величины этих показателей могут быть и при наличии скрытых – ещё компенсированных нарушений.
— Диурез – снижение или повышение мочеотделения также могут быть признаком дисфункции кровообращения.
— Наличие отеков и влажных хрипов в лёгких.
Функциональные показатели для оценки состояния кровообращения.
— Физиологический прирост АД к ЧСС – в норме зависимость величины САД от ЧСС отражается следующим уравнением:
Соответственно при ЧСС 120 в минуту САД должно быть как минимум 150 мм рт.ст.
— Индексы кровообращения (индексы Туркина). Первый из них определяется отношением СДД и ЧСС. Если это отношение равно 1 или близко к 1 (0,9-1,1), то СВ в норме. Второй определяется отношением СДД в мм рт.ст и ЦВД в мм вод.ст. Если это отношение равно 1 или близко к 1 (0,9-1,1), то артериальные и
Какие факторы определяют строение сосудов
Распространено и обосновано деление сердечно-сосудистой системы по уровню кровяного давления: область высокого и область низкого давления. К области высокого давления относят левый желудочек сердца, артерии крупного, среднего и малого калибра, артериолы; к области низкого давления — остальные отделы системы (от капилляров до левого предсердия).
В функциональной классификации шведского физиолога Б. Фолкова предусмотрено деление системы кровообращения на «последовательно соединенные звенья».
1. Сердце — насос, ритмически выбрасывающий кровь в сосуды.
2. Упруго-растяжимые сосуды, которые превращают периодичный выброс крови из сердца в равномерный кровоток (аорта с ее отделами, легочная артерия).
3. Резистивные сосуды (сосуды сопротивления) — прекапиллярный (в основном артериолы) и посткапиллярный отделы (венулы), которые вместе создают общее сопротивление кровотоку в сосудах органов.
4. Прекапиллярные сфинктеры — специализированный отдел мельчайших артериальных сосудов, сокращение гладкомышечных клеток этих сфинктеров может приводить к перекрытию просвета мелких сосудов. Эти сосуды регулируют объем кровотока в капиллярном русле.
5. Обменные сосуды, или истинные капилляры, где кровь контактирует с тканью благодаря огромным поверхностям капиллярного ложа. Здесь реализуется основная функция сердечно-сосудистой системы — обмен между кровью и тканями.
6. Шунтирующие сосуды (артериовенозные анастомозы), наличие которых доказано не для всех тканей.
7. Емкостные сосуды, в которых изменения просвета, даже столь небольшие, что не оказывают существенного влияния на общее сопротивление, вызывают выраженные изменения распределения крови и величины притока ее к сердцу (венозный отдел системы).
Однако разделение на «резистивные» и «емкостные» сосуды весьма условно, поскольку сопротивлением обладают как артериальные, так и венозные сосуды, хотя в количественном плане эта функция различна для указанных отделов. С другой стороны, емкостью обладают как венозные сосуды, так и артериальные. Весьма расплывчатым является и понятие «емкостные сосуды», поскольку одни авторы относят к ним все венозное ложе, другие — только венулы и мелкие вены. Неудачно выделены в классификации и «прекапиллярные» сфинктеры, поскольку в венозном русле также существуют сосуды с расположением гладкомышечных волокон типа сфинктеров или запирательных образований.
Функциональное назначение различных отделов сердечно-сосудистой системы отражает следующая классификация (Б. И. Ткаченко):
1. Генератор давления и расхода крови — сердце, подающее кровь в аорту и легочную артерию во время систолы.
2. Сосуды высокого давления — аорта и крупные артериальные сосуды, в которых поддерживается характерный для индивидуума уровень кровяного давления.
3. Сосуды — стабилизаторы давления — мелкие артерии и артериолы, которые путем сопротивления кровотоку и во взаимоотношении с сердечным выбросом поддерживают оптимальный для системы уровень артериального давления.
4. Распределители капиллярного кровотока — терминальные сосуды, глад-комышечные образования которых при сокращении прекращают кровоток в капилляре или возобновляют его (при расслаблении), обеспечивая необходимое в данной ситуации число функционирующих и нефункционирующих капилляров.
5. Обменные сосуды — капилляры и частично посткапиллярные участки венул, функция которых состоит в обеспечении обмена между кровью и тканями.
6. Аккумулирующие сосуды — венулы и мелкие вены, активные или пассивные изменения просвета которых ведут к накоплению крови (с возможностью ее последующего использования) или к экстренному выбросу ее в циркуляцию. Функция этих сосудов в основном емкостная, но они обладают и резистивной функцией, хотя и намного меньшей, чем стабилизаторы давления.
7. Сосуды возврата крови — крупные венозные коллекторы и полые вены, через которые обеспечивается подача крови к сердцу.
8. Шунтирующие сосуды — различного типа анастомозы, соединяющие между собой артериолы и венулы и обеспечивающие ненутритивный кровоток.
9. Резорбтивные сосуды — лимфатический отдел системы кровообращения, в котором главная функция лимфатических капилляров состоит в резорбции из тканей белков и жидкости, а лимфатических сосудов — в транспортировке резорбированного материала обратно в кровь.
Какие факторы определяют строение сосудов
РНЦХ им. акад. Б.В. Петровского РАМН
клиника аортальной и сердечно-сосудистой хирургии Первого Московского государственного медицинского университета им. И.М. Сеченова, Москва, Россия
ФГБУ «Российский научный центр хирургии им. акад. Б.В. Петровского» РАМН, Москва
Архитектоника, нормальная и патологическая физиология сосудистой стенки
Журнал: Кардиология и сердечно-сосудистая хирургия. 2014;7(6): 59-63
Белов Ю. В., Комаров Р. Н., Винокуров И. А. Архитектоника, нормальная и патологическая физиология сосудистой стенки. Кардиология и сердечно-сосудистая хирургия. 2014;7(6):59-63.
Belov Iu V, Komarov R N, Vinokurov I A. Architectonics, normal and pathological physiology of the vascular wall. Kardiologiya i Serdechno-Sosudistaya Khirurgiya. 2014;7(6):59-63.
РНЦХ им. акад. Б.В. Петровского РАМН
РНЦХ им. акад. Б.В. Петровского РАМН
клиника аортальной и сердечно-сосудистой хирургии Первого Московского государственного медицинского университета им. И.М. Сеченова, Москва, Россия
ФГБУ «Российский научный центр хирургии им. акад. Б.В. Петровского» РАМН, Москва
Для более полного понимания сути проблемы и патогенеза развития заболеваний крупных сосудов необходимо подробно знать анатомо-физиологические аспекты строения сосудистой стенки. Она состоит из трех оболочек: интимы (внутренняя оболочка), медии (средняя оболочка) и адвентиции (наружная оболочка). Каждая из них несет определенную функцию и, как следствие, имеет свою, строго индивидуальную, структуру.
Адвентиция обеспечивает сосудистую стенку (СС) кислородом и питательными веществами, поэтому она пронизана множеством мелких сосудов, которые ее питают (vasa vasorum) и благодаря которым удаляются избыточные продукты естественного метаболизма и элементы, участвующие в патологических процессах в СС. С другой стороны, по vasa vasorum разносятся патологические микроорганизмы, которые могут поражать СС и благодаря которым происходит накопление клеточных элементов, борющихся с инфекцией и воспалительным процессом как таковым (макрофаги, нейтрофилы, лимфоциты). Таким образом осуществляется реализация механизма «снаружи внутрь», по которому обеспечивается защита СС от какого-либо воспалительного процесса [21].
Следующей оболочкой является медия. Ее основная функция каркасная, поэтому она достигает 80% общей толщины СС. Именно на эту оболочку приходится наибольшее гемодинамическое напряжение, и, чтобы его компенсировать, она содержит большое количество эластина и коллагена, а также гладкомышечные клетки (ГМК). Густое скопление эластических волокон находится на границе между интимой и медией, а также медией и адвентицией, тем самым образуя внутреннюю и наружную пластинки, пространство между ними пронизано большим количеством ГМК, перекрещивающихся с эластином и коллагеном. Стоит отметить, что наиболее толстый слой эластических волокон находится в восходящей аорте и ее дуге (артерии эластического типа) и постепенно уменьшается к бифуркации (артерии мышечно-эластического типа); в противоположность этому происходит увеличение числа ГМК. Такие изменения необходимы для поддержания достаточно высоких цифр артериального давления (АД) и, соответственно, проталкивания крови в нижележащие отделы организма.
После ознакомления с общим планом строения СС необходимо перейти к морфологическим элементам каждого слоя, так как именно изменения в этих элементах и приводят к развитию патологического процесса.
1. Эндотелий сосудов
Для питания крупных артерий, на которые приходится основная гемодинамическая нагрузка, необходимы структуры, содержащие множество капилляров, благодаря которым происходил бы забор крови из кровеносного русла для питания сосудистой стенки. Таким элементом является эндотелий. Он практически полностью состоит из капилляров, которые обеспечивают макромолекулярный транспорт и диффузию крови к базальной мембране и медии.
Долгое время считалось, что эндотелий является гомогенным, инертным, пассивным контейнером для крови, но исследования показали его взаимодействие с клетками иммунной системы и молекулами, которые обеспечивают поддержание АД, проницаемости сосудистой стенки и гомеостаза. Это привело к более полному пониманию активной роли эндотелия в здоровой СС и при ее патологии [3, 12, 13, 17].
Следующим свойством эндотелия является его избирательная проницаемость для жидкостей и питательных веществ к средней оболочке артерии. При этом происходят секреция, фильтрация и абсорбция воды, ионов и солей [17, 37]. Прерывается эндотелий только в костном мозге, селезенке и синусах печени. Через слой эндотелия непрерывно могут проходить элементы с диаметром от 1 до 4 нм, для более крупных элементов необходимы специальные транспорты, которые способствуют преодолению этого барьера [43].
Высвобождение NO происходит под действием ацетилхолина, вазопрессина, а в некоторых случаях в связи с сильным стрессом [16, 18]. Количество механизмов, влияющих на высвобождение NO, а тем самым расслабляющих гладкую мускулатуру сосудов велико, однако это компенсируется хорошей лабильностью реакции на такое высвобождение. Постоянное высвобождение NO стимулирует пролиферацию и миграцию ГМК [25], что приводит к ремоделированию сосудистой стенки в этой области.
Действуя на циклооксигеназу, PGI 2 осуществляет вазодилатацию за счет активации метаболического пути арахидоновой кислоты в эндотелии. Кроме того, такой же процесс происходит и в тромбоцитах, что препятствует их агрегации, но не влияет на адгезию [9, 28, 29, 35].
Эндотелий выступает как иммуномодулирующий орган. Кроме того, он обладает барьерной функцией. На него постоянно воздействуют бактериальные агенты, которые могут попасть в кровь, клетки иммунного воспаления (моноциты, макрофаги, нейтрофилы, лимфоциты), а также различные патогенетические молекулы (цитокины, хемокины и др). Эндотелий интенсивно поддерживает противовоспалительную среду, однако постоянное присутствие агрессора может нарушить его защитную функцию, вследствие чего начинает развиваться патологический процесс. Для своей защиты эндотелий способен вырабатывать различные цитокины, использовать растворимые в крови факторы, а также активировать гены цитопротективных агентов, таких как оксидредуктаза [43].
Важным является тот факт, что 1 раз активировав эти механизмы, эндотелий может быстро стимулировать противовоспалительные процессы, что определяется высоким числом цитокиновых и хемокиновых рецепторов, которые регулируют взаимодействие между лейкоцитами и эндотелиальными клетками [32]. В ответ на активацию и избыточный синтез провоспалительных элементов активируется механизм «down-регуляции», в результате которого происходит ограничение воспалительного ответа и, в конце концов, реакция прекращается, тем самым предотвращая неадекватную патологическую активацию в эндотелии.
Эндотелий играет важную роль в регуляции васкулогенеза, ангиогенеза и ремоделировании СС [40]. У здорового взрослого человека пролиферация в СС очень низкая, что создает стабильность сосудистого русла, посредником которой выступает эндотелий. Длительное влияние различных внешних факторов может нарушить стабильность эндотелия, это приводит к развитию гиперплазии интимы. Кроме того, через поврежденный эндотелий начинают проникать липиды с последующей инфильтрацией моноцитами и Т-лимфоцитами [38]. Вследствие этого процесса развивается атеросклероз.
2. Гладкомышечные клетки сосудов
Гладкомышечные клетки сосудов участвуют в поддержании АД, в адаптационных механизмах СС и в процессах ее восстановления. Преимущественно ГМК находятся в медии сосудов, при этом чем дистальнее находится артерия, тем большее количество ГМК содержится в ее стенке.
Интересно, что длительное воздействие клеточных элементов воспаления или активного кислорода на ГМК приводит к экспрессии различных факторов роста, а соответственно к пролиферации клеток. Из-за этого может происходить постоянный миогенез. Продукция и активация факторов роста осуществляются за счет эндотелиальных клеток, поэтому сдерживание гемодинамического напряжения происходит во взаимодействии двух структур [10, 11, 33]. Современная теория гласит, что ГМК являются клетками широкого спектра действия, которые несут функциональную нагрузку. Пластичность ГМК осуществляется за счет изменения структуры в ответ на агрессивные факторы окружающей среды.
На биологию ГМК влияет их фенотипически высокая изменчивость. Они состоят из множества нитей актина и миозина, что способствует их сокращению; на более глубоком уровне основой являются эндоплазматический ретикулум и комплекс Гольджи [6]. Фенотипическую изменчивость используют для объяснения гетерогенности и множества функций ГМК. На изменчивость ГМК в процессе их развития влияет множество факторов, начиная от повреждения экстрацеллюлярного матрикса (ЭМ), до прямого воздействия на них эндотелия.
Основные процессы, которые происходят в системе ГМК, имеют характерные особенности и подразделяются на несколько категорий: 1) восстановление и расширение; 2) дифференцировка; 3) ремоделирование. В результате происходит разделение нового сосуда на артерии и вены.
Наиболее интересны на практике процессы ремоделирования СС за счет изменения ГМК, так как они включаются не только в ангиогенезе, но и при патологических состояниях. Эти процессы начинают работать при активации факторов роста и, что важно, в ответ на физическое или химическое воздействие. Подобное влияние может оказывать, например, эндотелиальный сосудистый фактор роста. Из примеров физического воздействия можно описать увеличение тока крови и давления в сосуде. В этот момент происходит выброс NO для компенсации перерастяжения мышц. Ангиогенез также происходит под действием хронической гипоксии, за счет активации гипоксия-индуцированного фактора, что помогает регулировать данный процесс [7]. Таким образом, основным процессом, которым отвечают ГМК на любое внешнее раздражение, является ремоделирование СС.
Регуляция основной функции ГМК (поддержания тонуса сосудов) происходит под действием различных факторов (Анг-2, тромбин, протромбин и др.). Повышение локальной экспрессии факторов и увеличение количества рецепторов к ним приводит к динамической регуляции тонуса сосуда. Новые молекулярные технологии помогают определять факторы, которые приводят к расширению просвета сосуда [2]. Одним из отличительных признаков ГМК является их пластичность в ответ на расширение. Существует три основных вида ответа ГМК на избыточное расширение СС: 1) гиперплазия; 2) гипертрофия; 3) апоптоз. Большинство заболеваний сосудов связано с одним из них.
При избыточном давлении на сосудистую стенку (например, при артериальной гипертензии) происходит гипертрофия ГМК. Ингибиторы ангиотензин-превращающего фермента действуют профилактически на гипертрофию ГМК за счет снижения АД [36], а антагонист рецепторов ангиотензина (лозартан) уменьшает гипертрофию ГМК, несмотря на повышенное АД [41]. При этом действие β-адреноблокаторов оказывается незначительным. Отсюда можно сделать вывод, что гипертрофия ГМК сосудов происходит под действием ренин-ангиотензиновой системы, что делает препараты, воздействующие на нее, предпочтительными при патологии, сопровождающейся гипертрофией ГМК.
Апоптоз возникает при воздействии какого-либо воспалительного фактора и играет ключевую роль в создании механизмов восстановления ткани и ремоделирования. Объем ГМК, подвергающихся апоптозу, зависит от степени развития атеросклеротической бляшки или диспластических нарушений, а также от локализации процесса [23], и, кроме того, играет важную роль в формировании аневризмы аорты [20]. Известно, что ГМК могут уничтожаться макрофагами, которые в больших количествах скапливаются в средней оболочке артерий при таких поражениях СС. При активном апоптозе в качестве компенсации происходит нарастание синтеза коллагена, который производится ГМК. Это приводит к дестабилизации атеросклеротической бляшки, а также нарушает упругость и усиливает ломкость СС, что является причиной расширения сосуда. Мертвые клетки не могут обезвреживать тромбин, и это приводит к нарастанию тромботических масс вокруг образовавшейся атеромы.
Необходимо отметить, что ГМК сосудов отвечают на большинство изменений особым образом, что делает их важными элементами в понимании процессов, происходящих при патологии сосудов.
3. Элементы соединительной ткани сосудов
Молекула коллагена является основным элементом коллагеновой ткани, она представляет собой палочковидные образования, которые образуют полипептидные α- цепи. Коллаген 1-го и 3-го типов обладает примерно одинаковой структурой. Даже синтез этих двух типов коллагена осуществляется одинаковыми клетками, которые синтезируют один или другой тип коллагена в зависимости от типа ткани, возраста и множества других параметров [4, 45]. В норме метаболизм коллагена идет чрезвычайно медленно, а при быстром нарастании этой ткани происходит резкое ремоделирование СС. В обычном состоянии коллаген является очень устойчивой молекулой, но при повреждениях его молекулы хорошо распадаются под широким спектром протеаз. Из специфических протеаз, которые могут воздействовать на коллаген, можно назвать матриксные металлопротеиназы [34]. Они разрушают целостность молекулы коллагена, в результате чего она начинает самопроизвольно распадаться в течение некоторого времени.
Если коллаген обеспечивает жесткостные свойства СС, то для ее упругости существуют эластические волокна.
Таким образом, очевидно, что структурные компоненты ЭМ несут на себе основную нагрузку в стенке сосуда. Его разрушение ведет к развитию слабости стенки сосуда, при этом образуются компенсаторные процессы в виде гипертрофии и гиперплазии ГМК, которые в свою очередь не могут полностью компенсировать нагрузку, из-за чего начинается их апоптоз. Как результат взаимодействия этих процессов, развиваются атеросклероз, стенозы и аневризмы сосудов.
Основы гемодинамики: факторы, обуславливающие движение крови по сосудам
Система кровообращения с точки зрения механики представляет гидровлическую сеть. В ней содержатся камерные насосы с клапанами ( правое и левое сердце ) и растяжимые трубки, по которым течет вязкая жидкость – кровь.
И сердце, и сосуды способны менять свои геометрические и механические характеристики под влиянием физических, физиологических и биохимических факторов. Один из основных показателей движения крови по сосудам – объемную скорость кровотока – Q можно рассчитать по формуле:
Объемная скорость кровотока одинакова в разных регионах сосудистого русла и составляет 4-6 л/мин. Линейная скорость кровотока в аорте максимальна – 50 см/сек, в капиллярах – 0,07 см/сек, в полых венах – 33 см/сек.
Эти формулы взяты из гидродинамики, они не учитывают неравномерности тока крови внутри сосуда, наличия вихревых токов, неоднородности крови и т.д. Тем не менее они применимы для упрощенной оценки кровотока. В них формализованы основные физиологические факторы, определяющие движение крови по сосудам.
Существует термин эффективная вязкость крови, или вязкость движущейся крови в сосуде. Она определяется силой трения крови о стенки сосуда и ее слоев относительно друг друга.
Напряжение сдвига – сила взаимодействия движущихся слоев жидкости, которая уменьшается при нарастании линейной скорости то- ка крови (рис. 1).
При низкой скорости кровотока эффективная вязкость растет за счет уменьшения градиента и может увеличиться в 8-10 раз в мелких сосудах с низкой скоростью кровотока. Последнее не распространяется на капилляры, в которых эффективная вязкость снижается в связи с изменением агрегации эритроцитов.
При высокой скорости кровотока вязкость резко увеличивается за счет перехода ламинарного типа течения жидкости в турбулентное (рис. 2). Наиболее выражен этот процесс в местах разветвлений и крутых изгибов сосудов ( дуга аорты, раз- ветвление сонных артерий и т.д.).
При этом сила трения слоев жидкости и, соответственно, вязкость, рез- ко нарастают (возможно при мышечной работе и анемии). Величина артериального давления является важным показателем гидродинамики. Основной фактор движения крови по сосудам – разница давлений. Она активно создается в артериальной системе работой сердца. По ходу кровеносной системы давление снижается, являясь максимальным в аорте и минимальным в полых венах.
Факторы, определяющие величину артериального давления.
При оценке артериального давления используют следующие показатели:
Артериальное давление определяют двумя группами методов: прямыми и косвенными.
К косвенным методам относятся аускультативный метод Короткова и пальпаторный метод Рива-Роччи. Прямое измерение артериального давления производят с помощью датчика давления, который можно вводить в полость артерии или соединять с ней при помощи специальных катетеров.
Особенности венозного кровотока. Вены относятся к сосудам низкого давления, по отношению к со- противлению кровотока резистивная функция выражена слабо, но сильно – емкостная.
Морфологически отличаются от артерий:
Функционально отличаются от артерий:
Функции вен:
Вспомогательные факторы движения крови по венам:
Нарушения венозного кровотока могут приводить к патологическому венозному заcтою крови, снижению венозного возврата к сердцу и падению артериального давления. Венозный застой может возникнуть при сердечной недостаточности.
Микроциркуляция и транскапиллярный обмен.
Важнейшими компонентами микроциркуляции, обеспечивающей тканевой гомеостаз, являются:
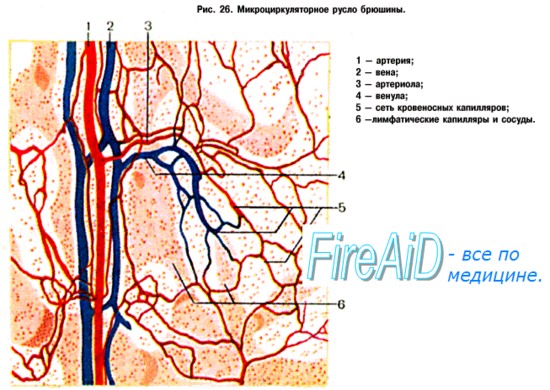
К зоне микроциркуляции относят: артериолы, прекапиллярные артериолы, капилляры, посткапиллярные венулы, венулы и артериоло- венулярные анастамозы.
Основой зоны микроциркуляции является капилляр. По строению различают:
Общая площадь поперечного сечения всех капилляров 11000 см2, количество капилляров – 40 миллиардов. Общая площадь обмена капиллярной сети составляет 1000 м2, или 1,5 м2 на 100 г ткани. Плотность капиллярной сети в тканях различна ( в мозге – 3000 кап / мм3, в тонических мышцах – 1000 кап / мм3, в фазных скелетных мышцах – 300-400 кап/ мм3 ). В активно работающих мышцах плотность сети капилляров увеличивается.
Движение крови в микрососудах имеет ряд отличий, связанных с малым диаметром капилляра ( от 4 до 20 мкм, но обычно 7-8 мкм ). Скорость движения крови ( оценивают по скорости движения эритроцитов ) разная, поток крови не стационарный. Клетки крови при движении выстраиваются строго друг за другом, эритроциты при движении через капилляры с малым диаметром могут изменять свою форму.
При активности ткани в условях физиологического покоя открыта часть капилляров. Их количество возрастает в 2-3 раза при рабочей гиперемии.
Открытие капилляров регулируется оксигенацией тканей: при высоких значениях РО2 ( 50-60 мм. рт.ст.) количество функционирующих капилляров снижается в 2 раза, а при максимальном напряжении кислорода в тканях ( 100 мм.рт.ст. ) все обменные капилляры закрываются и кровь течет через артериоловенулярные шунты.
Транскапиллярный обмен обеспечивается следующими процессами: диффузией, фильтрацией и реабсорбцией.
Диффузия. Состоит в движении водорастворимых веществ низкой молекулярной массы через заполненные водой поры.
Фильтрация и реабсорбция. В процессе фильтрации кровь интенсивно обменивается с тканевой жидкостью водой и водорастворимыми компонентами. Между объемом жидкости, который переходит в меж- клеточную среду из плазмы в артериальном конце капилляра, и объемом жидкости, поступающим обратно в кровь в процессе реабсорбции существует динамическое равновесие. Оба процесса связаны с градиентами гидростатического и онкотического давлений.