какие химические связи возникают между молекулами воды
Какое строение имеет молекула воды
Вода является источником жизни для всех живых организмов.
Молекула воды имеет уникальное строение. В ней удивительным образом сочетаются прочность и устойчивость кристаллической структуры (льда), и подвижность жидкого вещества.
В статье мы подробно рассмотрим особенности строения молекулы воды в различных агрегатных состояниях: жидком, твердом, газообразном.
Какое строение имеет молекула воды
Долгое время химики считали воду простым соединением, не вступающим в сложные реакции.
Состав воды как сложного вещества был установлен Лавуазье в 1783 г.
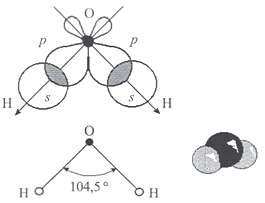
Одна молекула воды состоит из трех атомов: двух атомов водорода и одного атома кислорода, которые соединены между собой ковалентной связью. Химическая формула: H₂O
Характерные свойства ковалентной связи — направленность, насыщаемость, полярность, поляризуемость. Они определяют химические и физические свойства соединений.

По форме молекула воды напоминает равнобедренный треугольник, в основании которого находятся два атома водорода. Связь между атомом кислорода и атомами водорода полярная, т.к. кислород притягивает электроны сильнее, чем водород.
Межъядерные расстояния О—Н близки к 0,1 нм, расстояние между ядрами атомов водорода равно 0,15 нм, угол между связями Н—О—Н равен 104,5°.
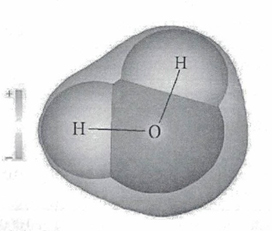
Молекула воды имеет два положительных и два отрицательных полюса и поэтому в большинстве случаев ведёт себя как диполь (т.е. на одной стороне – положительный заряд, на другой – отрицательный)
Значения эффективных зарядов на атомах составляет ±0,17 от заряда электрона.
Водородная связь
В жидкой воде происходит ассоциация молекул, т. е. соединение их в более сложные агрегаты за счёт особой химической связи, которая называется водородной.
Особенностями водородной связи, по которым её выделяют в отдельный вид, является её не очень высокая прочность.
Водородная связь также играет важную роль в процессах растворения, поскольку растворимость зависит и от способности соединения давать водородные связи с растворителем. В результате содержащие ОН-группы такие вещества, как сахар, глюкоза, спирты, карбоновые кислоты, как правило, хорошо растворимы в воде.

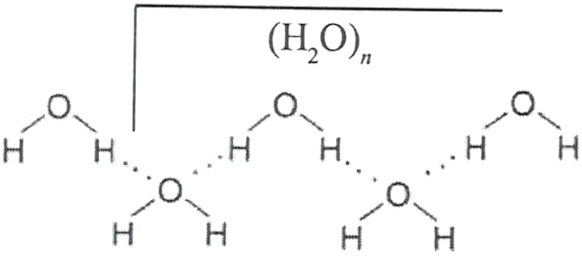
Димер — это две молекулы Н2О, соединенные водородной связью. Связь между молекулами воды водородная.
Каждая молекула способна образовать четыре водородные связи: две между неподеленными электронными парами её атома кислорода и атомами водорода соседних молекул и ещё две – между атомами водорода и атомами кислорода двух других молекул.
Энергия водородной связи может изменяться от 17 до 33 кДж/моль.
Строение молекулы в различных агрегатных состояниях
Вода может быть в нескольких состояниях:
Существуют также и переходные состояния жидкости, которые возникают при замерзании или испарении.
Примечательно, что различные формы воды могут одновременно находиться рядом и даже взаимодействовать, например реки с ледниками, айсберги с морской водой, облака на небе с водяным паром.
Строение молекулы воды, водородная связь способствует расположению молекул воды. Рассмотрим особенности каждого агрегатного состояния по отдельности.
Представляет собой твердое состояние воды.
Молекулы воды образуют слои, причём каждая молекула связана с тремя молекулами в своём слое и с одной молекулой соседнего слоя. Расстояние между атомами кислорода ближайших молекул равно 0,276 нм.
Атом кислорода связан с четырьмя атомами водорода: с двумя, расположенными на расстоянии 0,096 — 0,102 нм посредством валентных связей, и с двумя другими, находящимися на расстоянии 0,174 — 0,180 нм посредством водородных связей.
Жидкая вода
В отличие от структуры льда структура жидкой воды исследована ещё недостаточно.
Предполагается, что жидкая вода по своему строению представляет нечто среднее между кристаллами льда и паром.
В результате изучения молекулы воды с помощью инфракрасных и рентгеновых лучей было видно, что при температуре близкой к точке замерзания, молекулы жидкой воды собираются в небольшие группы, практически так, как в кристаллах.
При температуре близкой к точке кипения они располагаются более свободно.
Водяной пар
Это газообразное агрегатное состояние воды.
При данном состоянии молекула воды не имеет структуры и состоит преимущественно из мономерных молекул воды, которые находятся на расстояние относительно друг друга.
Из чего состоит вода
При обычных условиях вода выглядит как прозрачная жидкость. У нее отсутствуют вкус и запах. При небольшой толщине слоя не наблюдается даже цвета.
Вода является отличным растворителем. В природе в ней постоянно находятся растворенные газы и соли. При соединении атомов кислорода с водородом получается молекула воды. Поскольку более сильными являются водородные соединения, то, когда происходит их разрыв, они прикрепляются к иным веществам, помогая тем растворяться.
Из-за своего малого размера каждую молекулу растворенного вещества окружают очень много молекул воды. Благодаря этому в ней присутствуют отрицательные и положительные ионы.
Чистая вода является еще и хорошим изолятором с концентрацией протонов и гидроксильных ионов в количестве 10-7 моль/л, это позволяет ей проводить электричество. Именно по ее электропроводности можно оценивать чистоту жидкости.
При взаимодействии с другими веществами состав воды не изменяется, что играет особую роль в жизни любого живого организма. Ведь очень важно, чтобы жидкостные растворы, через которые в организм поступают полезные вещества, не изменялись.
Кроме того, вода хорошо поглощает инфракрасное и микроволновое излучение, а также способна хранить в себе память о веществах, которые были в ней растворены.
Элементы
Проходя гидрологический цикл: испарение, конденсацию и выпадение в виде осадков вода может дополняться разными химическими элементами, которые можно разделить на 6 категорий. Рассмотрим информацию в таблице № 1.
Таблица № 1 «Элементы, которые могут входить в состав воды».
| Ионы | Na, K, Mg, Ca, анионы: Cl, HCO3 и SO4. Эти компоненты находятся в воде в наибольшем, по сравнению с другими, количестве. |
| Растворенные газы | Кислород, азот, сероводород, углекислый газ и прочие. Количество каждого газа в воде напрямую зависит от ее температуры. |
| Биогенные элементы | Главными из них являются фосфор и азот, которые поступают в жидкость из осадков |
| Микроэлементы | Их насчитывается около 30 видов: бром, селен, медь, цинк и т. д. Показатели их в составе воды очень малы и колеблются от 0,1 до микрограмма на 1 литр. |
| Органические вещества | Спирты, углеводы, альдегиды, фенолы, пептиды и прочее. |
| Токсины | Тяжелые металлы и продукты нефтепереработки. |
В настоящий момент доступны специальные методы очистки, которые эффективно борются с вредными химическими соединениями.
Вода также может содержать в себе магний и катионы кальция. В зависимости от этого ее подразделяют на мягкую и жесткую.
По изотопам водорода в молекуле воды можно говорить о легкой воде, тяжелой и сверхтяжелой воде.
Подводим итоги
Вода необходима для жизни всего живого на Земле. Она участвует в мировом круговороте воды в природе. Благодаря испарению с поверхности водоемов, почвы, растений образуются облака. Затем они выпадают в виде дождя, снега, града, питая собой подземные воды и родники. Родниковые воды по рекам попадает в море.
Таким образом, количество воды на Земле не изменяется, она только меняет свои формы — это и есть круговорот воды в природе.
Уникальное строение молекулы воды помогает ей трансформироваться в три агрегатных состояния.
При замерзании воды ее молекулы собираются в небольшие группы. При испарении находится на расстоянии относительно друг друга. Жидкая вода по своему строению представляет нечто среднее между кристаллами льда и паром.
Водородная связь.
Водородная связь – связь между положительно заряженным атомом водорода одной молекулы и отрицательно заряженным атомом другой молекулы.
Механизм возникновения водородной связи – частично электростатический и частично донорно-акцепторный.
Характерной чертой водородной связи является расстояние между атомом водорода и другим атомом, её образующим. Оно должно быть меньше, чем сумма радиусов этих атомов.
Водородная связь подразделяется:
1. Межмолекулярная водородная связь образуется между молекулами веществ, в состав которых входят водород и сильно электроотрицательный элемент – фтор, кислород, азот, хлор, сера. Сильно смещенная общая электронная пара от водорода к атому отрицательно заряженного элемента, при этом положительный заряд водорода сконцентрирован в малом объеме, приводит взаимодействие протона с неподеленной электронной парой другого атома или иона, обобществляя её.
Водородную связь обозначают точками, указывая, что она намного слабее ковалентной связи (примерно в 15-20 раз).
Межмолекулярная водородная связь: две молекулы воды и две молекулы уксусной кислоты с образованием циклической структуры
2. Внутримолекулярная водородная связь присутствует в многоатомных спиртах, углеводах, белках и других органических веществах.
Молекула салициловой кислоты.
Вещества с водородной связь имеют молекулярные кристаллические решетки, в узлах которой находятся молекулы.
Примеры: вода в виде льда, йод, хлор, бром, «сухой лёд» (твердый диоксид углерода), твёрдый аммиак, а также твёрдые органические вещества (метан, бензол, фенол, нафталин, белки и т.д.).
Физические свойства веществ с водородной связью.
Водородная связь обеспечивает низкомолекулярным веществам способность быть при обычных условиях в жидком агрегатном состоянии (этанол, метанол, вода) или сжижающимися газами (аммиак, фтороводород).
Более высокая температура кипения воды (100 о С) по сравнению с водородными соединениями элементов подгруппы кислорода (Н2S, Н2Sе, Н2Те), так как затрачивается дополнительная энергия на разрушение водородных связей.
Также при плавлении воды её плотность возрастает. Это объясняется тем, что в структуре льда каждый атом кислорода связан через атомы водорода с четырьмя другими атомами кислорода других молекул воды. В результате образуется рыхлая «ажурная» структура.
Какие химические связи возникают между молекулами воды
§7.4 Вода. Водородная связь.
Ни одна из планет Солнечной системы не содержит на своей поверхности такого большого количества воды, как наша Земля. Моря и океаны, средняя глубина которых около 6 км, покрывают 71 % поверхности Земли. Огромное количество воды в виде снега и льда сосредоточено в приполярных районах.
Этот удивительный факт пока не нашел однозначного объяснения. Безусловно, вода играет огромную роль в возникновении и существовании жизни на нашей планете. Во многом это связано со свойствами, которых нет у ее ближайших соседей и аналогов (H 2 S, H 2 Se и т.д. – см. таблицу 7-1 в предыдущем параграфе). Прежде всего нужно разобраться, почему вода может находиться в жидком и даже в твердом состоянии (лед) в условиях, в которых похожие соединения водорода с более тяжелыми элементами (серой, селеном и т.д.) газообразны.
Молекула воды имеет следующее строение:
Две поделенные электронные пары участвуют в образовании двух полярных ковалентных связей, а оставшиеся две неподеленные пары электронов тоже играют важную роль в свойствах воды. Все заместители у атома кислорода, включая неподеленные пары, стремятся расположиться как можно дальше друг от друга (вспомните §3.6). Это приводит к тому, что молекула приобретает форму искаженного тетраэдра с атомом кислорода в центре. В четырех вершинах этого «тетраэдра» находятся два атома водорода и две неподеленные пары электронов. Но если смотреть только по центрам атомов, то получается, что молекула воды имеет угловое строение, причем угол Н–О–Н составляет примерно 105 градусов.
Для возникновения водородных связей важно, чтобы в молекулах вещества были атомы водорода, связанные с небольшими, но электроотрицательными атомами, например: O, N, F. Это создает заметный частичный положительный заряд на атомах водорода. С другой стороны, важно, чтобы у электроотрицательных атомов были неподеленные электронные пары. Когда обедненный электронами атом водорода одной молекулы (акцептор) взаимодействует с неподеленной электронной парой на атоме N, O или F другой молекулы (донор), то возникает связь, похожая на полярную ковалентную.
Рис. 7-1а. Водородные связи между молекулами воды (обозначены пунктиром).
Рис. 7-1б. Объемная модель, показывающая расположение молекул воды, связанных водородными связями.
В водных растворах аммиака или HF эти молекулы образуют водородные связи не только между собой, но и с молекулами воды. Благодаря водородным связям аммиак NH 3 имеет фантастическую растворимость: в 1 л воды может растворяться 750 л газообразного аммиака! В органических веществах встречаются также внутримолекулярные водородные связи, сильно влияющие на пространственную форму этих молекул.
Энергия связи водородной связи Н—О в димере воды (H 2 O) 2 составляет 21,5 кДж/моль, а ее длина 2,04 А. Таким образом, эти связи более длинные и примерно в 10-20 раз менее прочные, чем обычные ковалентные, но именно они заставляют воду быть жидкостью или льдом (а не газом) в обычных условиях. Водородные связи разрушаются только тогда, когда жидкая вода переходит в пар.
При температурах выше 0 °С (но ниже температуры кипения) вода уже не имеет такую упорядоченную межмолекулярную структуру, как показано на рисунках 7-1а и 7-1б. Поэтому в жидкой воде молекулы связаны между собой лишь в отдельные агрегаты из нескольких молекул. Эти агрегаты могут свободно двигаться рядом друг с другом, образуя подвижную жидкость. Но при понижении температуры упорядоченность становится все больше и больше, а агрегаты – все крупнее. Наконец, образуется лед, который имеет примерно такую упорядоченную структуру, как на рис. 7-1б и 3-15 из §3.8.
Кстати, на этих рисунках хорошо видно, что в кристалле льда между молекулами остаются пустоты. Объем пустот чуть больше, чем размер отдельной молекулы Н 2 О. Поэтому лед имеет меньшую плотность, чем жидкая вода и плавает на поверхности. Большинство же других веществ при замерзании увеличивает свою плотность.
Таким образом, водородные связи придают воде еще одно уникальное свойство, без которого вряд ли могла бы существовать разнообразная жизнь в тех районах Земли, где температура зимой понижается ниже 0 °С. Если бы лед тонул в воде, то зимой все водоемы промерзали бы до самого дна. Трудно ожидать, что рыбы согласились бы жить в таких условиях. Человек мог бы растапливать лед, превращая его в воду для своих нужд, но это потребовало бы огромных затрат дополнительной энергии.
** Еще одно красивое проявление водородных связей – голубой цвет чистой воды в ее толще. Когда одна молекула воды колеблется, она заставляет колебаться и связанные с ней водородными связями другие молекулы. На возбуждение этих колебаний расходуются красные лучи солнечного спектра, как наиболее подходящие по энергии. Таким образом, из солнечного спектра «отфильтровываются» красные лучи – их энергия поглощается и рассеивается колеблющимися молекулами воды в виде тепла.
В белом солнечном свете различные цвета как бы уравновешивают друг друга. Поэтому солнечный свет кажется глазу «белым» – лишенным цвета. Если «отфильтровать» лучи одного участка спектра, то начинает проступать другой – в данном случае голубой участок спектра. Он и окрашивает воду в красивый голубой цвет. Но для этого требуется, чтобы солнечный луч прошел не менее чем через 2-х метровую толщу чистой воды и «потерял» достаточно много красных лучей.
Связь строения воды с ее функциями
1. Один атом кислорода в воде соединен ковалентными связями с парой атомов водорода. Поэтому каждый атом водорода приобретает частично положительный заряд, а атом кислорода частично отрицательный.
2. Между отрицательно заряженным атомом кислорода одной молекулы воды и положительно заряженным атомом водорода другой молекулы имеется водородная связь. Потому молекулы воды и связаны друг с другом.
3. Водородные связи легко разрушаются — они в 20 раз слабее ковалентных связей. Поэтому молекулы воды подвижны в клетке и организме.
4. Водородные связи также обусловливают высокую температуру кипения воды, теплоемкость (способность поглощать тепло при минимальном колебании собственной температуры).
Роль воды в живой системе — клетке
1. Молекула воды — это диполь, так как в области атомов водорода преобладает заряд положительный, а в области атома кислорода выше плотность отрицательного заряда.
2. Угол связи H-O-H в молекуле воды составляет 104,5 градуса, поэтому положительный и отрицательный заряды сосредоточены на разных концах молекулы. И именно поэтому вода — прекрасный растворитель полярных веществ.
3. Вода вообще является универсальным растворителем благодаря своей способности образовывать гидраты.
4. Вода способна на ориентирование в электрическом поле, она может присоединиться к различным молекулам и участкам молекул, несущим заряд, — при этом образуются гидраты. Если силы притяжения внутри молекулы воды меньше, чем силы притяжения молекул воды к молекулам иного вещества, это вещество растворятся в воде.
5. Поэтому выделяют гидрофильные вещества — они хорошо растворимы в воде: соли, щелочи, кислоты. Данные вещества диссоциируют на заряженные частицы — катионы и анионы. Молекулы воды взаимодействуют с ними.
6. Кроме полярных соединений к гидрофильным веществам относятся также сахара, аминокислоты, спирты — неполярные соединения, в составе которых имеются полярные группы (OH, различные радикалы).
7. Гидрофобные вещества — с трудом или вовсе не растворяются в воде. К ним относятся жиры, жироподобные вещества, бензин, парафин, каучук. Жироподобные вещества находятся, например, внутри клеточных мембран, ограничивая исход растворенных веществ из клетки в окружающую среду и проникновение обратно.
8. Вода — участник многих реакций в клетке, ведь большинство реакций идут как раз в водном растворе. Белки, липиды, углеводы и другие органические вещества расщепляются в результате работы ферментов и взаимодействия с водой до более простых веществ в результате реакций гидролиза.
9. В связи с высокой теплоемкостью вода отлично поддерживает тепловое равновесие в клетке, и при сильном повышении температуры среды вода нагревается медленно, но долго сохраняет тепло. Организмы защищены водой от резких колебаний температуры окружающей среды, поэтому процессы обмена веществ могут происходить в стабильных условиях.
10. Вода имеет относительно высокую для жидкостей теплопроводность. Тепло равномерно распределяется по всему объему воды в клетке, препятствуя перегреванию в отдельных точках.
11. Испарение воды обеспечивает охлаждение именно всей поверхности клетки, так как на разрыв водородных связей тратится энергия. Таким образом, вода участвует в терморегуляции.
12. Вода — источник кислорода, который растения выделяют в атмосферу.
13. Вода — источник водорода, который используется для синтеза органических веществ растениями.
14. Вода — среда для транспорта веществ в организме. Она обеспечивает ток лимфы и крови, восходящие и нисходящие токи растворов по древесине и лубу у растений. В клетках вещества, растворенные в воде, транспортируются через клеточные мембраны. Транспортные функции воды обеспечиваются ее низкой вязкостью и высокой подвижностью.
15. В клетке различают воду свободную (ее 90 процентов) и связанную (10 процентов). Связанная вода участвует в образовании макромолекул и никогда не теряется живой клеткой. Вода определяет объем и тургор клеток и тканей. Тургор — напряженное состояние плазматической мембраны, вызванное давлением воды внутри клетки.
16. Вода характеризуется высоким поверхностным натяжением — этим обеспечивается сцепление ее молекул. Благодаря такому свойству молекулы воды передвигаются по проводящим тканям растений, а также некоторые животные двигаются по поверхности воды. Например, клоп-водомерка при передвижении использует именно поверхностное натяжение воды. На первой и третьей паре ног у него есть специальные волоски, которые не продавливают слой воды, а держат жука на поверхности.
17. При замерзании воды ее объем возрастает, а плотность уменьшается, поэтому вода в виде льда всплывает на поверхность водоема. Максимальную плотность вода имеет при температуре 4 градуса, а при 0 она имеет меньшую плотность. Зимой часть воды в реках превращается в более легкий лед, который всплывает на поверхность и создает защиту для речных обитателей, препятствуя промерзанию толщи воды. При этом более теплая и плотная вода (с температурой не ниже 4 градусов) концентрируется под покровом льда, создавая условия для выживания водных животных. Поздней осенью, при понижении температуры ниже 4 градусов в клетках растений образуются кристаллы льда и они погибают. Чтобы выжить, многие растения накапливают в тканях белки и сахара, благодаря чему вода с растворенными в ней органическими веществами не замерзает, и растения благополучно переносят холода.
Вода | Строение молекулы и структура воды в жидком, твердом и газообразном виде.
Содержание:
1. Современные представления о составе и структуре воды. Строение молекулы воды. Легкая и тяжелая вода.
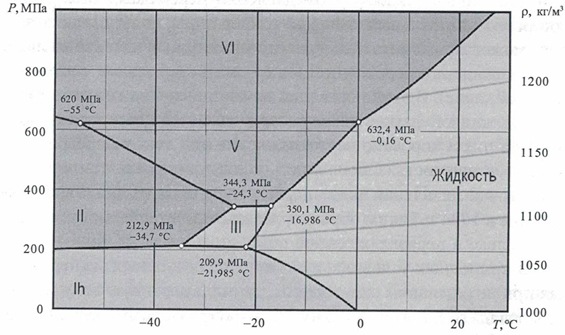
В «тройной» точке на диаграмме может одновременно существовать вода во всех трех агрегатных состояниях.
В «критической» точке все свойства жидкости и пара (энергия, плотность, структура, характер движения частиц и т.п.) становятся равны. При более высоком давлении и/или температуре агрегатное состояние воды называют «сверхкритическим».
В стабильном энергетическом состоянии молекула воды имеет тетраэдрическую пространственную структуру. При изменении агрегатного состояния воды длина сторон и угол между ними меняются. Если бы мы увидели молекулу воды, то обнаружили, что она имеет сфероидальную форму с двумя выпуклостями (рисунок 3).
Наличие неподеленных пар электронов у кислорода и смещение обобществленных электронных пар обуславливает возникновение водородных связей, что способствует ассоциации молекул воды в группы.
Обладая значительным дипольным моментом, молекулы воды также сильно взаимодействуют с полярными молекулами других веществ.
Идеально чистую воду практически невозможно получить. По факту, мы всегда будем иметь дело хоть и с очень разбавленными, но растворами.
В природе на 1 000 000 молекул воды в среднем приходится:
— 997 284 молекул легкой воды 1 H2 16 O;
— 311 молекул 1 HD 16 O;
— 390 молекул 1 H2 17 O;
— 2005 молекул 1 H2 18 O.
Если из глубинной океанической воды, отвечающей стандарту SMOW (Standard Mean Ocean Water) удалить все тяжелые изотопы и заменить их на 1 H2 16 O, то масса 1 л такой воды станет меньше на 250 мг, т.е. на четверть.
2. Структура воды. Водородные связи.
В ходе современных физико-химических исследований были выявлены характерные структурные агрегаты воды, формирующиеся с помощью водородных связей.
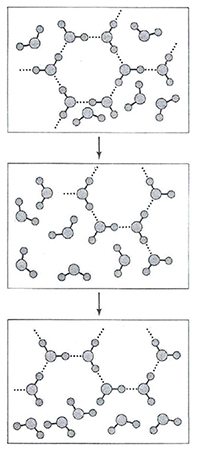
Для формирования трехмерных структур необходимо, кроме способности молекул создавать водородные связи, выполнение еще двух условий. Этих связей должно быть не менее четырех на одну молекулу и геометрические размеры молекулы не должны противоречить оптимальным направлениям водородных связей. Вода удовлетворяет этим требованиям. Так, нагревая лед мы получаем смесь жидкой воды и кристаллов льда, температура которой останется неизменной до тех пор, пока все кристаллики не расплавятся. Это говорит о том, что подводимое нами тепло будет расходоваться в первую очередь на разрушение водородных связей льда.
3. Структура воды в жидком виде.
Жидкость, как известно, отличается от других агрегатных состояний вещества своей текучестью, т.е. способностью неограниченно менять форму под действием касательных механических напряжений, сохраняя при этом объем. Жидкость способна течь даже под свей неподвижной поверхностью. Молекулы жидкости не имеют своего строго определенного места, но, все же, им недоступна полная свобода перемещения, как в паре.
Структура жидкости есть статистическая закономерность межмолекулярных расстояний и ориентаций, характерных для плотно упакованных систем.
Согласно одной из первых моделей воды Бернала и Фаулера, основанной на рентгеноструктурном анализе, существует три формы расположения молекул в жидкой воде:
В 1951 г. Дж. Попл предложил модель воды в виде непрерывной сетки (рисунок 5), отличной от модели Бернала и Фаулера. Отличия заключались в том, что сетка была случайной, связи в ней искривлены и имеют различную длину.
Попл объяснял уплотнение воды при плавлении искривлением связей. Однако, данная модель не могла объяснить нелинейность зависимости свойств воды от температуры и давления.
Почти одновременно с идеей Попла возникли кластерные и клатратные модели, которые можно обозначить как «смешанные».
Кластерная модель представляла жидкую воду как кластеры из молекул, связанных водородными связями, плавающих в объеме свободных молекул. В группе кластерных моделей выделяется теория Г.Немети и Х.Шераги (рисунок 6). Отметим, что в данной модели разрушение одной водородной связи приводит к разрушению всего кластера. Разрушение и образование кластеров происходит постоянно.
Кластерная модель не говорит о расположении молекул в гроздьях, но авторы предполагают наличие отдельных «роев». При этом постулируется тот факт, что большинство молекул должно быть тетракоординировано. Состояние молекул будет определяться количеством водородных связей, которые она образует (0-5).
Удар по кластерной теории наносят исследования Г.Стэнли на основе теории перколяции (протекания). Г.Стэнли доказывает невозможность существования в воде изолированных кластеров.
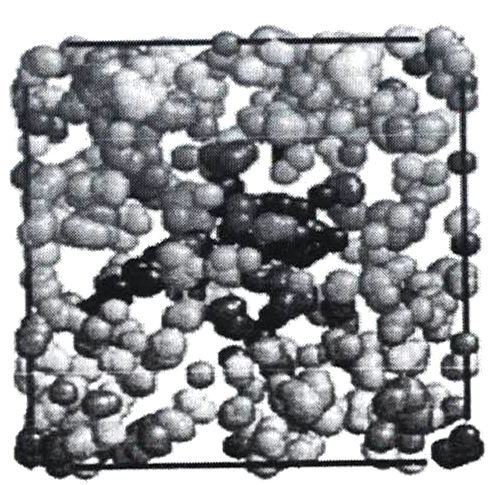
Клатратная модель говорила о воде как о непрерывной сетке-каркасе связанных молекул, внутри которого содержались пустоты со свободными молекулами.
Первую модель клатратного типа предложил О.Я.Самойлов в 1946 году. В ее основе лежало представление о жидкой воде как о испорченной, размытой структуре льда Ih с частичным заполнением полостей мономерами. В процессе движения молекул решетка постоянно перестраивается. Настройкой свойств и концентраций микрофаз, а также параметрами пустот легко можно было объяснить все закономерности свойств воды.
Пустоты в воде по результатам моделирования имеют тенденцию объединяться друг с другом, образуя еще более крупные пустоты, как показано на рисунке 7.
Рассмотрим кластерную и клатратную модели строения жидкой воды подробнее.
3.1 Кластерная модель строения жидкой воды.
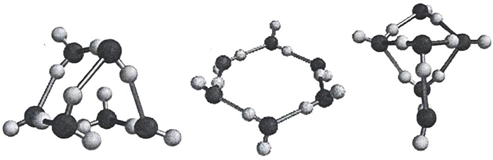
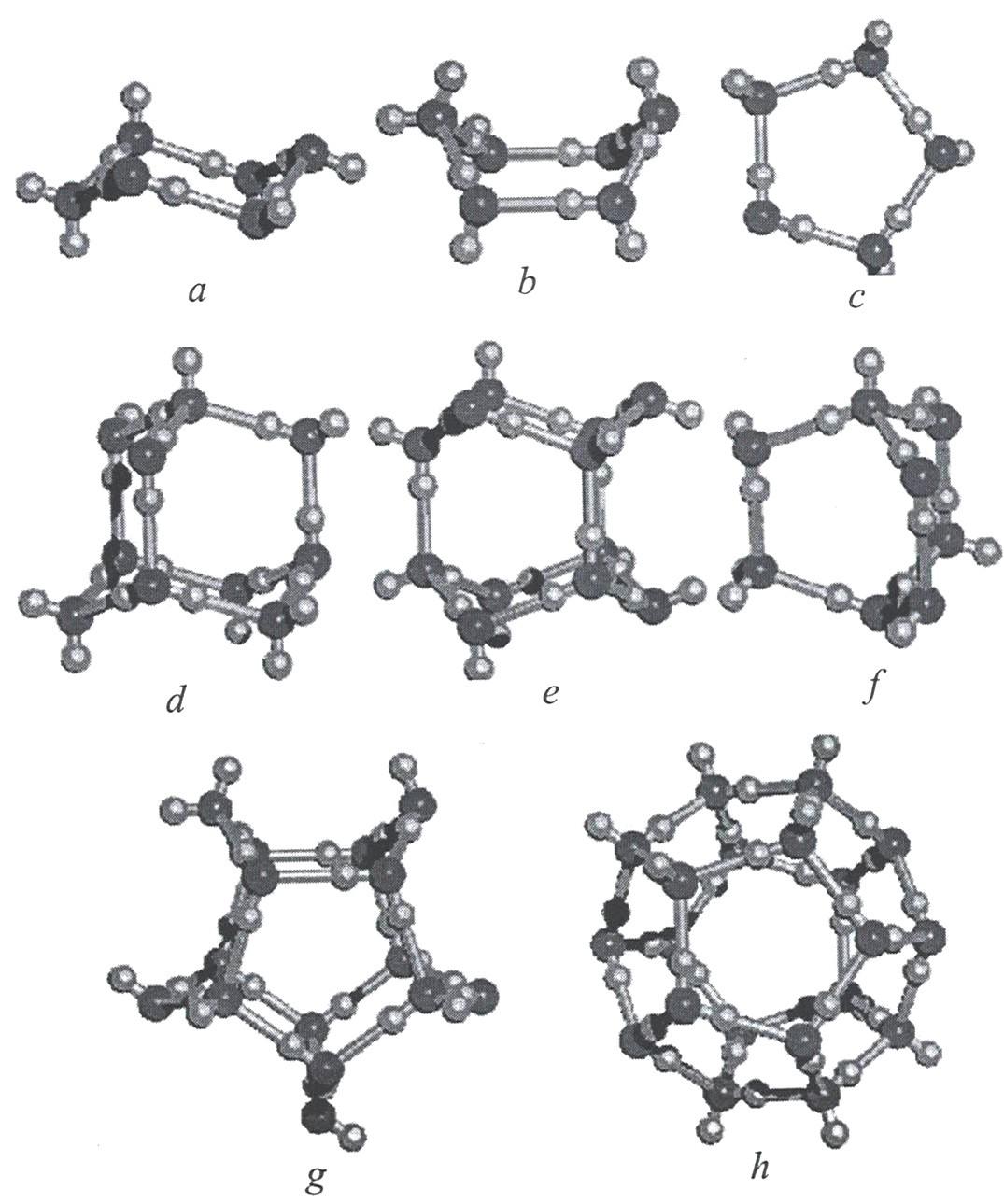
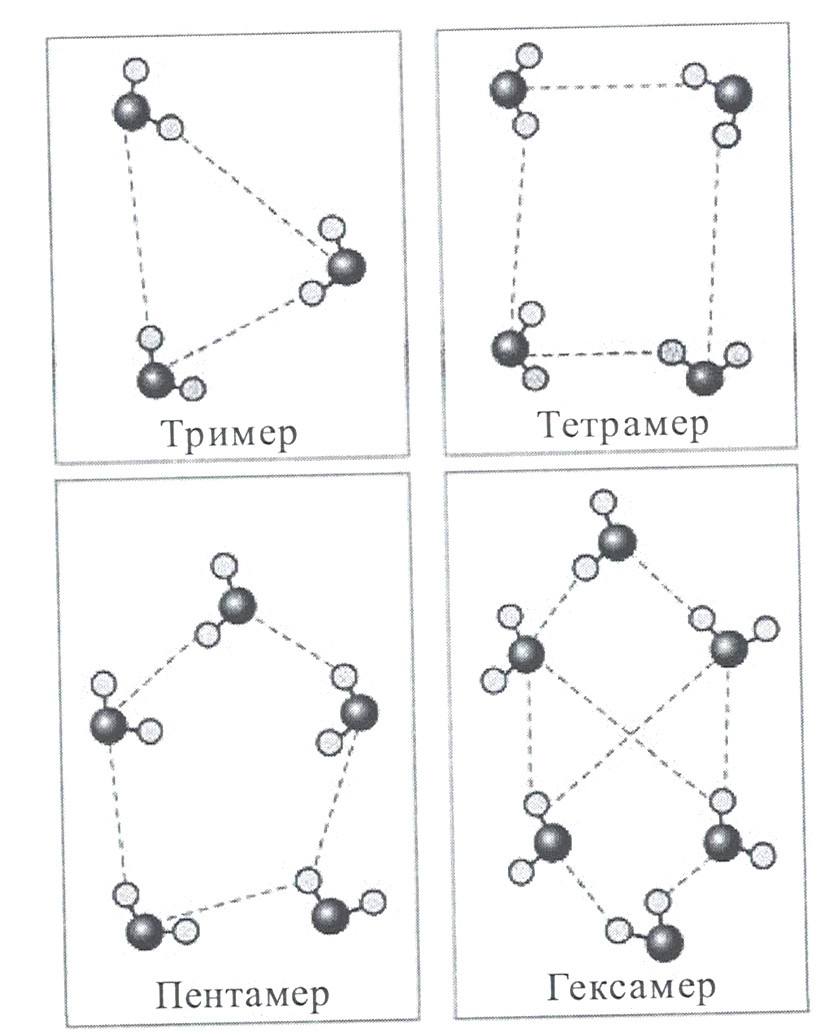
Согласно квантово-химическим расчетам большей устойчивостью обладают линейного «открытого» димера воды, по сравнению с циклическими формами. В случае цикла выгодными являются трех-четырех- и пятичленные образования, в которых водородные связи имеют одинаковое направление. Для шестичленного цикла выгодным становится структура типа «кресло».
Одно из первых изображений формирования циклических кластеров воды приведено на рисунке 9.
Большой вклад в возможность формирования и устойчивость кластеров воды во времени внесли работы Г.А.Домрачева и Д.А. Селивановского. Они доказывали существование механохимических реакций радикальной диссоциации воды. Доказательство основывалось на том, что вода, по их мнению, представляет собой динамически нестабильную полимероподобную систему и по аналогии с механохимическими реакциями в полимерах при механическом воздействии на воду поглощенная водой энергия используется для разрыва химических связей H-OH. Реакция разрыва связи может выглядеть так:
Рассчитав эффективность механодиссоциации воды, авторы пришли к выводу, что кислород на Земле появился при диссоциации воды.
В 1993 г. К.Джордан предложил свои варианты устойчивых «ассоциатов воды», которые состоят из 6 молекул (рисунок 10).
По Джордану кластеры могут объединяться и друг с другом, и со свободными молекулами воды за счет водородных связей, формируя более крупные ассоциаты. Такие кластеры могут объединяться как друг с другом, так и со свободными молекулами воды.
Квантово-химические расчеты нанокластеров с общей формулой (H2O)n с n=6-20 показали, что самые устойчивые структуры образуются посредством взаимодействия тетрамерных и пентамерных кольцевых структур (рисунок 11). На рисунке ниже показаны возможные структуры конформации кластеров воды.
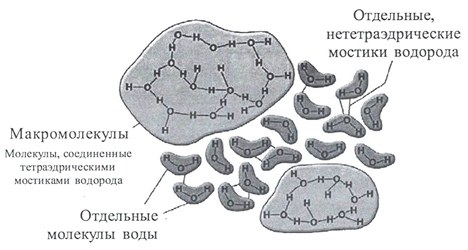
Оригинальной кластерной моделью является теория С.В.Зенина. Согласно модели С.В.Зенина вода представляет собой иерархию геометрически правильных объемных структур «ассоциато». Согласно его теории элементарной структурной ячейкой воды являются тетраэдры, в которых может содержаться 4 (простой тетраэдр) или 5 (объемно-центрированный тетраэдр) молекул воды. При этом у каждой молекулы воды в простых тетраэдрах сохраняется способность образовывать водородные связи, благодаря чему создаются более сложные структуры, как показано на рисунке 13.
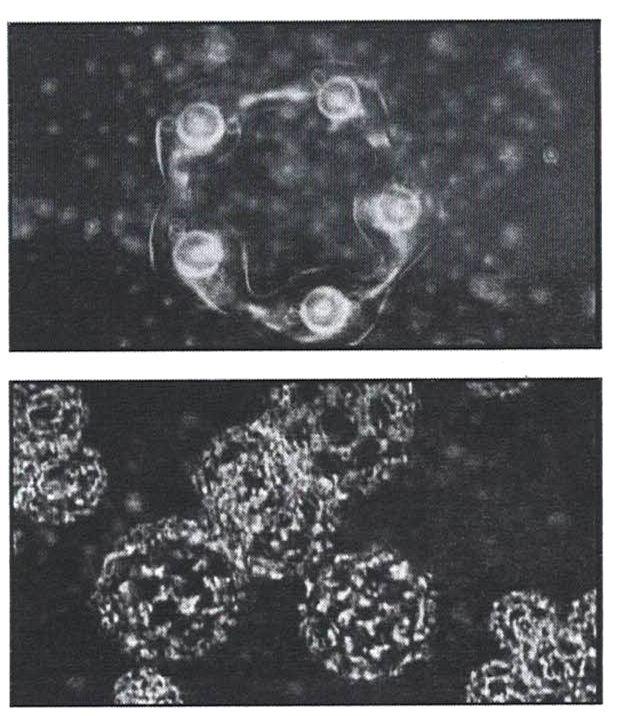
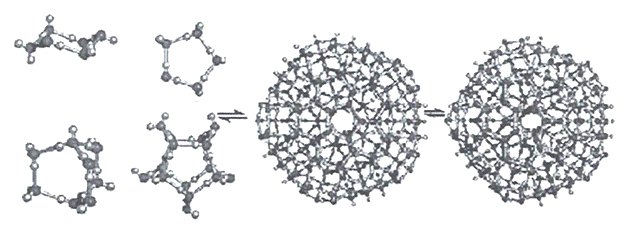
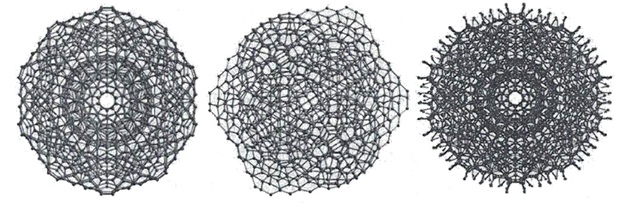
Кластеры, содержащие 20 молекул воды (додэкаэдры) более стабильны. Схема их образования показана на рисунке 14.
Из 57 молекул такого образования 17 составляют гидрофобный каркас с полностью насыщенными связями, а по 10 молекул на поверхности каждого додекаэдра формируют центры образования водородных связей.
Методами жидкостной хроматографии было подтверждено существование пяти- и шестиквантовых структур типа «четырехконечной звезды» и «шестилучевой снежинки».
На уровне 24 центров связывание по водородным связям практически прекращается ввиду того, что поверхность образований становится насыщенной (нейтральной).
Кластеры почти не взаимодействуют между собой, а скользят друг по другу, поэтому вода не отличается высокой вязкостью. В таком «режиме» из кластеров формируются метастабильные структуры, пример которых показан на рисунке 17 (микроизображение в режиме фазового контраста).
Теория Зенина хорошо объясняет электропроводные свойства воды, уменьшение плотности при плавлении, но плохо согласуется с большими значениями коэффициента самодиффузии и малым временем диэлектрической релаксации.
Однако практически существование регулярных матриц в воде маловероятно. Кластеры из 280 молекул также могут формировать цепочки, но с более напряженными водородными связями.
Кластеры могут разрастаться в суперкластеры (гигантские икосаэдры), примеры которых приведены на рисунке 19.
В 2002 Беркли методом рентгеноструктурного анализа показала, что молекулы воды действительно способны образовывать структуры, представляющие собой топологические цепочки и кольца из множества молекул.
А.Н.Смирновым в бидистиллированной воде и некоторых растворах методами акустической эмиссии, лазерной интерферометрии и термического анализа удалось визуализировать надмолекулярные образования с размерами частиц от 1 до 100 мкм, распределенных в водной среде (рисунок 20). Свойства таких частиц были сходны со свойствами частиц, образующих эмульсию, поэтому они были названы «эмулонами».
Размеры и пространственная организация эмулонов зависят от состава водного раствора, температуры и предыстории раствора. Наибольшее число фракций имеют размеры 30, 70 и 100 мкм.
Температурная динамика структуры эмулонов имеет следующие отсечки:
3.2 Клатратная модель строения жидкой воды.
Клатраты в целом (не только вода) делятся на два класса, зависящие от соединения-хозяина. Молекулярные клатраты образуются «хозяевами», имеющими внутримолекуярные полости. Такие клатраты могут существовать как в растворе, так и в кристаллическом состоянии. Если «хозяин» способен образовывать только межмолекулярные или кристаллические полости, то из него получаются решетчатые клатраты (рисунок 21), устойчивые лишь в твердом состоянии.
В поздних модификациях клатратной модели воды допускается образование водородных связей между молекулами в каркасе и молекулами в пустотах. При этом сами молекулы в обеих микрофазах соединены водородными связями.
В заключение отметим, что существует целый ряд воздействий, которые могут приводить к определенному структурированию воды:
Более подробно структурирование воды под воздействием внешних сил будет рассмотрено в отдельной статье.
4. Особенности строения воды в твердом виде. Лед.
• Всего насчитывается около 15 структурных модификаций льда (рисунок 22).
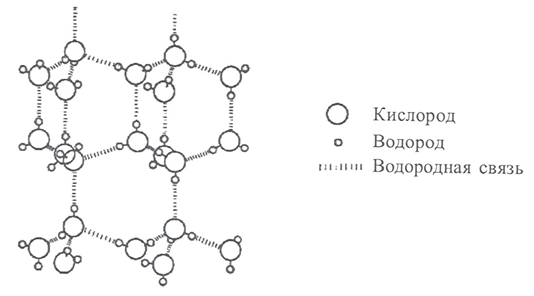
1922 г. У.Г.Брэгг в статье «Кристаллическая структура льда» пытается выяснить причины возможных ошибок при расшифровке положений ядер кислорода. Он убежден, что ни Джон, ни Деннисон не смогли найти истинного расположения ядер кислорода в структуре льда. Брэгг сделал важное замечание: каждый атом кислорода в структуре льда должен быть окружен четырьмя другими. Атом же водорода располагается между двумя кислородами как бусинки на нитке. При этом, что важно, бусинки сдвинуты, смещены, относительно центра льда. Т.е. ядра водорода расположены асимметрично.
Кристаллическая решетка льда называется ажурной (рисунок 23). Паутина связей между молекулами воды во льду содержит много крупных пустот, больших по размеру, чем сами молекулы. Именно поэтому лед более легкий, чем жидкая вода. При плавлении льда водородные связи начинают разрушаться и в пустотах оставшихся ассоциатов поместиться освободившиеся молекулы воды.
• При давлении в 2 ГПа можно получить лед со структурой VI (горячий лед), который не будет плавиться даже при 80 о С.
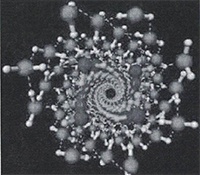
• При очень высоких давлениях внутри нанотрубок с диаметром от 1,35 до 1,90 нм вода может кристаллизоваться в форме двойных спиралей (рисунок 24).
• Современные представления о структуре льда говорят о наличии кластерного строения. Чем ниже температура, тем крупнее кластеры. Наиболее устойчивы кластеры из 8, 12, 24, 36 молекул.
5. Особенности строения воды в газообразном виде. Пар.
В паре водородные связи на 99% разорваны. При этом в нем сохраняется до 1% димеров. Полностью разорвать все связи в паре можно лишь при температура 600 о С.
Расстояние между молекулами во много раз больше самих молекул. При этом сами молекулы хаотично двигаются, сталкиваются со стенками сосуда, в котором заключены, и между собой. Скорость их тем выше, чем выше температура системы.
Вода может длительное время находиться и в перегретом состоянии до 200 о С. При введении пузырька воздуха в такую перегретую воду она мгновенно вскипает и ее температура падает до 100 о С.