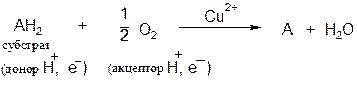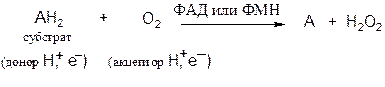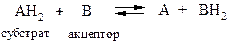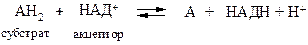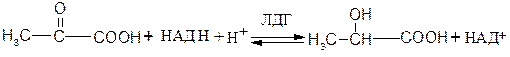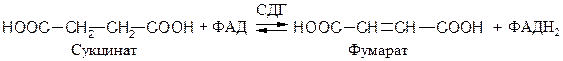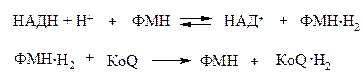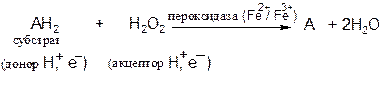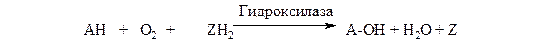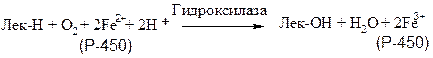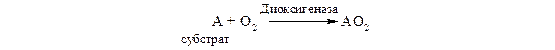какие реакции катализируют ферменты класса оксидоредуктаз
Оксидоредуктазы
Примером подклассов могут служить ферменты, действующие на СН-ОН-группу доноров, на СH-СН-группу доноров, на СН-NН2-группу доноров, на гемсодержащие доноры.
1.1. CH-OH группу доноров;
1.2. альдегидную или кетоновую группу доноров;
1.3. CH-СH группу доноров;
1.4. CH-NH2 группу доноров;
1.5. CH-NН группу доноров;
1.6. НАДH или НАДФН в качестве доноров;
1.8. содержащие серу группы доноров;
1.9. гем-содержащие доноры;
1.10. дифенолы в качестве доноров;
1.11. пероксид водорода в качестве акцептора;
1.11. водород в качестве донора;
1.13. один донор с включением молекулярного кислорода;
1.14. два донора с включением молекулярного кислорода;
1.15. супероксидные радикалы в качестве акцептора;
1.17. СН2 группу доноров;
1.18. ферредоксин в качестве донора;
1.19. флаводоксин в качестве донора;
1.20. фосфор или мышьяк в качестве донора;
1.21. на вещества Х-Н и Y-Н с образованием X-Y-связи;
1.22. галоген в качестве донора;
1.97. другие оксидоредуктазы.
На подподклассы деление производится в зависимости от акцептора – НАД+ или НАДФ+ (1.1.1., 1.2.1., 1.3.1., 1.4.1.), дисульфиды (1.2.4.), кислород (1.3.3.). Например, каталаза (КФ 1.11.1.6), пероксидаза (КФ 1.11.1.7).
Наиболее распространены следующие рабочие названия оксидоредуктаз:
1. Дегидрогеназы – оксидоредуктазы, катализирующие дегидрирование субстрата с использованием в качестве акцептора водорода любых молекул, кроме кислорода.
3. Оксидазы – оксидоредуктазы, катализирующие окисление субстратов с молекулярным кислородом в качестве акцептора электронов без включения кислорода в молекулу субстрата.
4. Монооксигеназы – оксидоредуктазы, катализирующие внедрение одного атома кислорода в молекулу субстрата с молекулярным кислородом в качестве донора кислорода.
5. Диоксигеназы – оксидоредуктазы, катализирующие внедрение 2 атомов кислорода в молекулу субстрата с молекулярным кислородом в качестве донора кислорода.
6. Пероксидазы – оксидоредуктазы, катализирующие реакции с пероксидом водорода в качестве акцептора электронов.
Систематическое название образуется:
Донор электронов : акцептор электронов – оксидоредуктаза.
ОКСИДОРЕДУКТАЗЫ
Субстраты, к-рые окисляются при участии О., рассматриваются как доноры электронов или атомов водорода. Систематическое название О. согласно классификации, предложенной Международным биохимическим союзом и Международной комиссией по ферментам, составляется по схеме «донор водорода : акцептор электронов оксидоредуктаза».
Класс О. пока включает 21 подкласс. К подклассу 1 класса оксидоредуктаз (КФ 1.1) относят ферменты, действующие на группу СН—ОН донора; к подклассу 2 (КФ 1. 2) относят ферменты, действующие на альдегидную или кето-группы донора; к подклассу 3 (КФ 1. 3) относят ферменты, действующие на группу —CH—CH донора; к подклассу 4 (КФ 1.4) — ферменты, действующие на CH—NH2 группу донора; к подклассу 5 (КФ 1. 5) — ферменты, действующие на C—NH группу донора, и т. д.
Третья цифра классификационного шифра фермента класса О. (подподкласс) указывает на тип акцептора электронов: 1 — НАД или НАДФ, 2 — цитохром, 3 — молекулярный кислород, 4 — дисульфид, 5 — хинон и т. д. Четвертая цифра классификационного шифра обозначает порядковый номер конкретного фермента в подподклассе.
Помимо систематического названия О. имеют тривиальные названия. Термин «дегидрогеназы» используют в тех случаях, когда акцептором атомов водорода от донора являются любые молекулы, кроме кислорода.
Термин «оксидазы» применяют в тех случаях, когда акцептором электронов является молекула кислорода (см. Оксидазы).
В качестве примеров в таблице приведены систематические и тривиальные названия нек-рых НАД (НАДФ)-зависимых дегидрогеназ, активность и изоферментный спектр к-рых используются в клин, практике в качестве дополнительного диагностического теста.
В зависимости от природы кофактора О. можно разделить на три группы: 1) НАД- или НАДФ-зави-симые дегидрогеназы; 2) флавин-зависимые дегидрогеназы и оксидазы, в молекуле к-рых роль простетической группы играют ФАД или фла-винмононуклеотид (ФМН); 3) Цитохромы, содержащие железопорфири-новую кольцевую систему в качестве простетической группы.
Различные НАД(НАДФ)-зависимые дегидрогеназы обычно легко диссоциируют на белок и простетическую группу (кофермент) и находятся в динамическом равновесии с растворенной частью НАД или НАДФ. Это обеспечивает сопряженное действие различных дегидрогеназ. Так, простетическая группа одной дегидрогеназы, восстанавливаясь в комплексе с молекулой фермента, может перейти в р-р и, ассоциируясь с другими дегидрогеназами, может в комплексе с ними восстанавливать (гидрировать) молекулы различных акцепторов (см.Окисление биологическое).
Измерение скорости ферментативной реакции, катализируемой НАД(Ф)-зависимыми дегидрогеназами, основано на измерении интенсивности поглощения при 340 нм, к-рая повышается в процессе восстановления НАД или НАДФ, или на измерении величины pH, изменение к-рой связано с освобождением протона, сопровождающим восстановление НАД+ или НАДФ+, либо на измерении флюоресценции, поскольку окисленные формы НАД и НАДФ в отличие от их восстановленных форм характеризуются сильной флюоресценцией в области 440 нм. Восстановленные формы НАД(Ф)-зави-симых дегидрогеназ не окисляются молекулярным кислородом. Перенос ими водорода на соответствующие акцепторы происходит в анаэробных условиях. Как правило, за начальной стадией анаэробного окисления субстрата следует реакция аэробного окисления восстановленного НАД (НАДФ) с участием системы флавино-вых ферментов и цитохромов (см. Дыхательные ферменты).
Наиболее важную роль из флавин-зависимых дегидрогеназ играют НАД(Ф)•Н-дегидрогеназа, сукцинатдегидрогеназа и дигидролипоил-дегидрогеназа, входящая в состав пируватдегидрогеназного и альфа-кетоглутаратдегидрогеназного комплексов. Нек-рые флавиновые О. содержат также, помимо ФАД и ФМН, катионы металлов. Напр., сукцинат-дегидрогеназа, помимо ФАД, содержит комплексно связанное железо. Для флавинзависимых дегидрогеназ характерны широкие спектры поглощения при 370 и 450 нм. При ферментативном или хим. восстановлении максимум поглощения в области 450 нм исчезает. Окислительно-восстановительный процесс, катализируемый флавинзависимыми дегидрогеназами, сопровождается также характерными изменениями в спектре флюоресценции, к-рые используют при определении активности флавин-зависимых дегидрогеназ.
Цитохромная система представлена различными цитохромами (см.), различающимися между собой спектрами поглощения восстановленной и окисленной форм и величиной окислительно-восстановительного потенциала. У млекопитающих в митохондриях найдены Цитохромы b, c, c1, a3 и в микросомах — цитохром b5. Последний цитохром дыхательной цепи, цитохром а3, реагирующий с кислородом, называется цитохром-оксидазой.
При ряде патол, состояний наблюдают изменение активности и изоферментного спектра нек-рых НАД(Ф)-зависимых дегидрогеназ. Так, при нек-рых заболеваниях печени (напр., при остром инф. гепатите) в сыворотке крови в разгаре болезни резко повышена активность лактатдегидрогеназы (см.) и алкогольдегидрогеназы (см.), а в более поздние сроки — активность глутаматдегидрогеназы. При остром инфекционном гепатите, а также при злокачественных новообразованиях наблюдают изменение изоферментного спектра нек-рых дегидрогеназ, в т. ч. появление аномальных молекулярных форм фермента. Определение активности и изоферментного состава лактатдегидрогеназы в сыворотке крови является важным тестом при дифференциальной диагностике инфаркта миокарда и наблюдении за его течением (см. Инфаркт миокарда). Генетически обусловленная гемолитическая анемия (см.) характеризуется снижением активности в эритроцитах одной из оксидоредуктаз — НАДФ-зависимой глюкозо-6-фосфатдегидрогеназы (КФ 1. 1. 1. 49), что вызывает уменьшение образования АТФ в эритроцитах, задержку ионов Na + и связанной с ними воды, набухание и гемолиз эритроцитов. При полном отсутствии активности этого фермента гемолитическая анемия проявляется спонтанно уже в детском возрасте. Причиной гемолитической анемии может быть также врожденная недостаточность или полное отсутствие активности еще одной О.— глутатионредуктазы (КФ 1. 6. 4. 2), вызывающие патологическое снижение концентрации глутатиона в эритроцитах.
Таблица. СИСТЕМАТИЧЕСКИЕ И ТРИВИАЛЬНЫЕ НАЗВАНИЯ НЕКОТОРЫХ ДЕГИДРОГЕНАЗ, ИСПОЛЬЗУЮЩИХ В КАЧЕСТВЕ КОФЕРМЕНТОВ НАД ИЛИ НАДФ, И КАТАЛИЗИРУЕМЫЕ ИМИ РЕАКЦИИ
Оксидоредуктазы



КЛАССИФИКАЦИЯ И НОМЕНКЛАТУРА ФЕРМЕНТОВ
Современная классификация ферментов разработана Международным биохимическим союзом (1961г.). В ее основу положен тип катализируемой реакции и механизм. Все ферменты делят на шесть классов: I. Оксидоредуктазы. II. Трансферазы. III. Гидролазы. IV. Лиазы. V. Изомеразы. VI. Лигазы.
Каждый фермент имеет кодовый номер по классификации ферментов: первая цифра характеризует класс реакции, вторая − подкласс, третья − подподкласс, четвертая цифра указывает порядковый номер фермента в его подподклассе. Название фермента состоит из двух частей: в первой части − название субстрата (или субстратов), во второй − тип катализируемой реакции.
Оксидоредуктазы
Оксидоредуктазы катализируют окислительно-восстановительные реакции и подразделяются на 5 основных подклассов:
Оксидазы. Катализируют удаление водорода из субстрата, используя при этом в качестве акцептора водорода только кислород. Оксидазы содержат медь, продуктом реакции является вода (исключение составляют реакции, катализируемые уриказой и моноаминоксидазой, в результате которых образуется Н2О2).
Общая схема процесса следующая:
В качестве субстратов оксидаз могут выступать фенолы, полифенолы, амины. Примерами ферментов класса оксидаз являются фенолаза, цитохром-оксидаза, моноаминоксидаза, уриказа.
Фенолаза (катехолоксидаза, тирозиназа) − медьсодержащий фермент с широкой специфичностью. Он катализирует превращение монофенола
(в присутствии о-дифенола) в орто-хинон. Медь содержится также в уриказе, катализирующей окисление мочевой кислоты в аллантоин, и в моноаминоксидазе, окисляющей адреналин и тирамин в митохондриях.
Цитохромоксидаза − гемопротеин, который служит конечным компонентом дыхательной цепи и осуществляет перенос электронов на конечный акцептор − кислород. Данный фермент ингибируется оксидом углерода (II), цианидами и сероводородом. Фермент содержит две молекулы гема, в каждой из которых атом железа может переходить из состояния Fe 2+ в состояние Fe 3+ и обратно в ходе окисления и восстановления, а также два атома Сu, каждый из которых взаимодействует с одним из гемов.
Аэробные дегидрогеназы. Катализируют удаление водорода из суб-страта, используя в качестве акцептора водорода не только кислород, но и искусственные акцепторы (например, метиленовый синий). Эти дегидрогеназы относятся к флавопротеинам.
В результате реакции образуется пероксид водорода, а не вода:
В качестве кофермента дегидрогеназы содержат ФАД (флавинаденин-динуклеотид) или ФМН (флавинмононуклеотид). Многие флавопротеиновые ферменты содержат несколько ионов металлов.
К ферментам группы аэробных дегидрогеназ относятся: дегидрогеназа L-аминокислот (оксидаза L-аминокислот), катализирующая окислительное дезаминирование природных L-аминокислот, и ксантиндегидрогеназа (ксантиноксидаза), катализирующая окисление ксантина в мочевую кислоту. Молибденсодержащий фермент ксантиноксидаза играет важную роль в катаболизме пуриновых оснований.
Анаэробные дегидрогеназы. Катализируют удаление водорода из субстрата, но не способны использовать кислород в качестве акцептора.
Общая схема процесса следующая:
Анаэробные дегидрогеназы подразделяются в зависимости от природы кофермента на несколько групп.
Общая схема процесса следующая:
ФАД- и ФМН- зависимые анаэробные дегидрогеназы (флавин-зависимые дегидрогеназы). Первичные флавинзависимые дегидрогеназы переносят восстановительные эквиваленты от субстрата непосредственно на дыхательную цепь. К ним относятся, например, 1.3.99.1 сукцинатдегидрогеназа (СДГ), ацил-КоА-дегидрогеназа и митохондриальная глицерол-3-фосфат-дегидрогеназа:
Вторичная ФМН-зависимая НАДН-дегидрогеназа − компонент дыхательной цепи, переносящий электроны от НАДН к более электроположительным компонентам:
Еще одна функция флавинзависимых дегидрогеназ − катализируемое дигидролипоилдегидрогеназой дегидрирование восстановленного липоата
(промежуточного продукта при окислительном декарбоксилировании пирувата и a-кетоглутарата). При этом вследствие низкого значения окислительно-восстановительного потенциала системы липоата переносчиком водорода от восстановленного липоата к НАД + является флавопротеин (ФАД).
Цитохромы за исключением цитохромоксидазы классифицируются как анаэробные дегидрогеназы. В дыхательной цепи они служат переносчиками электронов от флавопротеинов к цитохромоксидазе. Цитохромы являются гемопротеинами, у которых атом железа переходит из состояния Fe 2+ в Fe 3+ и обратно в процессе окисления и восстановления. Помимо дыхательной цепи цитохромы имеются в эндоплазматическом ретикулуме (цитохромы Р-450 и b-5).
Гидропероксидазы. К их числу относятся ферменты пероксидаза и каталаза.
Пероксидаза − фермент, катализирующий окисление пероксидом водорода различных органических соединений − фенолов, аминов, аскорбиновой кислоты, цитохрома С. Пероксидаза обнаружена в растениях, молоке, лейкоцитах, тромбоцитах, а также в тканях, в которых происходит метаболизм эйкозаноидов. Фермент содержит протогем, который в отличие от гемовых групп большинства гемопротеинов слабо связан с апоферментом.
Реакция, катализируемая пероксидазой, имеет сложный характер; суммарная реакция выглядит следующим образом:
В эритроцитах глутатионпероксидаза, содержащая в качестве простетической группы селен, катализирует разложение Н2О2 и гидропероксидов липидов восстановленным глутатионом и, таким образом, защищает липиды мембран и гемоглобин от окисления пероксидами.
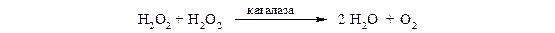 |
Каталаза − это гемопротеин, содержащий 4 гемовые группы. Наряду с пероксидазной активностью каталаза способна использовать одну молекулу Н2О2 в качестве донора электронов, а другую − в качестве акцептора электронов. В организме каталаза в основном разлагает пероксид водорода, образующийся при действии аэробных дегидрогеназ:
Каталаза содержится в крови, костном мозге, мембранах слизистых оболочек, почках и печени.
Во многих тканях, включая и печень, обнаружены микротельца − пероксисомы, которые богаты аэробными дегидрогеназами и каталазой. Биологически выгодно группировать в одном месте как ферменты, приводящие к образованию Н2О2, так и ферменты, разлагающие это соединение.
К ферментам, катализирующим образование Н2О2, кроме пероксисомных ферментов, относятся также митохондриальные и микросомные системы транспорта электронов.
Оксигеназы.
Ферменты этой группы катализируют включение кисло-рода в молекулу субстрата, которое происходит в две стадии:
1) кислород связывается с активным центром фермента;
2) происходит реакция, в результате которой, связанный кислород восстанавливается или переносится на субстрат.
Оксигеназы не относятся к ферментам, которые катализируют реакции, снабжающие клетку энергией; они участвуют в синтезе и деградации многих типов метаболитов, токсинов и ксенобиотиков. Оксигеназы подразделяются на 2 подгруппы.
Монооксигеназы (гидроксилазы). Эти ферменты катализируют включение в субстрат только одного из атомов молекулы кислорода. Другой атом кислорода восстанавливается до воды; для чего необходим дополнительный донор электронов (косубстрат):
Природа косубстрата может быть различной. Многие оксигеназы используют НАДФН2. В этом случае суммарное уравнение реакции можно записать как
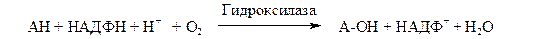
Другой пример подобных систем − митохондриальные цитохром-Р-450-содержащие монооксигеназные системы. Они находятся в коре надпочечников, семенниках, яичниках, плаценте, почках и участвуют в биосинтезе стероидных гормонов из холестерина, катализируют гидроксилирование гидроксихолекальциферола, что приводит к образованию активной формы витамина D3 (1,25-дигидроксихолекальциферола). В коре надпочечников содержание митохондриального цитохрома Р-450 в 6 раз выше, чем содержание цитохромов в дыхательной цепи.
Диоксигеназы (истинные оксигеназы). Эти ферменты катализируют включение в молекулу субстрата обоих атомов молекулы кислорода:
Примером служат железосодержащие ферменты 1.13.11.5 гомогентизатдиоксигеназа и 1.13.11.6 3-гидроксиантранилатдиоксигеназа, а также некоторые гемсодержащие ферменты, в частности триптофандиоксигеназа (триптофанпирролаза).
Параграф 20. 2. Виды оксидоредуктаз
Автор текста – Анисимова Елена Сергеевна.
Авторские права защищены. Продавать текст нельзя.
Курсив не зубрить.
Замечания можно присылать по почте: exam_bch@mail.ru
https://vk.com/bch_5
Параграф учебника по биохимии 20.2
«Виды оксидоредуктаз».
см. п.3.
См. таблицу в файле «20.2 Таблица оксидоредуктазы».
Определение.
Оксидоредуктазы – это класс ферментов, которые катализируют окислительно-восстановительные реакции.
Основные группы (не только подклассы) оксидоредуктаз:
дегидрогеназы, оксидазы, оксигеназы,
редуктазы, цитохромы и антиокислительные ферменты.
Что такое окисление и восстановление.
Окисление – это отщепление электрона,
а восстановление – это присоединение электрона.
Окисление и восстановления всегда сопряжены, то есть связаны,
потому что если одно вещество теряет электрон
и при этом окисляется,
то другое вещество этот электрон приобретает
и при этом восстанавливается.
При восстановлении органических субстратов
электроны часто присоединяются в составе атомов водорода
(каждый из которых состоит из одного электрона и одного протона),
источником которых является НАДФН,
который получает атомы водорода в ПФП (п.35).
При окислении органических субстратов
электроны отщепляются обычно в составе атомов водорода,
которые переносятся на кофермент (НАД и др.) или кислород.
Присоединение атомов кислорода
тоже является окислением органического субстрата,
поскольку присоединившиеся атомы кислорода притягивают к себе электронную плотность тех атомов, в которым они присоединились.
1. Д Е Г И Д Р О Г Е Н А З Ы
катализируют реакции дегидрирования,
то есть отщепления атомов водорода (Н).
При этом водород
(2 атома водорода, состоящие из 2 протонов и 2 электронов)
отщепляется от органического субстрата (R)
и переносится на кофермент (на КоФ – НАД+, ФАД или НАДФ+).
Формулируя короче – дегидрогеназы переносят 2 атома водорода
от субстрата на кофермент.
Субстрат до отщепления от него пары атомов водорода
называется восстановленным субстратом
и обозначается так – RН2;
где Н – это атомы водорода, которые будут отщепляться,
а R – это остальные атомы молекулы субстрата.
Субстрат после отщепления от него пары атомов водорода
обозначается так – R
и называется окисленным.
Кофермент, получающий атомы водорода,
до их присоединения обозначается как КоФ,
а после присоединения двух Н обозначается как КоФН2.
Поскольку при отщеплении атомов водорода
вещество теряет вместе с водородом
входящие в состав водорода электроны,
а потеря электронов называется окислением,
то RН2 – более восстановленное вещество, чем R,
а КоФН2 – более восстановленное вещество, чем КоФ.
Поэтому RН2 называют восстановленным субстратом,
а R – окисленным субстратом.
КоФ2 называют восстановленным коферментом
(восстановленной формой кофермента),
а КоФ – окисленным коферментом
(окисленной формой кофермента).
Схема реакции, которая катализируется дегидрогеназами,
может быть представлена в таком виде:
RH2 + КоФ ; R + КоФН2.
Где RH2 – это восстановленный субстрат
(органический субстрат до отщепления водорода),
КоФ – окисленный кофермент
(кофермент до присоединения к нему отщепленного от субстрата водорода),
R – окисленный субстрат
(органический субстрат после отщепления от него водорода),
КоФН2 – восстановленный кофермент
(кофермент после присоединения к нему отщепленного от субстрата водорода).
Коферменты, которые участвуют в работе дегидрогеназ:
НАД+, ФАД и НАДФ+.
НАД+, ФАД и НАДФ+ – это обозначения окисленных форм коферментов,
а НАДН,Н+, ФАДН2 и НАДФН,Н+ – это обозначения восстановленных форм коферментов.
НАДН, Н+ и ФАДН2 переносят водород
от субстратов в ДЦ (для выработки АТФ),
а НАДФН, Н+ переносит водород от метаболитов ПФП не в ДЦ,
а в реакции,
катализируемые редуктазами и гидроксилазами.
Дегидрогеназы катализируют реакции
процессов окислительного катаболизма.
См. п.32, 45, 65.
2. О К С И Д А З Ы
катализируют дегидрирование,
при котором водород, отщепленный от субстрата, присоединяется к кислороду (О2).
Формулируя короче – дегидрогеназы переносят 2 атома водорода
от субстрата на кислород.
Схема реакции, которая катализируется оксидазами,
может быть представлена в таком виде:
RH2 + О2 ; R + Н2О2.
Где RH2 – это восстановленный субстрат,
R – окисленный субстрат
(органический субстрат после отщепления от него водорода).
Кислород в результате этой реакции восстанавливается.
Для работы оксидоредуктаз нужен кофермент ФАД
и витамин В2 в составе ФАД.
Основные примеры оксидаз –
это ксантин/оксидаза (КсО) в п.71
и моноамин/оксидаза (МАО) в п.105.
КсО участвует в катаболизме пуринов
(аденина и гуанина,
но субстраты КсО – гипоксантин и ксантин;
под действием КсО гипоксантин превращается в ксантин,
а ксантин – в мочевую кислоту).
МАО участвует в окислении аминов (адреналина, например).
Ингибиторы КсО применяются для снижения выработки уратов (см. гипер/урикемии),
а ингибиторы МАО применяются в качестве антидепрессантов.
Оксидазы участвуют в реакциях свободного окисления – п.26.
Сходство и отличия дегидрогеназ и оксидаз:
сходство в том, что катализируют отщепление водорода (дегидрирование),
отличия в том, что
дегидрогеназы переносят отщеплённый от субстратов водород на коферменты,
а оксидазы – на кислород (окси).
3. О К С И Г Е Н А З Ы
катализируют включение в молекулу органического субстрата
атомов кислорода, источником которых является О2.
Атомы кислорода включаются
между атомом водорода органического субстрата
и атомом углерода субстрата,
поэтому молекула органического субстрата
до включения в нее атомов кислорода оксигеназами обозначается так – RН,
а после включения атомов кислорода –
либо R-О-О-Н (если включены оба атома О2),
либо R-О-Н (если включен один атом О2).
3.1). Оксигеназы, которые включают в молекулу субстрата
оба атома кислорода,
называются ДИоксигеназами;
схему реакции можно записать так:
Продукт реакции (R-О-О-Н)
называется органической перекисью.
RООН – более окисленное вещество, чем RН,
то есть окисляется органический субстрат,
а восстанавливается кислород.
3.2). Оксигеназы, которые включают в молекулу органического субстрата
только один атом кислорода,
называются МОНОоксигеназами или гидроксилазами.
Второй атом кислорода молекулы кислорода
соединяется с двумя атомами водорода, образуя молекулу воды;
источником атомов водорода в этом случае является кофермент –
либо НАДФН, либо аскорбат.
Схему реакции можно записать так:
RH + О2 + КоФН2 ; R-О-Н + КоФ + Н2О.
RН – это субстрат, в который должен включиться атом кислорода,
R-О-Н – это субстрат со включенным в него атомом кислорода,
О2 – это источник атомов кислорода,
КоФН2 – это источник атомов водорода.
Субстрат RН – более восстановленный по сравнению с RОН.
В реакции окисляются RН и КоФН2,
а восстанавливается кислород.
-ОН – это спиртовая (гидроксильная) группа,
а RОН – это спирт.
Из-за того, что при действии монооксигеназ
образуется гидроксильная группа,
у них есть синоним – гидроксилазы. (Не путать с гидролазами.)
Нужно уметь написать реакции,
которые катализируют фенилаланин/гидроксилаза
и тирозин/гидроксилаза (п.105 и 68).
И знать значение этих реакций.
Оксигеназы (как и оксигеназы),
участвуют в процессах свободного окисления.
Участвуют в метаболизме ксенобиотиков,
в обмене многих гормонов,
в образовании коллагена.
4. Р Е Д У К Т А З Ы
катализируют присоединение водорода
к органическому субстрату,
при этом источником атомов водорода является НАДФН.
Другой вариант определения –
редуктазы катализируют перенос водорода
от кофермента на органический субстрат.
Действие редуктаз противоположно действию дегидрогеназ.
При получении водорода субстрат восстанавливается,
поэтому редуктазы можно считать восстановителями субстратов.
Схема реакций, которые катализируются редуктазами:
R + КоФН2 ; R + КоФН2.
Здесь R – органический субстрат до присоединения водорода,
RН2 – органический субстрат после присоединения к нему атомов водорода,
КоФ2 – восстановленная форма кофермента (источник водорода),
КоФ – окисленная форма кофермента.
В этой реакции органический субстрат восстанавливается (приобретает водород),
а кофермент окисляется (теряет водород).
Редуктазы – основные ферменты восстановительных синтезов –
например, синтеза жирных кислот,
синтеза холестерина (ГМГ-КоА/редуктаза),
синтеза дезокси/рибонуклеотидов (рибонуклеотид/редуктаза).
А глутатион/редуктаза относится к антиокислительным ферментам – п.27.
5. Ц И Т О Х Р О М Ы
участвуют в реакциях изменения валентности металлов –
например, в присоединении электрона к иону железа Fe3+.
В результате ион железа Fe3+превращается в ион железа Fe2+
(восстановление иона железа).
Схема реакции: Fe3+ + е ; Fe2+.
Почему (3+) превращается в (2+) при присоединении электрона – потому что у электрона отрицательный заряд.
Получается (3+) + (1-) = (2+).)
В каких процессах встречаются цитохромы –
цитохромы катализируют ряд реакций дыхательной цепи – п.22;
нужно также помнить цитохром Р 450 – п.118.
См. п.27.
Это ферменты, которые участвуют в разрушении активных форм кислорода
и восстановлении окисленных ими веществ клетки
(органических перекисей).
Относятся к антиокислительной системе организма,
к которой также относятся низкомолекулярные антиоксиданты
(витамины А, Е, С и другие).
Благодаря этой системе организм дольше сохраняет молодость
и дольше не появляются такие болезни, как атеросклероз, катаракта и т.д..
Подробнее об антиокислительных ферментах сказано в ответе на вопрос № 27.
Примеры антиокислительных ферментов –
супероксид/дисмутаза,
глутатион/пероксидаза, глутатион/трансфераза,
глутатион/редуктаза, каталаза.
Реакции, катализируемые оксидоредуктазами,
можно разделить на группы –
к одной группе относятся оксидоредуктазы,
которые катализируют восстановление органических субстратов
(редуктазы = восстановители),
а к другой – оксидоредуктазы, которые катализируют
окисление органических субстратов (все, кроме редуктаз).
Оксидоредуктазы, которые катализируют реакции окисления органических субстратов,
можно разделить на три группы:
1) катализирующие отщепление водорода
(дегидрирование) дегидрогеназы и оксидазы,
2) катализирующие присоединение кислорода
(оксигенацию) оксигеназы,
3) катализирующие изменение валентности металлов цитохромы.
Как определить, какая форма субстрата более восстановленная,
а какая – более окисленная:
чем больше водорода в веществе,
тем более восстановлено вещество;
чем больше кислорода в веществе,
тем более окисленное вещество.