какие реакции наиболее характерны для алкенов
Алкены
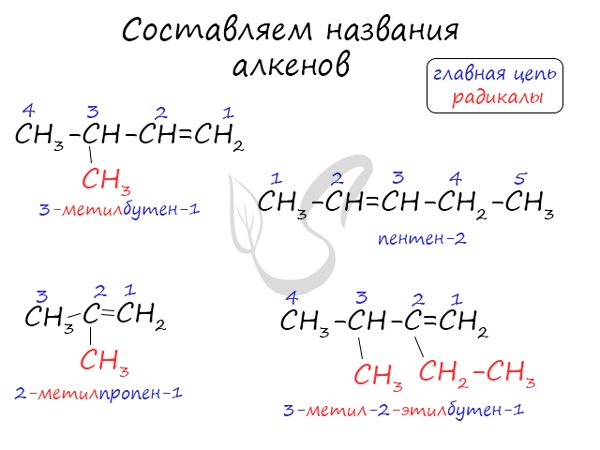
Номенклатура и изомерия алкенов
Названия алкенов формируются путем добавления суффикса «ен» к названию алкана с соответствующим числом: этен, пропен, бутен, пентен и т.д.
При составлении названия алкена важно учесть, что главная цепь атомов углерода должна обязательно содержать двойную связь. Принято начинать нумерацию атомов углерода с того края, к которому ближе двойная связь. В конце названия указывают атом углерода, у которого начинается двойная связь.
Атомы углерода, прилежащие к двойной связи находятся в sp 2 гибридизации.
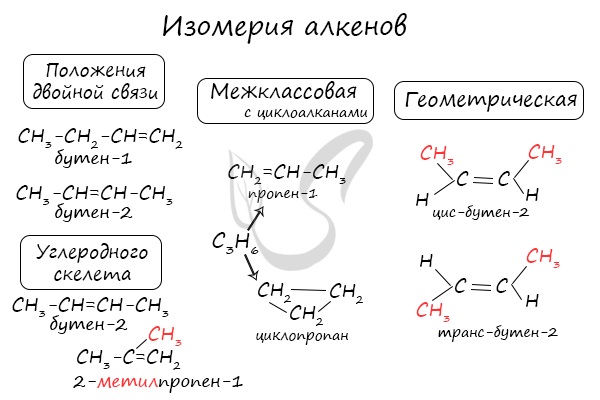
Для алкенов характерна изомерия углеродного скелета, положения двойной связи, межклассовая изомерия с циклоалканами и пространственная геометрическая изомерия в виде существования цис- и транс-изомеров.
Получение алкенов
В результате крекинга нефти образуется один алкан и один алкен.
В реакции галогеналкана со спиртовым(!) раствором щелочи образуется алкен. По правилу Зайцева, водород отщепляется от соседнего наименее гидрированного атома углерода.
Внутримолекулярная дегидратация спиртов происходит при t > 140 °C.
Химические свойства алкенов
Водород присоединяется к атомам углерода, образующим двойную связь. Пи-связь (π-связь) рвется, остается единичная сигма-связь (σ-связь).
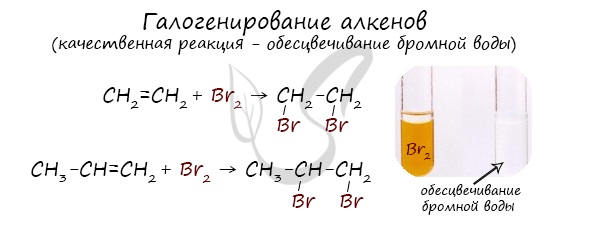
Реакция с бромной водой является качественной для непредельных соединений, содержащих двойные (и тройные) связи. В ходе такой реакции бромная вода обесцвечивается, что указывает на присоединение его по кратным связям к органическому веществу.
Реакция с хлором на свету протекает по свободнорадикальному механизму, так как на свету молекулы хлора расщепляются, образуя свободные радикалы.
Алкены вступают в реакции гидрогалогенирования, протекающие по типу присоединения.
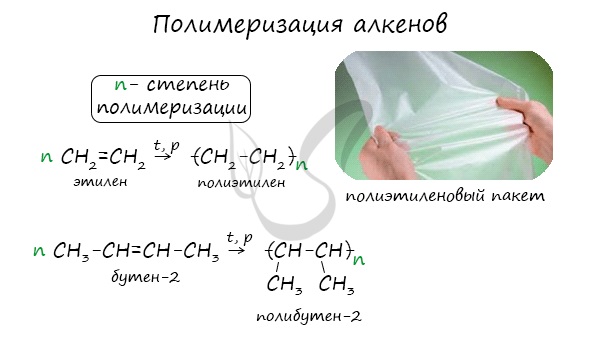
Индекс «n», степень полимеризации, обозначает число мономерных звеньев, которые входят в состав полимера.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Химические свойства алкенов
Алкены – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствует одна двойная связь между атомами углерода С=С.
Наличие двойной связи между атомами углерода очень сильно меняет свойства углеводородов.
Химические свойства алкенов
Алкены – непредельные углеводороды, в молекулах которых есть одна двойная связь. Строение и свойства двойной связи определяют характерные химические свойства алкенов.
Двойная связь состоит из σ-связи и π-связи. Рассмотрим характеристики одинарной связи С-С и двойной связи С=С:
| Энергия связи, кДж/моль | Длина связи, нм | |
| С-С | 348 | 0,154 |
| С=С | 620 | 0,133 |
Можно примерно оценить энергию π-связи в составе двойной связи С=С:
Таким образом, π-связь — менее прочная, чем σ-связь. Поэтому алкены вступают в реакции присоединения, сопровождающиеся разрывом π-связи. Присоединение к алкенам может протекать по ионному и радикальному механизмам.
Для алкенов также характерны реакции окисления и изомеризации. Окисление алкенов протекает преимущественно по двойной связи, хотя возможно и жесткое окисление (горение).
1. Реакции присоединения
Для алкенов характерны реакции присоединения по двойной связи С=С, при которых протекает разрыв пи-связи в молекуле алкена.
1.1. Гидрирование
Алкены реагируют с водородом при нагревании и под давлением в присутствии металлических катализаторов (Ni, Pt, Pd и др.).
| Например, при гидрировании бутена-2 образуется бутан. |
| Реакция протекает обратимо. Для смещения равновесия в сторону образования бутана используют повышенное давление. |
1.2. Галогенирование алкенов
Присоединение галогенов к алкенам происходит даже при комнатной температуре в растворе (растворители — вода, CCl4).
| При взаимодействии с алкенами красно-бурый раствор брома в воде (бромная вода) обесцвечивается. Это качественная реакция на двойную связь. |
| Например, при бромировании пропилена образуется 1,2-дибромпропан, а при хлорировании — 1,2-дихлорпропан. |
Реакции протекают в присутствии полярных растворителей по ионному (электрофильному) механизму.
1.3. Гидрогалогенирование алкенов
Алкены присоединяют галогеноводороды. Реакция идет по механизму электрофильного присоединения с образованием галогенопроизводного алкана.
| Например, при взаимодействии этилена с бромоводородом образуется бромэтан. |
При присоединении полярных молекул к несимметричным алкенам образуется смесь изомеров. При этом выполняется правило Марковникова.
| Правило Марковникова: при присоединении полярных молекул типа НХ к несимметричным алкенам водород преимущественно присоединяется к наиболее гидрогенизированному атому углерода при двойной связи. |
| Например, при присоединении хлороводорода HCl к пропилену атом водорода преимущественно присоединяется к атому углерода группы СН2=, поэтому преимущественно образуется 2-хлорпропан. |
1.4. Гидратация
Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
| Например, при взаимодействии этилена с водой образуется этиловый спирт. |
Гидратация алкенов также протекает по ионному (электрофильному) механизму.
Для несимметричных алкенов реакция идёт преимущественно по правилу Марковникова.
| Например, при взаимодействии пропилена с водой образуется преимущественно пропанол-2. |
1.5. Полимеризация
Полимеризация — это процесс многократного соединения молекул низкомолекулярного вещества (мономера) друг с другом с образованием высокомолекулярного вещества (полимера).
nM → Mn (M – это молекула мономера)
| Например, при полимеризации этилена образуется полиэтилен, а при полимеризации пропилена — полипропилен. |
2. Окисление алкенов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
2.1. Каталитическое окисление
Каталитическое окисление протекает под действием катализатора.
| Взаимодействие этилена с кислородом в присутствии солей палладия протекает с образованием этаналя (уксусного альдегида) |
| Взаимодействие этилена с кислородом в присутствии серебра протекает с образованием эпоксида |
2.2. Мягкое окисление
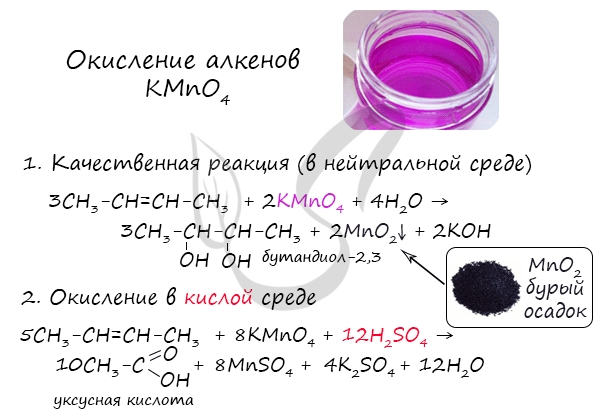
Мягкое окисление протекает при низкой температуре в присутствии перманганата калия. При этом раствор перманганата обесцвечивается.
В молекуле алкена разрывается только π-связь и окисляется каждый атом углерода при двойной связи.
При этом образуются двухатомные спирты (диолы).
| Например, этилен реагирует с водным раствором перманганата калия при низкой температуре с образованием этиленгликоля (этандиол-1,2) |
2.2. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) происходит полный разрыв двойной связи С=С и связей С-Н у атомов углерода при двойной связи. При этом вместо разрывающихся связей образуются связи с кислородом.
Так, если у атома углерода окисляется одна связь, то образуется группа С-О-Н (спирт). При окислении двух связей образуется двойная связь с атомом углерода: С=О, при окислении трех связей — карбоксильная группа СООН, четырех — углекислый газ СО2.
Поэтому можно составить таблицу соответствия окисляемого фрагмента молекулы и продукта:
| Окисляемый фрагмент | KMnO4, кислая среда | KMnO4, H2O, t |
| >C= | >C=O | >C=O |
| -CH= | -COOH | -COOK |
| CH2= | CO2 | K2CO3 |
При окислении бутена-2 перманганатом калия в среде серной кислоты окислению подвергаются два фрагмента –CH=, поэтому образуется уксусная кислота:
При окислении метилпропена перманганатом калия в присутствии серной кислоты окислению подвергаются фрагменты >C= и CH2=, поэтому образуются углекислый газ и кетон:
При жестком окислении алкенов в нейтральной среде образующаяся щелочь реагирует с продуктами реакции окисления алкена, поэтому образуются соли (кроме реакций, где получается кетон — кетон со щелочью не реагирует).
| Например, при окислении бутена-2 перманганатом калия в воде при нагревании окислению подвергаются два фрагмента –CH=, поэтому образуется соль уксусной кислоты – ацетат калия: |
| Например, при окислении метилпропена перманганатом калия в воде при нагревании окислению подвергаются фрагменты >C= и CH2=, поэтому образуются карбонат калия и кетон: |
Взаимодействие алкенов с хроматами или дихроматами протекает с образованием аналогичных продуктов окисления.
2.3. Горение алкенов
Алкены, как и прочие углеводороды, горят в присутствии кислорода с образованием углекислого газа и воды.
В общем виде уравнение сгорания алкенов выглядит так:
| Например, уравнение сгорания пропилена: |
3. Замещение в боковой цепи
Алкены с углеродной цепью, содержащей более двух атомов углерода, могут вступать в реакции замещения в боковой цепи, как алканы.
При взаимодействии алкенов с хлором или бромом при нагревании до 500 о С или на свету происходит не присоединение, а радикальное замещение атомов водорода в боковой цепи. При этом хлорируется атом углерода, ближайший к двойной связи.
| Например, при хлорировании пропилена на свету образуется 3-хлорпропен-1 |
4. Изомеризация алкенов
При нагревании в присутствии катализаторов (Al2O3) алкены вступают в реакцию изомеризации. При этом происходит либо перемещение двойной связи, либо изменение углеродного скелета. При изомеризации из менее устойчивых алкенов образуются более устойчивые. Как правило, двойная связь перемещается в центр молекулы.
Какие реакции наиболее характерны для алкенов
По какому механизму идут реакции присоединения к алкенам?
1. За счет электронов π-связи в молекулах алкенов имеется область повышенной электронной плотности (облако π-электронов над и под плоскостью молекулы):
Поэтому двойная связь склонна подвергаться атаке электрофильным (электронодефицитным) реагентом. В этом случае будет происходить гетеролический разрыв π-связи и реакция пойдет по ионному механизму как электрофильное присоединение.
Механизм электрофильного присоединения обозначается символом АdЕ
(по первым буквам английских терминов: Ad – addition [присоединение],
2. С другой стороны, углерод-углеродная π-связь, являясь неполярной, может разрываться гомолитически, и тогда реакция будет идти по радикальному механизму.
Механизм радикального присоединения обозначается символом АdR
Механизм присоединения зависит от условий проведения реакции.
Кроме того, алкенам свойственны реакции изомеризации и окисления (в том числе реакция горения, характерная для всех углеводородов).
Реакции присоединения к алкенам
Алкены вступают в разнообразные реакции присоединения.
1. Гидрирование (присоединение водорода)
Алкены взаимодействуют с водородом при нагревании и повышенном давлении в присутствии катализаторов (Pt, Pd, Ni и др.) с образованием алканов:
Присоединение водорода к атомам углерода в алкенах приводит к понижению степени их окисления:
Поэтому гидрирование алкенов относят к реакциям восстановления. Эта реакция используется в промышленности для получения высокооктанового топлива.
2. Галогенирование (присоединение галогенов)
Присоединение галогенов по двойной связи С=С происходит легко в обычных условиях (при комнатной температуре, без катализатора). Например, быстрое обесцвечивание красно-бурой окраски раствора брома в воде (бромной воды) служит качественной реакцией на наличие двойной связи:
Еще легче происходит присоединение хлора:
Эти реакции протекают по механизму электрофильного присоединения с гетеролитическим разрывом связей в молекуле галогена.
При нагревании до 500 °С возможно радикальное замеще ние атома водорода при соседнем к двойной связи атоме углерода:
3. Гидрогалогенирование (присоединение галогеноводородов)
Направление реакции присоединения галогеноводородов к алкенам несимметричного строения (например, к пропилену CH2=CH–СН3 ) определяется правилом Марковникова :
Так, в реакции HCl c пропиленом из двух возможных структурных изомеров 1-хлорпропана и 2-хлорпропана, образуется последний:
Эта закономерность была первоначально установлена эмпирически. В современной органической химии дано теоретическое обоснование правила Марковникова на основе положения о влиянии электронного строения молекул на их реакционную способность.
Следует отметить, что правило Марковникова в его классической формулировке соблюдается только для электрофильных реакций самих алкенов. В случае некоторых производных алкенов или при изменении механизма реакции идут против правила Марковникова.
4. Гидратация (присоединение воды)
Гидратация происходит в присутствии минеральных кислот по механизму электрофильного присоединения:
В реакциях несимметричных алкенов соблюдается правило Марковникова.
Число n в формуле полимера (Mn) называется степенью полимеризации. Реакции полимеризации алкенов идут за счёт присоединения по кратным связям:
2. Димеризация алкенов – образование димера (удвоенной молекулы) в результате реакции присоединения. В присутствии минеральной кислоты (донора протона Н + ) происходит присоединение протона по двойной связи молекулы алкена. При этом образуется карбокатион:
Этот процесс протекает при обработке изобутилена (2-метипропена) 60% серной кислотой при температуре 70°С. Образовавшаяся в результате смесь диизобутиленов подвергается гидрированию с целью получения «изооктана» (2,2,4-триметилпентана), который применяется для улучшения антидетонационной способности бензина («изооктан» – стандарт моторного топлива с октановым числом 100).
Подобно реакции димеризации алкенов происходит их полимеризация, только процесс не останавливается на стадии образования димера, а идет дальше и включает в себя множество стадий присоединения молекул алкена к растущему карбокатиону.
6. Реакции окисления алкенов
Строение продуктов окисления алкенов зависит от условий реакции и природы окислителя.
1. Мягкое окисление алкенов водным раствором перманганата калия приводит к образованию двухатомных спиртов (реакцияВагнера):