какие способы очистки можно использовать для оксида молибдена 6
Способ очистки триоксида молибдена
Владельцы патента RU 2610494:
Заявляемое изобретение относится к технологии неорганических материалов, в частности оксидов металлов, и касается разработки способа получения высокочистого триоксида молибдена, используемого при выращивании из раствора в расплаве монокристаллов трибората лития, являющихся перспективным материалом для формирования третьей и четвертой гармоники лазера на основе иттрий алюминиевого граната, легированный неодимом, при синтезе сырья для выращивания монокристаллов молибдата лития (Li2MoO4), перспективного материала для детекторов редких явлений распада ядер, а также при синтезе теллуритных стекол, являющихся перспективными для изготовления активных и пассивных элементов волоконной и интегральной ИК-оптики.
В настоящее время доступным на отечественном рынке является триоксид молибдена марки «ЧДА», выпускаемый по ТУ 6-09-4471-77, а также препарат фирмы ООО «Ланхит», выпускаемый на основании собственной разработки, в котором суммарная чистота по 65 примесям не более 99,97 мас %. Однако упомянутый реактив не удовлетворяет современному уровню и требованиям лазерной техники, волоконной оптики и сцинтилляционных детекторов в смысле суммарной примесной чистоты.
Среди известных способов очистки триоксида молибдена можно выделить способы, основанные на переводе исходного сырья в раствор, очистке полученного раствора, осаждении и выделении смеси. Так, например, в патенте США описан способ получения чистого триоксида молибдена из низкосортного концентрата молибденита, включающий последовательные стадии окисления исходного сырья, выщелачивания, очистки полученного раствора (в том числе и многократной), выделения конечной смеси из раствора.
Однако упомянутый способ имеет ряд недостатков, а именно многостадийность, необходимость большого количества реактивов и вспомогательных материалов, а также получение в результате процесса большого количества отходов (US 20050019247 А1).
Однако настоящий способ позволяет судить об эффективности очистки только 14 примесей. Кроме того, описанный способ не гарантирует получения гомогенного препарата с фиксированным отклонением состава от стехиометрического в пределах области гомогенности фазы α-МоО3.
Задачей предлагаемого изобретения является повышение глубины очистки триоксида молибдена с возможностью получения препарата с фиксированным отклонением состава от стехиометрического в пределах области гомогенности фазы α-МоО3, при этом технический результат предлагаемого способа заключается в упрощении известных технологий и получении минимального количества отходов.
Поставленная задача решается, а технический результат достигается тем, что в предлагаемом способе очистку триоксида молибдена ведут сублимацией в вакууме, а перед очисткой триоксид молибдена смешивают с оксидом d-элемента, после чего полученную смесь прокаливают при температуре 650-700°C, при этом создают давление кислорода 0,2-1 атм, затем прокаленную смесь очищают сублимацией в вакууме при температуре 650-715°C, а затем осаждают очищенный триоксид молибдена в градиенте температуры 520-600°C, при этом сублимацию смеси в вакууме чередуют с окислением смеси, причем давление кислорода создают 0,1-0,4 атм.
Перед осуществлением способа триоксиду молибдена и оксиду d-элемента придают порошкообразную форму.
В результате отжига в атмосфере кислорода оксиды примесей образуют низколетучие тройные химические соединения или твердые растворы на их основе.
Чередование стадий сублимации в вакууме со стадиями окисления кислородом при давлении 0,1-0,4 атм обеспечивает получение фазы α-МоО3 в пределах области гомогенности, а выбор конкретного фиксированного значения давления кислорода в конкретном процессе обеспечивает получение фазы α-МоО3 с фиксированным отклонением состава от стехиометрического. При этом синтез реализуется в ходе одного цикла, а количество чередующихся стадий «сублимации-окисления» определяется экспериментально и зависит от конкретных геометрических размеров установки. Твердые отходы составляют 18-15% от исходной загрузки и их легко собирают и пускают в переработку.
Опытным путем было установлено, что проведение очистки при температуре 650-715°C с чередованием стадий сублимации в вакууме со стадиями окисления кислородом обеспечивает получение препарата с фиксированным отклонением состава от стехиометрического в пределах области гомогенности фазы α-МоО3.
Таким образом, упомянутые отличительные признаки являются существенными, так как каждый из них необходим, а вместе они достаточны для решения поставленной задачи: получение высокочистого триоксида молибдена с пониженным содержанием примеси металлов и фиксированным отклонением состава от стехиометрического в пределах области гомогенности фазы α-МоО3, пригодного для выращивания кристаллов трибората лития, при малом количестве стадий процесса очистки и малом количестве отходов.
Вес полученного препарата 343 г, что составляет 85,8% от загрузки.
Рентгенофазовый анализ препарата не выявил наличия фаз, кроме α-MoO3.
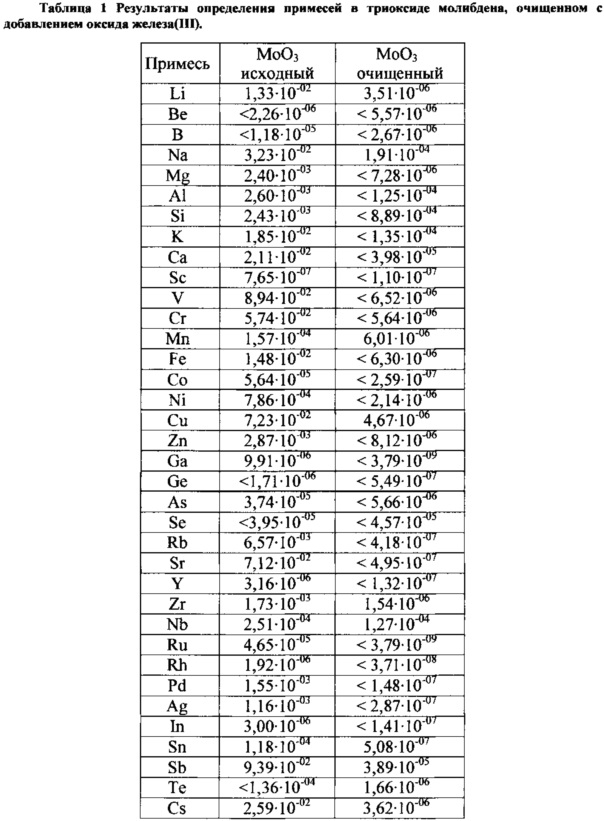
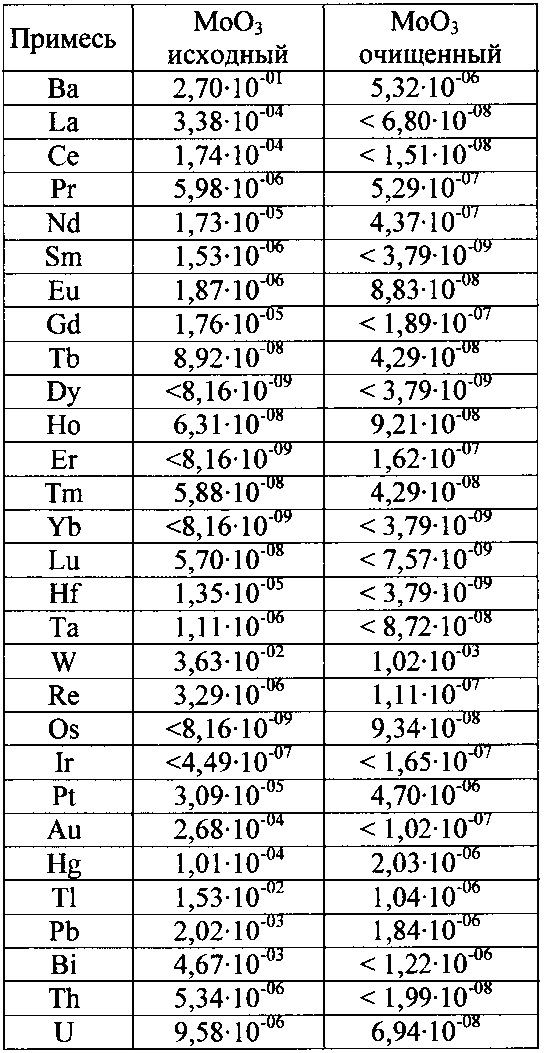
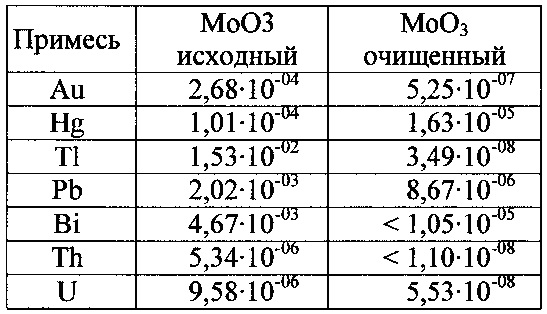
Результаты анализа методом МС-ИСП очищенного триоксида молибдена приведены в таблице 1.
Вес полученного препарата 340 г, что составляет 85,0% от загрузки.
Рентгенофазовый анализ препарата не выявил наличия фаз, кроме α-МоО3.
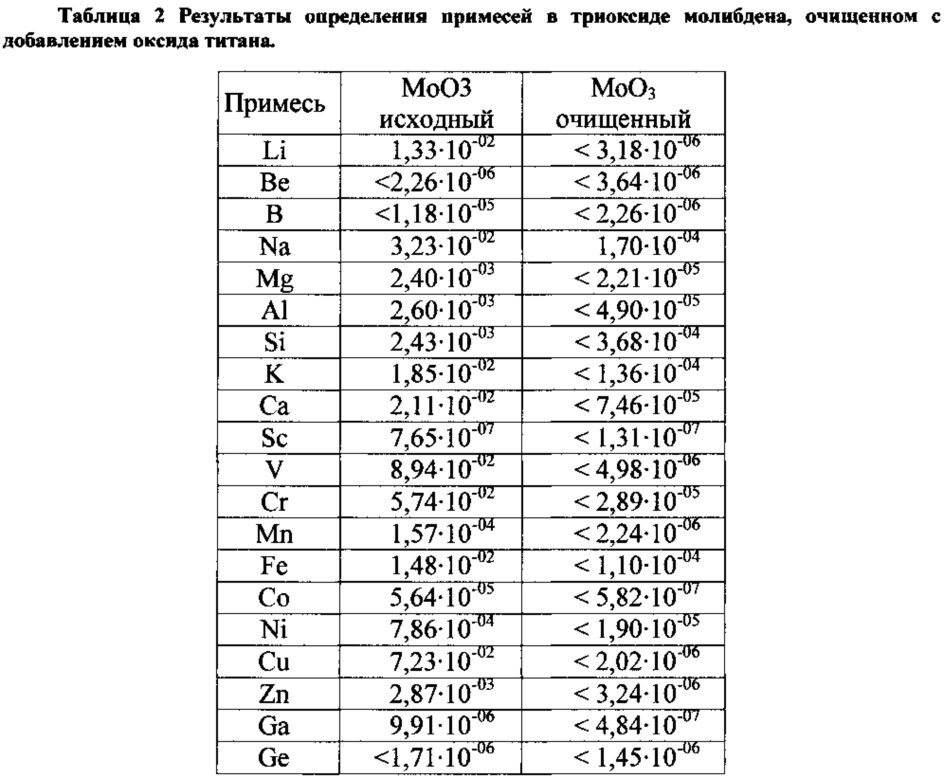
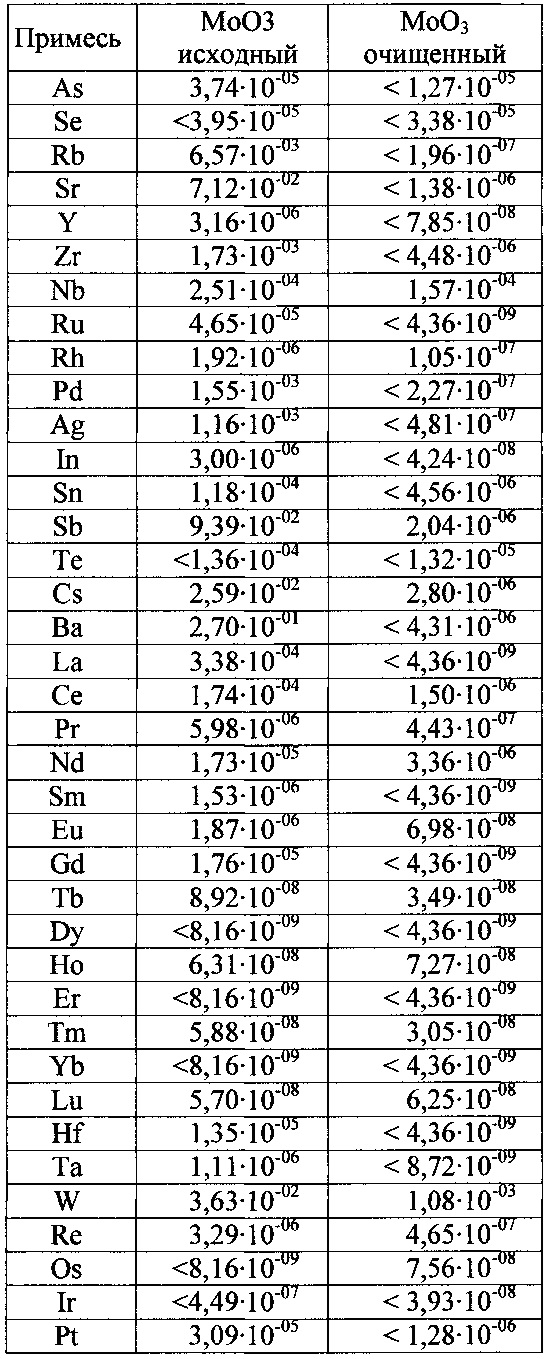
Результаты анализа методом МС-ИСП очищенного триоксида молибдена приведены в таблице 2.
Способ очистки триоксида молибдена, заключающийся в том, что очистку триоксида молибдена ведут сублимацией в вакууме, отличающийся тем, что перед очисткой триоксид молибдена смешивают с оксидом d-элемента, затем полученную смесь прокаливают при температуре 650-700°C, при этом создают давление кислорода 0,2-1 атм, затем прокаленную смесь очищают сублимацией в вакууме при температуре 650-715°C, осаждают очищенный триоксид молибдена в градиенте температуры 520-600°C, при этом сублимацию смеси в вакууме чередуют с окислением смеси при давлении кислорода 0,1-0,4 атм.
Способ очистки триоксида молибдена
Владельцы патента RU 2382736:
Заявляемое изобретение относится к технологии неорганических материалов, в частности оксидов металлов, и касается разработки способа получения высокочистого триоксида молибдена, используемого при синтезе теллуритных стекол, являющихся перспективными для изготовления активных и пассивных элементов волоконной и интегральной ИК-оптики.
Имеющийся на отечественном рынке триоксид молибдена марки «ЧДА», выпускаемый по ТУ 6-09-4471-77, не удовлетворяет требованиям волоконной оптики. Триоксид молибдена более высокой чистоты у нас в стране не производится.
Известны химические способы очистки триоксида молибдена, которые заключаются в связывании примесей специально подобранными реагентами в такие химические соединения, которые сравнительно легко отделяются от основного вещества (см., например, патент США №4762695).
В упомянутом источнике описан способ получения высокочистого триоксида молибдена переводом молибденсодержащего сырья в кислый водный раствор с перекисью водорода, очисткой этого раствора на ионообменных смолах с последующим его упариванием.
Содержание примесей радиоактивных элементов в полученном оксиде молибдена ниже 0,5 ppb, примесей Fe, Ni, Cr ниже 0,1 ppm.
Известный способ является многостадийным, требует большого количества высокочистых реактивов, в том числе тщательной отмывки ионообменной смолы.
Известен способ получения чистого триоксида молибдена возгонкой его из молибденовых концентратов. В качестве исходного концентрата используются огарки с содержанием молибдена от 48 до 56%, процесс испарения ведется при 900-1100°C в атмосфере воздуха. Возогнанный триоксид молибдена имеет чистоту 99,975%, что на 2-3 порядка выше исходного, в том числе по примесям меди и железа. Обеспечивая получение триоксида молибдена с высокой производительностью без затрат дополнительных химических реагентов по короткой технологической схеме, известный способ имеет недостаточную степень очистки триоксида молибдена, связанную с использованием в качестве исходного сырья огарка, высоких температур испарения и воздуха в качестве атмосферы (см. в книге Зеликман А.Н. Металлургия редких металлов, М., Металлургия, 1978, с.359). Упомянутый способ взят в качестве прототипа.
Задачей, на решение которой направлено заявляемое изобретение, является разработка способа получения высокочистого триоксида молибдена, пригодного для использования в качестве исходного материала при изготовлении теллуритных стекол для волоконной оптики.
Предпочтительно температуру подложки для осаждения триоксида молибдена поддерживать 510-530°C, что позволяет повысить коэффициент извлечения продукта из пара и использовать дополнительную ступень очистки от более летучих примесей.
Новыми отличительными признаками заявляемого способа является то, что очистке подвергают триоксид молибдена, предварительно прокаленный при 550-580°С в вакууме, очистку ведут испарением в режиме сублимации в вакууме при температуре 690-780°C, а очищенный триоксид молибдена выделяют на подложке, имеющей температуру 500-550°C. Для получения высокочистого продукта исходный триоксид молибдена прокаливают в тигле, выполненном из инертного по отношению к триоксиду молибдена материалу (платина, золото, и др.), а очищенный продукт осаждают на подложке из чистого кварцевого стекла или другого инертного материала.
Опытным путем было установлено, что прокаливание триоксида молибдена при 550-580°C обеспечивает очистку диоксида теллура от летучих примесей. При температуре менее 550°C реализуется низкая степень очистки от более летучих селена, мышьяка, ванадия и углеродсодержащих примесей, а при температуре выше 580°C возрастают потери продукта вследствие его возгонки.
Опытным путем было установлено, что при температуре подложки менее 500°С происходит конденсация нестехиометричного окисла молибдена, обедненного кислородом (например, Mo8O23, Mo4O11), имеющего более темный цвет, что непригодно для его использования, а при температуре подложки более 550°С понижается выход продукта на 10 и более процентов.
В платиновый тигель помещают навеску 60 г исходного триоксида молибдена квалификации «ЧДА» и прокаливают в безмасляном вакууме
600°С. После прокаливания температуру тигля повышают до 750°C и начинают процесс сублимации, температуру конденсатора понижают до 520°C. Когда в тигле остается
1. Способ очистки триоксида молибдена испарением, отличающийся тем, что перед очисткой триоксид молибдена прокаливают в вакууме при 550-580°С, очистку прокаленного продукта ведут испарением в режиме сублимации в вакууме при температуре 690-780°С, а очищенный продукт осаждают на подложке, температура которой составляет 500-550°С.
2. Способ по п.1, отличающийся тем, что очистку прокаленного продукта ведут в безмасляном вакууме при 730-750°С.
3. Способ по п.1, отличающийся тем, что очищенный продукт осаждают на подложке, температура которой составляет 510-530°С.
Какие способы очистки можно использовать для оксида молибдена 6
Заявляемое изобретение относится к технологии неорганических материалов, в частности оксидов металлов, и касается разработки способа получения высокочистого триоксида молибдена, используемого при выращивании из раствора в расплаве монокристаллов трибората лития, являющихся перспективным материалом для формирования третьей и четвертой гармоники лазера на основе иттрий алюминиевого граната, легированный неодимом, при синтезе сырья для выращивания монокристаллов молибдата лития (Li2MoO4), перспективного материала для детекторов редких явлений распада ядер, а также при синтезе теллуритных стекол, являющихся перспективными для изготовления активных и пассивных элементов волоконной и интегральной ИК-оптики.
В настоящее время доступным на отечественном рынке является триоксид молибдена марки «ЧДА», выпускаемый по ТУ 6-09-4471-77, а также препарат фирмы ООО «Ланхит», выпускаемый на основании собственной разработки, в котором суммарная чистота по 65 примесям не более 99,97 мас %. Однако упомянутый реактив не удовлетворяет современному уровню и требованиям лазерной техники, волоконной оптики и сцинтилляционных детекторов в смысле суммарной примесной чистоты.
Среди известных способов очистки триоксида молибдена можно выделить способы, основанные на переводе исходного сырья в раствор, очистке полученного раствора, осаждении и выделении смеси. Так, например, в патенте США описан способ получения чистого триоксида молибдена из низкосортного концентрата молибденита, включающий последовательные стадии окисления исходного сырья, выщелачивания, очистки полученного раствора (в том числе и многократной), выделения конечной смеси из раствора.
Однако упомянутый способ имеет ряд недостатков, а именно многостадийность, необходимость большого количества реактивов и вспомогательных материалов, а также получение в результате процесса большого количества отходов (US 20050019247 А1).
Однако настоящий способ позволяет судить об эффективности очистки только 14 примесей. Кроме того, описанный способ не гарантирует получения гомогенного препарата с фиксированным отклонением состава от стехиометрического в пределах области гомогенности фазы α-МоО3.
Задачей предлагаемого изобретения является повышение глубины очистки триоксида молибдена с возможностью получения препарата с фиксированным отклонением состава от стехиометрического в пределах области гомогенности фазы α-МоО3, при этом технический результат предлагаемого способа заключается в упрощении известных технологий и получении минимального количества отходов.
Поставленная задача решается, а технический результат достигается тем, что в предлагаемом способе очистку триоксида молибдена ведут сублимацией в вакууме, а перед очисткой триоксид молибдена смешивают с оксидом d-элемента, после чего полученную смесь прокаливают при температуре 650-700°C, при этом создают давление кислорода 0,2-1 атм, затем прокаленную смесь очищают сублимацией в вакууме при температуре 650-715°C, а затем осаждают очищенный триоксид молибдена в градиенте температуры 520-600°C, при этом сублимацию смеси в вакууме чередуют с окислением смеси, причем давление кислорода создают 0,1-0,4 атм.
Перед осуществлением способа триоксиду молибдена и оксиду d-элемента придают порошкообразную форму.
В результате отжига в атмосфере кислорода оксиды примесей образуют низколетучие тройные химические соединения или твердые растворы на их основе.
Чередование стадий сублимации в вакууме со стадиями окисления кислородом при давлении 0,1-0,4 атм обеспечивает получение фазы α-МоО3 в пределах области гомогенности, а выбор конкретного фиксированного значения давления кислорода в конкретном процессе обеспечивает получение фазы α-МоО3 с фиксированным отклонением состава от стехиометрического. При этом синтез реализуется в ходе одного цикла, а количество чередующихся стадий «сублимации-окисления» определяется экспериментально и зависит от конкретных геометрических размеров установки. Твердые отходы составляют 18-15% от исходной загрузки и их легко собирают и пускают в переработку.
Опытным путем было установлено, что проведение очистки при температуре 650-715°C с чередованием стадий сублимации в вакууме со стадиями окисления кислородом обеспечивает получение препарата с фиксированным отклонением состава от стехиометрического в пределах области гомогенности фазы α-МоО3.
Таким образом, упомянутые отличительные признаки являются существенными, так как каждый из них необходим, а вместе они достаточны для решения поставленной задачи: получение высокочистого триоксида молибдена с пониженным содержанием примеси металлов и фиксированным отклонением состава от стехиометрического в пределах области гомогенности фазы α-МоО3, пригодного для выращивания кристаллов трибората лития, при малом количестве стадий процесса очистки и малом количестве отходов.
Вес полученного препарата 343 г, что составляет 85,8% от загрузки.
Рентгенофазовый анализ препарата не выявил наличия фаз, кроме α-MoO3.
Результаты анализа методом МС-ИСП очищенного триоксида молибдена приведены в таблице 1.
Вес полученного препарата 340 г, что составляет 85,0% от загрузки.
Рентгенофазовый анализ препарата не выявил наличия фаз, кроме α-МоО3.
Результаты анализа методом МС-ИСП очищенного триоксида молибдена приведены в таблице 2.
Способ очистки триоксида молибдена, заключающийся в том, что очистку триоксида молибдена ведут сублимацией в вакууме, отличающийся тем, что перед очисткой триоксид молибдена смешивают с оксидом d-элемента, затем полученную смесь прокаливают при температуре 650-700°C, при этом создают давление кислорода 0,2-1 атм, затем прокаленную смесь очищают сублимацией в вакууме при температуре 650-715°C, осаждают очищенный триоксид молибдена в градиенте температуры 520-600°C, при этом сублимацию смеси в вакууме чередуют с окислением смеси при давлении кислорода 0,1-0,4 атм.
Оксид молибдена VI
(954 °C) 100 мм рт. ст.
(70 °C) 2.055 г/100 мл
Содержание
Структура
В газовой фазе, три атома кислорода вместе связаны с центральным атомом молибдена. В твердом состоянии безводный MoO3 состоит из слоев искаженных октаэдров MoO6 в ромбической форме кристаллов. Края октаэдров образуют цепочки, которые соединены с атомами кислорода, которые и образуют слои. Октаэдры имеют один короткую связь O—Mo с несоединенным кислородом.
Свойства и получение
Слабо парамагнитные двулучепреломляющие белые орторомбические кристаллы слоистой структуры, желтеющие при нагревании. Реагирует с кислотами, щелочами, раствором аммиака и сульфида натрия. Растворяется в воде, в избытке растворов щелочей или карбонатов щелочных металлов. Триоксид молибдена производится промышленным методом обжига дисульфида молибдена — главной руды молибдена:
Получается прокаливанием молибдена на воздухе при высокой температуре:
Лабораторный синтез предполагает подкисление водного раствора молибдата натрия с хлорной кислотой. При этом получаются диаква-триоксид молибдена и перхлорат натрия:
Применение
Молибденовый ангидрид используется в производстве металлического молибдена, который служит как добавка в сталь и коррозионно-стойкие сплавы.
Влечет за собой соответствующие преобразования из MoO3 в реакции с водородом при повышенных температурах:
Кроме того, является со-катализатором для использования в промышленном производстве акрилонитрила путём окисления пропилена и аммиака.
Из-за своей слоистой структуры и благодаря свойству пары ионов MoVI /Mo V данный оксид представляет интерес для использования в электрохимических устройствах и дисплеях.
«Лабораторный практикум по неорганическому синтезу» (стр. 5 )
 | Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 4 5 6 7 |
Монооксиды 3d-металлов (от Ti+2 до Ni+2) имеют структуру типа NaCl, многие являются нестехиометричными. Большинство диоксидов переходных металлов кристаллизуется в тетрагональной структуре типа рутила, где атомы металла находятся в тетрагонально-искаженном октаэдре из атомов кислорода.
5.2 Практическая часть
Методика получения оксида молибдена (VI)
крупнокристаллического
Для получения МоО3 молибдат аммония в количестве 15 г подвергается нагреванию в фарфоровой чашке в течение » 2 часов (уравнение реакции).
Молибденовый ангидрид, полученный таким образом, часто имеет синеватую окраску, вызванную образованием низших оксидов молибдена (в степени окисления +5 или +4). Это объясняется восстановительным действием аммиака, выделяющегося в ходе разложения (напишите уравнение реакции).
Для получения МоО3 и его возгонки прокаленный остаток растирают, помещают в тугоплавкую трубку (см. рисунок 12) и нагревают в токе кислорода или воздуха в течение 1,5-2 часов при температуре около 700°С. Препарат для прокаливания помещают ближе к входному отверстию трубки, что обеспечивает оседание возогнанного препарата на холодном конце трубки.
Методика получения крупнокристаллического оксида хрома (III)
Для получения крупнокристаллического оксида хрома смешивают равные весовые количества бихромата калия и хлористого натрия, растертых в порошок. Полученную смесь переносят в железный тигель, засыпают сверху слоем хлористого натрия и прокаливают. После охлаждения содержимое тигля выщелачивают (что переходит в раствор?). Какую роль в этом синтезе играет хлористый натрий?
Можно получить оксид хрома в аморфном состоянии. Для этого прокаливают в тигле смесь бихромата калия и серы, взятых в весовом отношении 10 : 1. После охлаждения тигля массу отделяют от стенок, промывают водой путем декантации (что переходит в раствор?). Осадок отфильтровывают и сушат на воздухе.
Взвесьте полученные продукты и рассчитайте выход их в процентах от теоретического по бихромату калия. Напишите уравнения реакций.
Предложите методику получения окиси хрома из: а) гидрата окиси хрома; б) нитрата хрома; в) хромита калия; г) хромата хрома? Как можно из окиси хрома получить соли хрома: а) трехвалентного; б) шестивалентного?
5.3 Вопросы и задания для самостоятельной работы по Модулю 5
1 На какие большие группы делятся оксиды (приведите примеры)? В каких реакциях проявляются кислотно-основные свойства каждой из указанных групп? От чего зависят окислительно-восстановительные свойства оксидов (приведите примеры реакций)?
2 Получение оксидов может быть осуществлено синтезом из простых веществ, а также термическим разложением солей, гидроксидов, кислот. Низшие и промежуточные оксиды при повышенных температурах в присутствии кислорода воздуха неустойчивы, но бывает и так, что при высоких температурах высшие оксиды теряют кислород и переходят в низшие (приведите примеры).
3 Какими тремя основными способами могут быть получены низшие и промежуточные оксиды?
4 Сравните строение, температуры плавления и кипения, устойчивость, кислотно-основные и окислительно-восстановительные свойства хромового, молибденового и вольфрамового ангидридов, объясните причины различий, приведите примеры реакций. Можно ли описанным ниже способом получить хромовый ангидрид? вольфрамовый ангидрид?
6 Охарактеризуйте строение, реакционную способность и химические свойства оксида хрома (III), оксида марганца (IV). Сравните их с другими оксидами этих же элементов.
5.4 Вопросы для самоконтроля к модулю 5
1. Какие Вы знаете способы получения оксидов?
2. Все ли оксиды могут быть получены разложением нитратов и карбонатов?
3. Почему разложение оксалатов используется только для получения низших оксидов?
4. Охарактеризуйте применимость реакций разложения сульфатов, фосфатов, боратов, солей аммония, гидроксидов для получения оксидов.
5. Охарактеризуйте применимость реакций разложения основных и кислотных гидроксидов для получения оксидов
6. Каково поведение примесей при проведении реакций разложения?
7. Каково физическое состояние оксида, полученного в результате реакции разложения, и как его можно менять, регулируя температуру?
Проектное задание к модулю 5.
Провести синтез какого-либо из оксидов. Рассчитать практический выход. Написать уравнения реакций, отражающих химические свойства полученного вещества.
Тест рубежного контроля к модулю 5.
1. Какой из указанных процессов является процессом восстановления?
г) (NH4)6 Mo7O24 → MoO3
2. Какие оксиды можно получить разложением солей аммония?
3. Какие оксиды проявляют сильные окислительные свойства?
4. Каково строение кристаллической решетки MoO3?
б) слоистая из октаэдров
г) цепочечная из тетраэдров
5. Основные способы получения оксидов Mo(VI) и W(VI):
а) разложение молибдатов и вольфраматов разложение нитратов
б) непосредственное соединение
в) разложение карбонатов
г) разложение нитратов
6. Какие способы очистки можно использовать для оксида молибдена (+6)
а) политермическая перекристаллизация
б) перегонка в вакууме с охлажде-нием паров на твердой подложке
в) возгонка в атмосфере воздуха
Модуль 6. АЛЮМОТЕРМИЧЕСКОЕ ПОЛУЧЕНИЕ МЕТАЛЛОВ
Комплексные цели: знать свойства алюминия и его оксида; основы металлотермических процессов; термодинамические возможности протекания таких процессов в с. у.; уметь грамотно проводить эксперимент по получению металлов.
6.1 Теоретическая часть
Металлотермические методы получения металлов, сплавов и неметаллов
При комнатной температуре такие реакции практически не протекают, но и при нагревании скорость реакции возрастает слишком незначительно. Только при температуре плавления хотя бы одного из компонентов (чаще всего металла – восстановителя) процесс идет со значительной скоростью. Для осуществления металлотермической реакции порошкообразную смесь оксида и восстановителя нагревают до расплавления одного из компонентов. Если компоненты реакционной смеси могут быть расплавлены за счет тепла, выделяющегося при протекании реакции восстановления, для инициирования реакции используют зажигательные смеси.
Возможность протекания реакции определяется значением ΔG процесса, а в первом приближении – тепловым эффектом реакции восстановления. Тепловой эффект реакции рассчитывают на основании закона Гесса: он равен разности между суммой теплот образования продуктов реакции и суммой теплот образования исходных веществ. Чем больше эта разность, тем полнее идет процесс. Следовательно, более активным восстановителем будет такой металл, при окислении которого выделяется больше тепла. В таблице 3 указаны ΔН образования некоторых оксидов.