какие структуры характерны для стенки артерии
Какие структуры характерны для стенки артерии
Кровеносная система состоит из центрального органа — сердца — и находящихся в соединении с ним замкнутых трубок различного калибра, называемых кровеносными сосудами (лат. vas, греч. angeion — сосуд; отсюда — ангиология). Сердце своими ритмическими сокращениями приводит в движение всю массу крови, содержащуюся в сосудах.

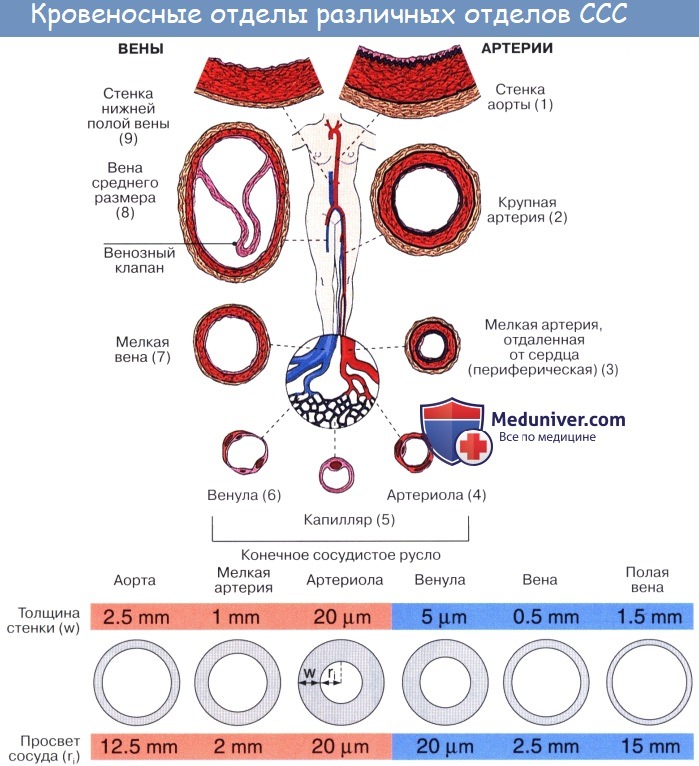
Артерии. Кровеносные сосуды, идущие от сердца к органам и несущие к ним кровь, называются артериями (аег — воздух, tereo — содержу; на трупах артерии пусты, отчего в старину считали их воздухоносными трубками).
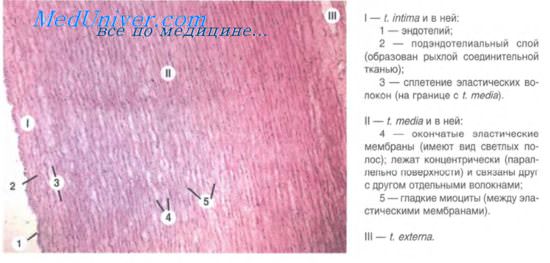
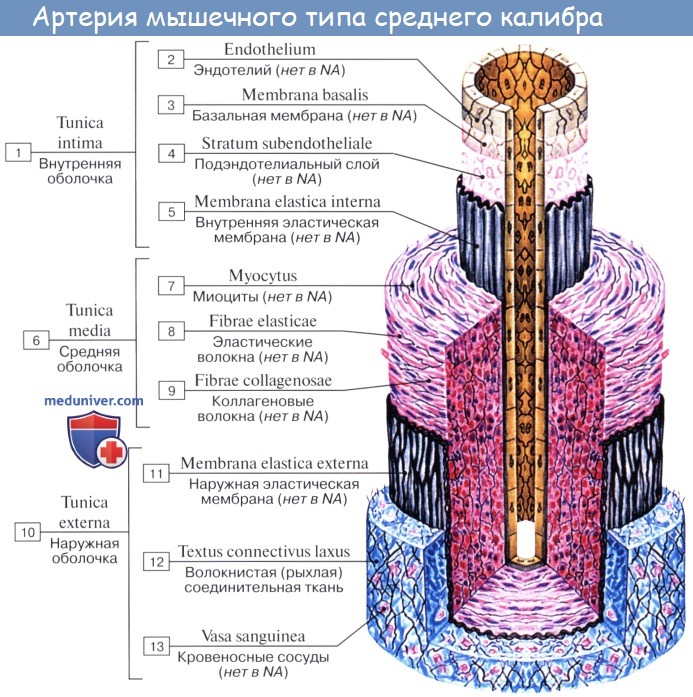
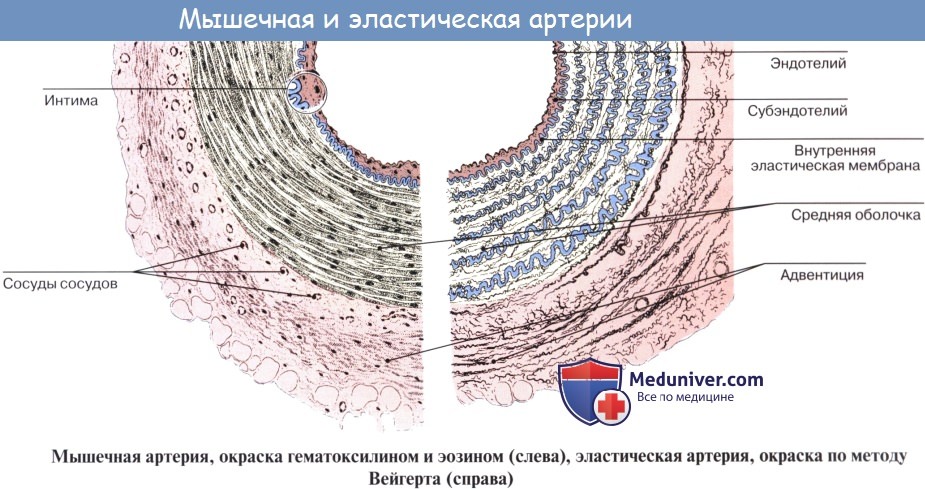
Стенка артерий состоит из трех оболочек. Внутренняя оболочка, tunica intima. выстлана со стороны просвета сосуда эндотелием, под которым лежат субэндотелий и внутренняя эластическая мембрана; средняя, tunica media, построена из волокон неисчерченной мышечной ткани, миоцитов, чередующихся с эластическими волокнами; наружная оболочка, tunica externa, содержит соединительнотканые волокна. Эластические элементы артериальной стенки образуют единый эластический каркас, работающий как пружина и обусловливающий эластичность артерий.
По мере удаления от сердца артерии делятся на ветви и становятся все мельче и мельче. Ближайшие к сердцу артерии (аорта и ее крупные ветви) выполняют главным образом функцию проведения крови. В них на первый план выступает противодействие растяжению массой крови, которая выбрасывается сердечным толчком. Поэтому в стенке их относительно больше развиты структуры механического характера, т. е. эластические волокна и мембраны. Такие артерии называются артериями эластического типа. В средних и мелких артериях, в которых инерция сердечного толчка ослабевает и требуется собственное сокращение сосудистой стенки для дальнейшего продвижения крови, преобладает сократительная функция.
Она обеспечивается относительно большим развитием в сосудистой стенке мышечной ткани. Такие артерии называются артериями мышечного типа. Отдельные артерии снабжают кровью целые органы или их части.
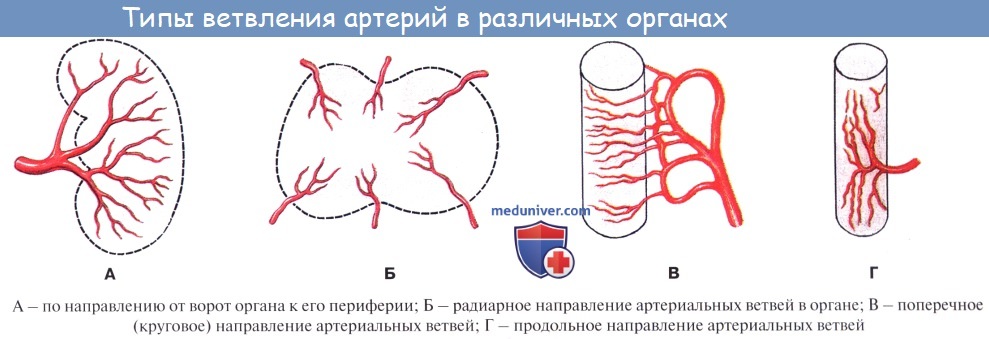
По отношению к органу различают артерии, идущие вне органа, до вступления в него — экстраорганные артерии, и их продолжения, разветвляющиеся внутри него — внутриорганные, или ингпраорганные, артерии. Боковые ветви одного и того же ствола или ветви различных стволов могут соединяться друг с другом. Такое соединение сосудов до распадения их на капилляры носит название анастомоза, или соустья (stoma — устье). Артерии, образующие анастомозы, называются анастомозирующими (их большинство).
Артерии, не имеющие анастомозов с соседними стволами до перехода их в капилляры (см. ниже), называются конечными артериями (например, в селезенке). Конечные, или концевые, артерии легче закупориваются кровяной пробкой (тромбом) и предрасполагают к образованию инфаркта (местное омертвение органа).
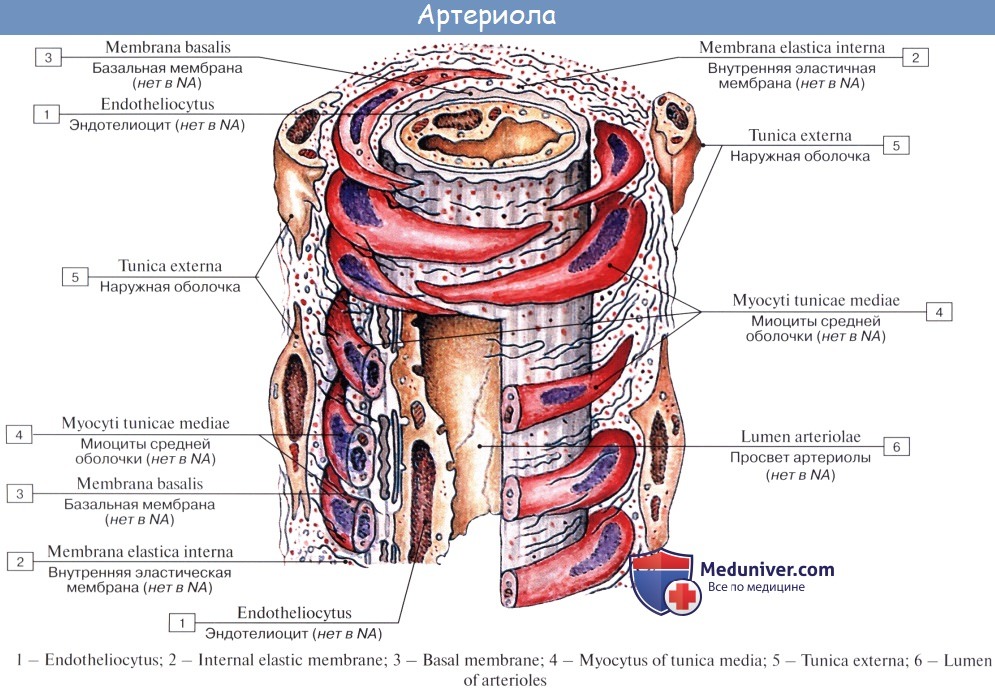
Последние разветвления артерий становятся тонкими и мелкими и потому выделяются под названием артериол.
Артериола отличается от артерии тем, что стенка ее имеет лишь один слой мышечных клеток, благодаря которому она осуществляет регулирующую функцию. Артериола продолжается непосредственно в прекапилляр, в котором мышечные клетки разрозненны и не составляют сплошного слоя. Прекапилляр отличается от артериолы еще и тем, что он не сопровождается венулой.
От прекапилляра отходят многочисленные капилляры.
Капилляры представляют собой тончайшие сосуды, выполняющие обменную функцию. В связи с этим стенка их состоит из одного слоя плоских эндотелиальных клеток, проницаемого для растворенных в жидкости веществ и газов. Широко анастомозируя между собой, капилляры образуют сети (капиллярные сети), переходящие в посткапилляры, построенные аналогично прекапилляру. Посткапилляр продолжается в венулу, сопровождающую арте-риолу. Венулы образуют тонкие начальные отрезки венозного русла, составляющие корни вен и переходящие в вены.
Вены (лат. vena, греч. phlebs; отсюда флебит — воспаление вен) несут кровь в противоположном по отношению к артериям направлении, от органов к сердцу. Стенки их устроены по тому же плану, что и стенки артерий, но они значительно тоньше и в них меньше эластической и мышечной ткани, благодаря чему пустые вены спадаются, просвет же артерий на поперечном разрезе зияет; вены, сливаясь друг с другом, образуют крупные венозные стволы — вены, впадающие в сердце.
Вены широко анастомозируют между собой, образуя венозные сплетения.
Движение крови по венам осуществляется благодаря деятельности и присасывающему действию сердца и грудной полости, в которой во время вдоха создается отрицательное давление в силу разности давления в полостях, а также благодаря сокращению скелетной и висцеральной мускулатуры органов и другим факторам.
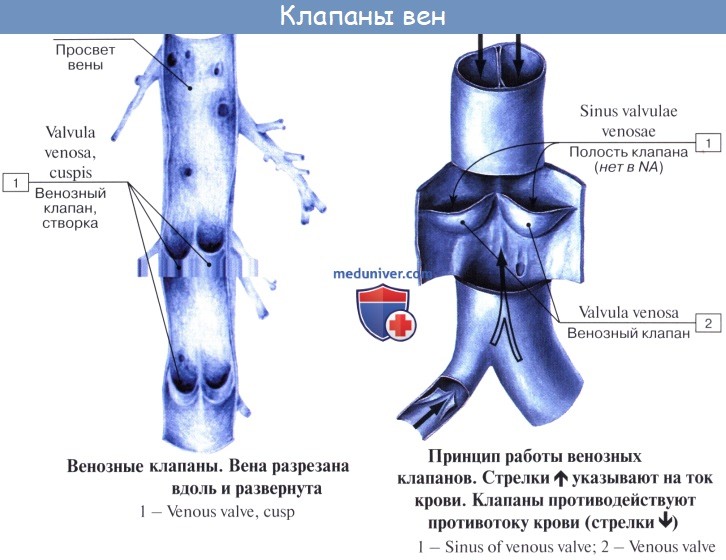
Имеет значение и сокращение мышечной оболочки вен, которая в венах нижней половины тела, где условия для венозного оттока сложнее, развитасильнее, чем в венах верхней части тела. Обратному току венозной крови препятствуют особые приспособления вен — клапаны, составляющие особенности венозной стенки. Венозные клапаны состоят из складки эндотелия, содержащей слой соединительной ткани. Они обращены свободным краем в сторону сердца и поэтому не препятствуют току крови в этом направлении, но удерживают ее от возвращения обратно.
Артерии и вены обычно идут вместе, причем мелкие и средние артерии сопровождаются двумя венами, а крупные — одной. Из этого правила, кроме некоторых глубоких вен, составляют исключение главным образом поверхностные вены, идущие в подкожной клетчатке и почти никогда не сопровождающие артерий. Стенки кровеносных сосудов имеют собственные обслуживающие их тонкие артерии и вены, vasa vasorum. Они отходят или от того же ствола, стенку которого снабжают кровью, или от соседнего и проходят в соединительнотканном слое, окружающем кровеносные сосуды и более или менее тесно связанном с их наружной оболочкой; этот слой носит название сосудистого влагалища, vagina vasorum.
В стенке артерий и вен заложены многочисленные нервные окончания (рецепторы и эффекторы), связанные с центральной нервной системой, благодаря чему по механизму рефлексов осуществляется нервная регуляция кровообращения. Кровеносные сосуды представляют обширные рефлексогенные зоны, играющие большую роль в нейро-гуморальной регуляции обмена веществ.
Какие структуры характерны для стенки артерии
Сердечно-сосудистый комплекс органов включает сердце, артерии, сосуды микроциркуляторного русла, вены, лимфатические сосуды. Сердце и замкнутая сеть сосудов обеспечивают циркуляцию крови в организме и транспорт лимфы к сердцу. Деятельность сердечно-сосудистого комплекса направлена на поддержание метаболизма и постоянства внутренней среды организма — из крови к тканям и клеткам поступают питательные вещества, кислород, биологически активные вещества, регулирующие их развитие и функции; в кровь и лимфу удаляются ненужные клеткам шлаки и продукты их специальной деятельности.
Развитие. Источником развития кровеносных сосудов является мезенхима. Первые сосуды возникают вне организма зародыша — в стенке желточного мешка и хориона в начале 3-й недели эмбриогенеза. Первоначально образуются скопления клеток мезенхимы, именуемые кровяными островками. Периферические клетки островков уплощаются и, соединяясь друг с другом, формируют примитивные сосуды в виде эндотелиальных трубок. Центрально расположенные мезенхимоциты дифференцируются в первичные клетки крови (начальный интраваскулярный этап кроветворения). В теле зародыша сосуды появляются позже, также из мезенхимы путем разрастания ее клеток по стенкам щелевидных пространств зародыша.
В конце 3-й недели устанавливается сообщение между первичными кровеносными сосудами внезародышевых органов и тела зародыша. После начала циркуляции крови структура сосудов заметно усложняется в соответствии с региональными условиями гемодинамики. В составе стенок сосудов, помимо эндотелия, развиваются другие ткани (происходящие также из мезенхимы), которые, объединяясь, формируют внутреннюю, среднюю, и наружную оболочки сосудов.
Закладка сердца возникает в начале 3-й недели развития в виде парных мезенхимных трубок. После их слияния начинается дифференцировка тканей внутренней оболочки сердца — эндокарда. Средняя и наружная оболочки сердца формируются также из парных миоэпикардиальных пластинок — фрагментов правого и левого висцеральных листков спланхнотома. Миоэпикардиальные пластинки приближаются к закладке эндокарда, окружают ее снаружи, и далее, сливаясь, дифференцируются в тканевые элементы мио- и эпикарда.
Артерии. Виды и строение артерий.
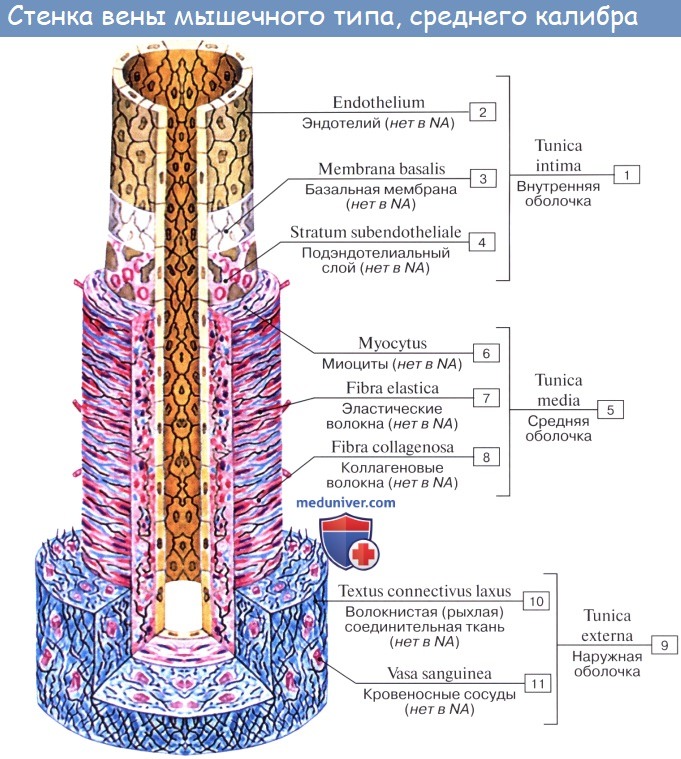
Артерии — сосуды, обеспечивающие продвижение крови от сердца к микроциркуляторному руслу. По величине диаметра они подразделяются на артерии малого, среднего и крупного калибра. Стенка всех артерий состоит из трех оболочек: внутренней (tunica intima), средней (tunica media) и наружной (tunica externa). Тканевый состав и степень развития этих оболочек в артериях разного калибра неодинаковы, что связано с гемодинамическими условиями и особенностями функций, выполняемых сосудами тех или иных отделов артериального русла. По количественному соотношению эластических и мышечных элементов в средней оболочке сосуда различают артерии эластического, смешанного (мышечно-эластического) и мышечного типов.
Артерии эластического типа (аорта и легочная артерия) выполняют транспортную функцию и функцию поддержания давления крови в артериальной системе во время диастолы сердца. Стенка их испытывает ритмические изменения кровяного давления. Кровь в эти сосуды поступает под высоким давлением (120-130 мм рт. ст.) и со скоростью около 1 м/с. В этих условиях вполне оправдано сильное развитие эластического каркаса стенки, который позволяет растягиваться сосудам во время систолы и принимать исходное положение во время диастолы. Возвращаясь в исходное положение, эластичная стенка таких сосудов способствует тому, что последовательно выбрасываемые из желудочков сердца порции крови превращаются в непрерывный кровоток.
Внутренняя оболочка сосудов эластического типа (на примере аорты) состоит из эндотелия, подэндотелиального слоя и сплетения эластических волокон. В подэндотелиальном слое определяются малодифференцированные звездчатые клетки рыхлой соединительной ткани, отдельные гладкие мышечные клетки, большое количество гликозаминогликанов. С возрастом здесь отмечается накопление холестерина. В средней оболочке аорты имеется до 50 эластических окончатых мембран (точнее — эластических окончатых цилиндров разных диаметров, вставленных друг в друга), в отверстиях которых располагаются гладкие мышечные клетки и эластические волокна. Наружная оболочка состоит из рыхлой волокнистой соединительной ткани, содержащей сосуды сосудов и нервные стволики.
Артерии смешанного (мышечно-эластического) типа характеризуются примерно равным количеством мышечных и эластических элементов в составе средней оболочки. Между гладкими миоцитами лежат густые сети эластических фибрилл.
На границе внутренней и средней оболочек отчетливо выражена внутренняя эластическая мембрана. В наружной оболочке содержатся пучки гладких мышечных клеток, а также коллагеновых и эластических волокон. К артериям данного типа относятся сонная, подключичная и другие.
Артерии мышечного типа выполняют не только транспортную, но и распределительную функции, регулируя приток крови к органам в условиях разных физиологических нагрузок (это, так называемые, органные артерии). Артерии мышечного типа содержат в средней оболочке гладкие миоциты. Это позволяет артериям регулировать приток крови к органам и поддерживать нагнетание крови, что важно для кровоснабжения органов, расположенных на большом удалении от сердца. Артерии мышечного типа могут быть крупного, среднего и малого калибров. Внутреннюю оболочку стенки этих артерий образуют эндотелий, лежащий на базальной мембране, подэндотелиальный слой и внутренняя эластическая мембрана, однако в мелких артериях внутренняя эластическая мембрана выражена слабо.
Средняя оболочка образована гладкой мышечной тканью с небольшим количеством фибробластов, коллагеновых и эластических волокон. Гладкие миоциты располагаются в средней оболочке по пологой спирали. Вместе с радиально и дугообразно расположенными эластическими волокнами миоциты создают единый пружинящий каркас, который препятствует спадению артерий, обеспечивая их зияние и непрерывность кровотока. На границе между средней и наружной оболочками имеется наружная эластическая мембрана. Последняя относится к наружной оболочке, состоящей из рыхлой соединительной ткани. Коллагеновые волокна имеют косое и продольное направление. В наружной оболочке артерий мышечного типа проходят питающие их кровеносные сосуды и нервы.
С помощью растровой электронной микроскопии показано, что внутренняя поверхность эндотелия артерий имеет многочисленные складки и углубления, разнообразные по форме микроскопические выросты. Это создает неровный и сложный микрорельеф внутренней (люминальной) поверхности сосудов. Такой микрорельеф увеличивает свободную поверхность соприкосновения эндотелия с кровью, что имеет трофическое значение и создает благоприятные условия для гемодинамики.
Ультрасонографическая оценка аорты и мезентериальных артерий
Margarita V. Revzin,MD, MS, John S. Pellerito, MD
ОСНОВНЫЕ ПОЛОЖЕНИЯ
ВВЕДЕНИЕ
В этой статье рассматривается сонографическая оценка брюшной аорты и мезентериальных артерий. В статье рассмотрена соответствующая анатомия и гемодинамика для нормальных сосудов, а также при патологии, в том числе аневризме брюшной аорты (АБА), стенозе сосудов, расслоении и окклюзии. Представлены также различные методы допплеровских исследований, протоколов и диагностических критериев, используемых при оценке аорты и мезентериальных артерий. Читателям представлена необходимая информация для правильной диагностики и показаны потенциальные ошибки, которых необходимо избегать.
АНАТОМИЯ БРЮШНОЙ АОРТЫ И ЕЕ ОСНОВНЫХ ВЕТВЕЙ
Базовые знания анатомии брюшной аорты и ее основных ветвей имеют важное значение для правильной интерпретации ультразвуковых находок и для понимания патологических состояний, поражающих эти сосуды.
Брюшная аорта
Анатомия мезентериальных артерий и коллатеральных путей
Существует богатая коллатеральная сеть между всеми мезентериальными артериями, которая обеспечивает кровоток в жизненно важных органах и кишечнике, если один или более сосудов скомпрометированы. Связь между чревным стволом и системой ВБА осуществляется через гастродуоденальную артерию. Гастродуоденальная артерия формируется из верхней панкреатодуоденальной артерии – ветви системы чревного ствола и нижней панкреатодуоденальной артерии, ветви ВБА. Системы ВБА и НБА соединяются дугой Риолана, объединяющей среднюю толстокишечную артерию – веточку ВБА с левой толстокишечной артерией – веточкой НБА. Она (дуга) образует короткую петлю, которая проходит рядом с корнем брыжейки. Кроме того, ВБА и НБА анастомозируют с помощью краевой артерии Драммонда, которая является продолжением артериального круга или аркады вдоль внутреннего края толстой кишки, образованной анастомозами терминальной ветви подвздошно-толстокишечной артерии, правой и средней толстокишечной артерии (от ВБА) с левой толстокишечной и сигмовидной артериями НБА. Кроме того, есть связь НБА и системы внутренней подвздошной артерии через анастомоз верхней прямокишечной артерии (ветви НБА) с нижней прямокишечной артерией (ветвь внутренней подвздошной артерии).
Существует значительные различия в анатомии коллатеральной циркуляции – варианты со слабой или отсутствием связи между брыжеечными артериями, что встречается до 30% населения.
ГЕМОДИНАМИКА БРЮШНОЙ АОРТЫ И МЕЗЕНТЕРИАЛЬНЫХ АРТЕРИЙ
Гемодинамика аорты
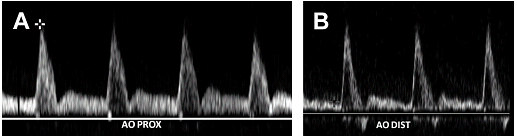
Брюшная аорта является эластичной структурой, обеспечивающая движение крови на периферию в течение сердечного цикла, расширяясь в систолу и сокращаясь в диаметре в диастолу. Эта физиология отражается в изменениях пульсации, которые наблюдаются на диаграмме волны в течение сердечного цикла. Формы волны, полученные в проксимальной брюшной аорте отличаются от полученных в дистальной аорте. Хотя оба сегмента показывают трехфазные формы волны, форма волны проксимальной брюшной аорты имеет большую длительность во время диастолы (Рис. 2 А).
Рис. 2. Аортальная волновая диаграмма. (A) Импульсный допплер проксимального отдела аорты показывает сигнал с низким сопротивлением и наличием потока в диастолу. (Б) Сигнал дистальной аорты имеет периферическую трехфазную форму.
Это явление обусловлено наличием нескольких крупных ветвей брюшной аорты, кровоснабжающих печень, селезенку и почки. Эти органы имеют кровоток с низким сопротивлением и требуют непрерывного тока крови в течение всей систолы и диастолы для их функционирования. Ниже почечных артерий, форма сигнала брюшной аорты имитирует периферические артерии, характеризующиеся трехфазным сигналом с минимальным диастолическим потоком и более заметным изменением направления потока в начале диастолы (см. Рис. 2B). Средняя систолическая пиковая скорость (СПС) в брюшной аорте составляет 110 см/с в популяции со средним возрастом 12 лет. С увеличением возраста, СПС уменьшается, варьируя от 70 до 100 см/с.
Гемодинамика мезентериальных судов
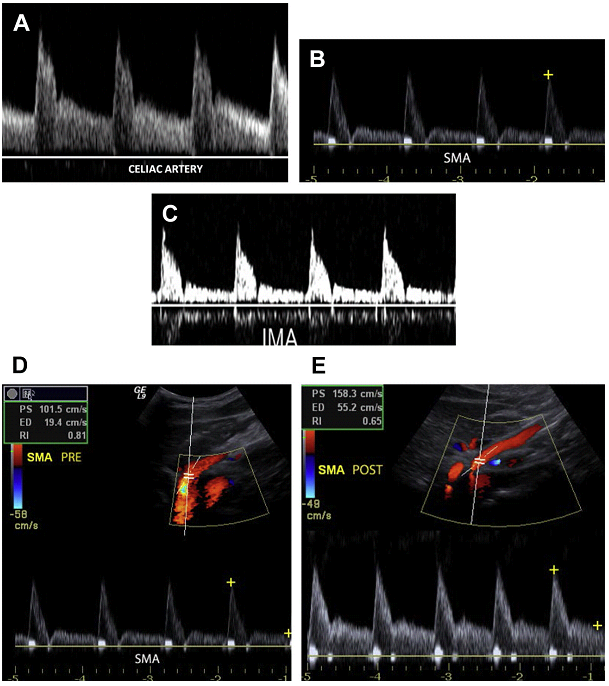
ВБА и НБА кровоснабжают слои тонкой кишки и толстой кишки с переменным сопротивлением и, таким образом волновая диаграмма имеет разную форму: с высоким сопротивлением в препрандиальном состоянии и низким сопротивлением потока в постпрандиальном состоянии (см. Рис. 3B-Е). Эта состояние связано с расширением ветвей мезентериальных сосудов в ответ на повышенные требования в кислороде кишечником после употребления пищи. Как результат, пик систолической и конечной диастолической скорости увеличивается после употребления еды, богатой липидами. Средняя СПС в брыжеечных артериях следующая: в чревном стволе диапазоны СПС от 98 до 105 см / с; в ВБА – от 97 до 142 см / с и в НБА – от 93 до 189 см / с.
Техника
Ультразвуковое исследование брюшной аорты и висцеральных сосудов преимущественно осуществляется после 8-12 часового голодания, чтобы уменьшить кишечный газ. Перед исследованием не дают лекарств.
Используется современное ультрасонографическое оборудование с высококачественным цветным, энергетическим и чувствительным импульсным допплером. Учитывая то, что аорта и брыжеечные артерии расположены глубоко в брюшной полости, у взрослых используется допплеровский аппарат с конвексным низкочастотным датчиком от 2 МГц до 5 МГц.
Рис. 3. Волновая диаграмма мезентериальных артерий. (A) Импульсный допплер чревной артерии показывает низкорезистивный сигнал с высокой диастолической скоростью. (B, C) Препрандиальный импульсный допплер от ВБА и НБА отражает сигнал высокого сопротивления с минимальным потоком в диастолу. (D, E) Препрандиальный и постпрандиальный импульсный допплер от ВБА отражает увеличение диастолической скорости в ВБА после еды.
ПРОТОКОЛ
Брюшная аорта
Стандартный протокол сканирования брюшной аорты первоначально включает оценку с использованием серой шкалы и цветного допплеровского режима для выявления любых патологических состояний, таких как атеросклероз сосудов, сужение просвета, расслоение или аневризма. Продольные и поперечные изображения брюшной аорты последовательно получают от уровня диафрагмы до уровня ее бифуркации, с визуализацией общих подвздошных артерий. Измерения диаметра сосуда должны быть выполнены на нескольких уровнях: проксимальном, среднеабдоминальном, дистальном и проксимальных сегментах обеих общих подвздошных артерий. На продольных и поперечных сканах аорты и общей подвздошной артерии измеряется наружный диаметр к наружному диаметру в передне-задней и поперечной плоскостях. Измерительные метки должны быть размещены вдоль внешней границы стенки аорты. Поперечный размер аорты также может быть оценен во фронтальной плоскости. Обе общие подвздошные артерии особенно хорошо визуализируется во фронтальной плоскости у пациентов в положении на левом боку. Затем выполняется последовательное цветное допплеровское сканирования средней части аорты и спектрометрия.
Мезентериальные (брыжеечные) артерии
Стандартный протокол сканирования сосудов внутренних органов начинается с оценки брюшной аорты в серой шкале и цветным допплером, после чего выполняется импульсное допплеровское исследование аорты на уровне брыжеечных артерий. Эти измерения служат базовыми показателями скорости для сравнения с СПС брыжеечной артерии. СПС впоследствии измеряется у начала, проксимального и среднего сегментов чревного ствола, ВБА, и НБА. Дистальные сегменты брыжеечных артерий не видны при ультрасонографии, хотя это не считается значительным ограничением, потому что большинство атеросклеротических поражений происходит вблизи истоков этих судов.
АТЕРОСКЛЕРОЗ И ОККЛЮЗИОННЫЕ ПОРАЖЕНИЯ АРТЕРИЙ
Структура стенки аорты
Чтобы понять патофизиологию развивающейся атеросклеротической бляшки в брюшной аорте, клиницисты должны иметь четкое понимание структуры стенки аорты. Внутренний слой называется интимой и состоит из эндотелиальных клеток с минимальным количеством субэндотелиальной соединительной ткани. Его функция заключается в предотвращении агрегации тромбоцитов и тромбоза, регулирование тонуса гладкой мускулатуры глубоких слоев, модуляция роста гладкомышечных клеток и их миграции, и контроль внедрения липопротеинов в стенку сосуда. Внешний слой стенки аорты называется адвентицией и отвечает за общую прочность на разрыв. Ваза-вазорум и мелкие нервы проходят через этот слой. Между интимой и адвентицией находится средняя оболочка, которая состоит из отдельных пучков гладкомышечных клеток, эластичных волокон и коллагена. Мышечный компонент поддерживает тонус стенки сосуда. Внутренняя и внешняя эластическая мембрана отделяют интиму от средней оболочки и, соответсвеноо, среднюю оболочку от адвентициального слоя, соответственно.
Формирование атеросклеротической бляшки
Атеросклероз является наиболее распространенным типом артериальных окклюзионных заболеваний, характеризующихся развитием бляшки вдоль стенки артерии с последующем сужением просвета сосуда. Это заболевание является хроническим и прогрессирующим, что может привести к почти полной или полной окклюзии сосуда. Образование бляшек в первую очередь является результатом повреждения эндотелиальных клеток интимы с отложение липидов в стенке и развитием клеточной гипоксии (9).
Наиболее ранним проявлением атеросклероза является медленное, прогрессирующее утолщение интимы, вызванное повышенной ее проницаемостью с последующей миграцией лейкоцитов, воспалительным клеточным ответом и постепенным отложением пенистых клеток в интиме. Этот процесс приводит к миграции клеток гладких мышц и развитие жировых прослоек, которые являются зонами первоначального накопления липидов. Жировые прослойки постепенно развиваются в фиброзные бляшки, которые являются очаговыми поражениями на поверхности просвета артерии, покрытой неповрежденным эндотелием. Бляшки становятся уязвимыми, когда фиброзная покрышка разрывается и на ее поверхности образуется тромб. Этот тромб – нестабильный и может привести к эмболии.
В отличие от этого, стабильная бляшка – гиалинизированная, содержит больше фиброзной ткани, кальцинированна, с высоким содержанием липидов. Она поражает более мелкие сосуды, вызывает меньшее воспаление и имеет гладкую поверхность. Частота эмболии при стабильной бляшке очень низкая.
Сонографическая оценка атеросклеротической бляшки и ассоциированного стеноза просвета сосуда
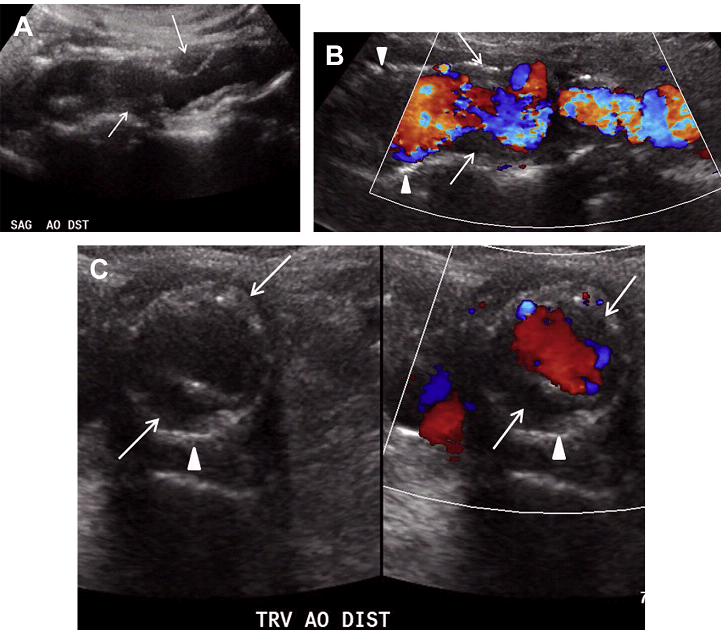
Сонография играет важную роль в выявлении атеросклеротических бляшек и оценке степени стеноза, связанного с их развитием. На изображении в серой шкале, геморрагическая бляшка обычно гипоэхогенная, может быть с неровной поверхностью, которая выступает в качестве очага для агрегации тромбоцитов. В отличие от этого, стабильная бляшка, как правило, – более гиперэхогенная на изображении в серой шкале из-за большого отложения кальция и различий структурного содержимого бляшки. Некоторые бляшки более неоднородны по эхогенности: за счет эхогенных и гипоэхогенных компонентов мягких тканей, которые отражают изменчивость их состава (Рис. 4А, В).
В аорте, основная часть атеросклеротических бляшек возникает у истоков ее основных судов и в месте бифуркации. Наиболее распространенным местом развития атеросклеротической бляшки является грудная аорта, а второе по частоте место – аортоподвздошный сегмент. Большинство атеросклеротических бляшек асимметричны в поперечном сечении. Эти данные лучше всего оценивать при тщательном обследования бляшки в разных плоскостях, чтобы точно определить степень стеноза (Рис. 4C).
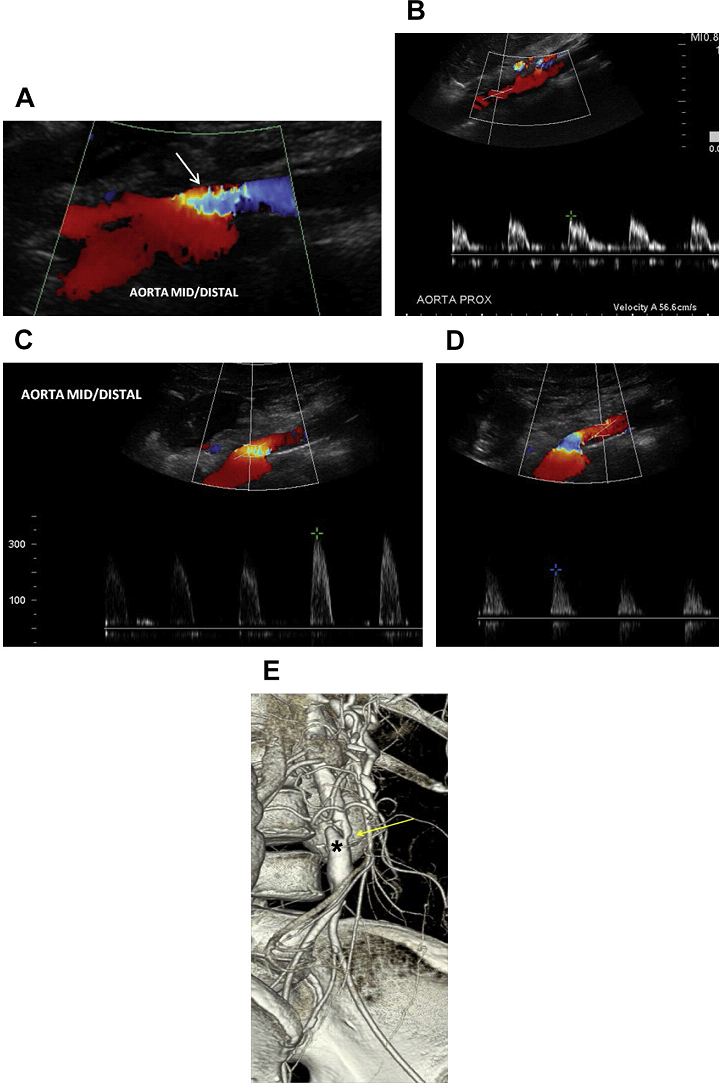
При ультрасонографии, обнаружение стеноза усиливается цветным допплеровским изображением при наложении его на место очевидного стеноза сегмента (Рис. 5).
Для того чтобы увеличить чувствительность диагностики аортального стеноза, клиницисты должны настроить параметры цветного допплера к ламинарному току в непораженном сегменте аорты, а затем искать любые очаговые нарушения кровотока вдоль брюшной аорты. После того, как обнаружено нарушение кровотока, проводится изучение объемного кровотока в центре гемодинамически аномального сосуда. Спектральный допплеровский анализ покажет не только заметное возрастание СПС в зоне стеноза, но также может показать наличие медленной и малой формы пульсовой волны дистальнее стенозированного сегмента, как в основном сосуде, так и его ветвях (Рис. 6 и 7).
Рис. 4. Атеросклероз и бляшки. Сагиттальный скан в серой шкале (А) и цветной допплер (B) дистального отдела брюшной аорты свидетельствуют о значительных мягких (стрелки) и кальцинированных (наконечники стрел) бляшек, ассоциированных с легким до умеренной неравномерным сужением просвета. (C) Поперечный скан в серой шкале (D) и цветной допплер подтверждают степень сужения просвета в зоне мягких (стрелки) и кальцинированных (наконечники стрел) бляшек.
Окклюзия аорты
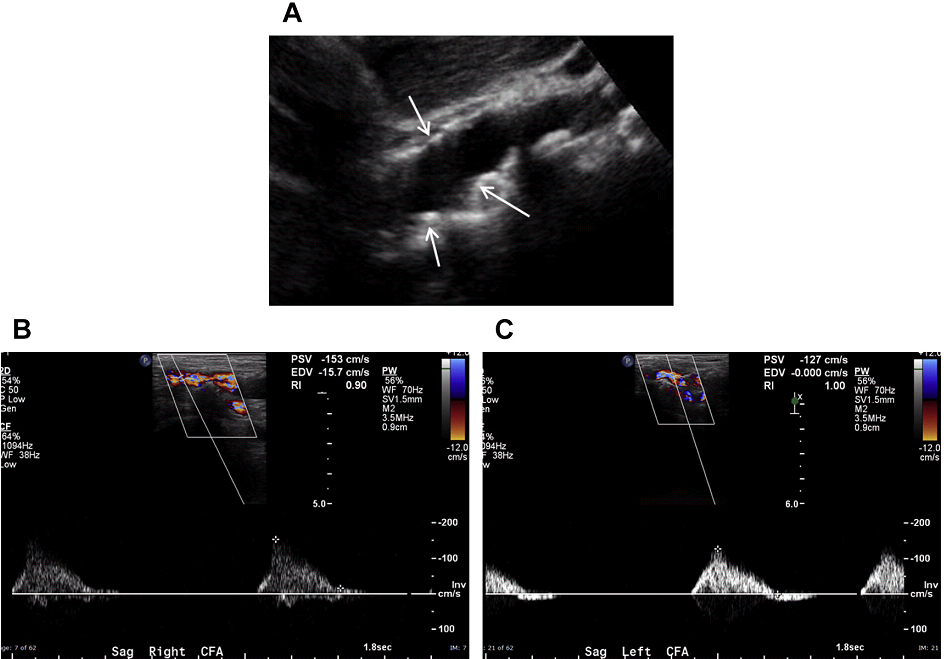
Развитие стеноза высокой степени является медленным и прогрессирующим процессом, который, как правило, сопровождается развитием каналов коллатерального кровотока. Пациенты обычно обращаются при ухудшении симптома нижних конечностей, такого как хромота, вторичного по отношению к развитию прогрессирующего окклюзионного сужения аорты. Когда сужение аорты является существенным, симптомы могут появляться в состоянии покоя, что также может привести к болям в ягодицах и бедрах. У мужчин также может развиваться импотенция. Окклюзия дистальной аорты, сопровождающаяся этими симптомами, называется синдромом Лериша.
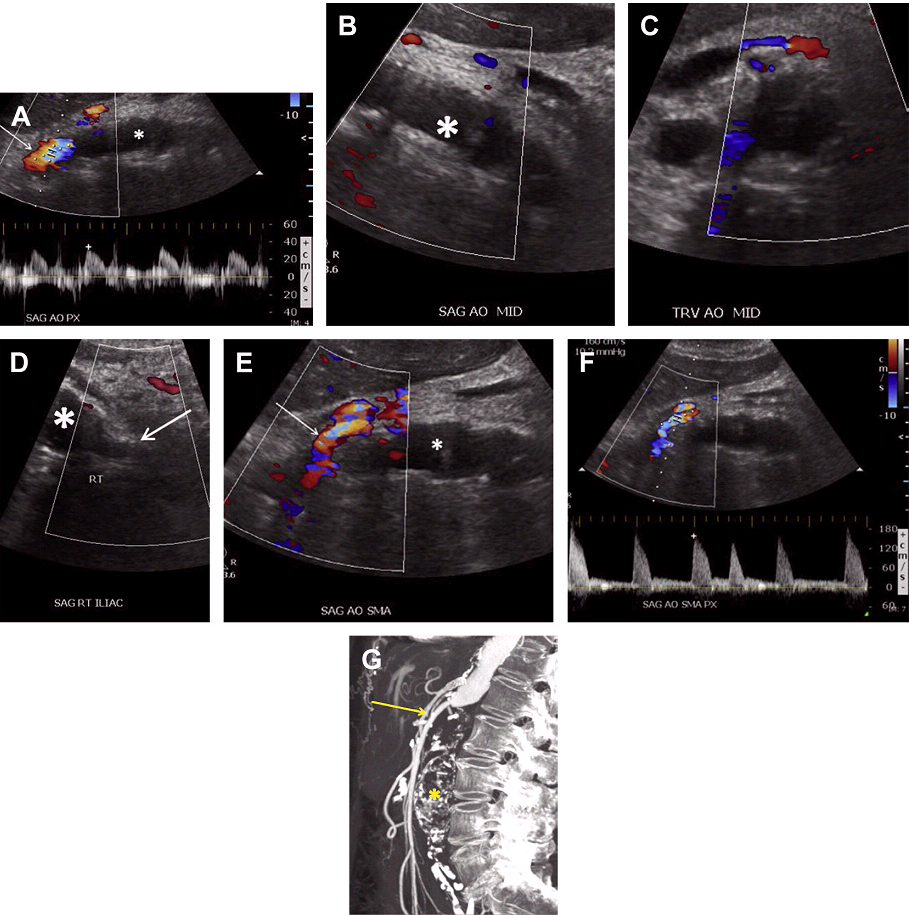
Полная окклюзия аорты чаще всего происходит в нижней части брюшной аорты (Рис. 8 A-D). В большинстве случаев тромб распространяется вверх до уровня почечных артерий без окклюзии почечных артерий. ВБА и ее ветви служат в качестве коллатерального источника для восстановления кровотока в общих подвздошных артериях через анастомозы с толстокишечными ветвями НБА (см. Рис. 8 E-G).
Рис. 5. Аортальный стеноз, вызванный, скорее всего, атеросклеротической бляшкой. (A) Цветной допплер среднего/дистального отдела аорты показывает локальное наложения цветных спектров (стрелка) – стеноз аорты на этом уровне. (B) Спектральный допплер проксимальной брюшной аорты показывает низкоскоростные (57 см / с), высокорезистивные волны. (C) Высокоскоростной поток (> 300 см / с) в средней части аорты соответствует наличию стеноза. (D) Наличие медленной и малой формы пульсовой волны идентифицированы дистальнее области стеноза. (Е) Соответствующая объемная КТ брюшной аорты показывает выраженный стеноз среднего/дистального отдела аорты (желтая стрелка) с постстенотической дилатацией (звездочка).
Рис. 6. Аортальный стеноз. (А) Сагиттальный скан в серой шкале средней части брюшной аорты показывает значительное количество атеросклеротических бляшек (стрелки); тем не менее, на этом изображении степень стеноза трудно оценить. (B, C) Спектральный допплер обеих общих бедренных артерий показывает наличие медленной и малой формы пульсовой волны, подразумевающих наличие значительного поражения кровотока, вероятно, вызваного аортальным стенозом.
Нормальные размеры брюшной аорты
Размеры брюшной аорты зависят от пола и возраста, у мужчин этот сосуд более крупный, чем у женщин и детей. Диаметр аорты увеличивается с возрастом. Средний размер брюшной аорты у мужчин составляет приблизительно 27 мм в переднезаднем размере на уровне диафрагмы перерыва, и постепенно сужается до 21 мм на уровне подвздошной бифуркации. У женщин диаметр аорты меньше на 3-5 мм.
Рис. 7. Коарктация аорты. (A) Предпроцедурный сагиттальный скан в серой шкале брюшной аорты показывает нормальный диаметр брюшной аорты. (B-D) Предпроцедурный спектральный допплеровский анализ показывает наличие медленной и малой формы пульсовой волны по всей брюшной аорте и обеим почечным артериям. (E) После стентирования магниторезонансная (МР) ангиография грудной клетки показывает постоянное очаговое сужение просвета нисходящей грудной аорты (стрелки), соответствующее остаточной коарктации.
Рис. 8. Окклюзия аорты. Спектральный (А), цветной и энергетический допплер, сагиттальное (В, D, Е), и поперечное (C) изображения аорты показывает кровоток только в проксимальном отделе брюшной аорты (стрелки А). Кровотока не видно ниже уровня ВБА, в соответствии с окклюзией аорты (звездочка А, В, D, Е) и правой подвздошной (звездочка D) артерии. ВБА служит коллатеральным источником для восстановления артериальных систем нижней конечности (стрелка в Е). (F) Высокорезистивные волны у пациента с СПС в ВБА до 180 см / с. (G) Сагиттальный КТ скан аорты показывает значительно кальцинированные бляшки по всей длине обтурированной брюшной аорты (звездочка). ВБА – расширена и продолжается до уровня таза (стрелка).
Развитие АБА
АБА обычно встречается при атеросклеротической болезни. Наиболее распространенными факторами риска являются: пожилой возраст, курение и гипертония. Другие факторы риска включают: семейный анамнез, заболевания соединительной ткани, гиперхолестеринемия, травма и инфекция. АБА связана с высокой смертностью, вызванной разрывом аневризмы. Разрыв АБА – 10-я по значимости причина смерности в Соединенных Штатах. АБА определяется, как увеличение переднезаднего (ПЗ) размера просвета аорты более чем на 30 мм. Большинство аневризм варьируют в диапазоне от 30 до 40 мм в ПЗ диаметре.
Патофизиология АБА и разрыв AБA
Знание патофизиологии аневризм имеет важное значение для понимания механизма развития аневризмы и ее разрыва. Образование АБА – результат дегенеративного процесса, который характеризуется ослаблением стенки брюшной аорты. Сначала происходит активация воспалительного процесса, отвечающего за продукцию и выделение матричных разрушающих ферментов, которые приводят к укорочению полураспада эластина и апоптозу клеток гладких мышц с развитием адгезивного мурального тромба. Деградация эластических волокон и коллагена приводит к ослаблению и, в конечном итоге, к разрыву стенки аорты. АБА более чем 5,5 см, связаны с 10% ежегодным риском разрыва, поэтому эти пациенты обычно нуждаются в хирургическом вмешательстве. Небольшие аневризмы также могут привести к разрыву, хотя ежегодный риск существенно меньше (1% в год).
Разрыв аневризмы вызывается неравномерным напряжением и деформацией аномально ослабленной стенки аневризмы. Высказывалось предположение, что внутристеночный тромб, обычно встречающийся в просвете АБА, связан с более высокой частотой разрыва, вызванного ослаблением брюшной стенки. Есть несколько факторов, которые способствуют прогрессированию аневризмы и последующему разрыву, в том числе напряжение брюшной стенки (соотношение между диаметром аорты и пульсовым давлением), напряжение и деформация стенки аневризмы и ее прочность на разрыв. Неравномерное распределение нагрузки на аорту приводит к очаговым различиям в прочности на разрыв, что ведет к неоднородной взаимосвязи между прочностью стенки и силой воздействия на нее. Если аневризма разрывается в области патологии стенки аорты, то силой воздействия на сосудистую стенку превышает предел ее прочности на разрыв. Эта закономерность определяется законом Лаплас, в котором говорится, что риск разрыва аневризмы напрямую связан с размером аневризмы, так как сила воздействия на стенку аорты является результатом суммации радиуса сосуда и кровяного давления.
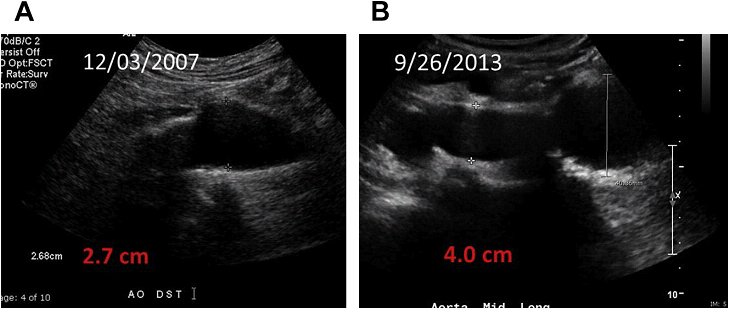
Темпы роста аневризм
АБА скрининг и наблюдение
Скрининг аневризм и регулярное последующее наблюдение известной аневризмы имеет важное значение, в связи с хроническим прогрессирующим характером роста аневризмы, высоким риском разрыва и последующей смерти при крупных аневризмах. Ультрасонография наиболее часто используется как метод скрининга и наблюдения за поциентами с АБА, с точностью исследования почти 100%. В настоящее время скрининг предлагается для мужчин старше 65 лет, а также людей с анамнезом курения. Различные исследования показали значительное снижение смертности от АБА в результате скрининга с 21% до 68%. Интервалы между проведением исследований зависят от размера аневризмы, хотя в настоящее время не существует единого мнения об оптимальных интервалах времени между наблюдениями. АБА, как правило, бессимптомна до момента разрыва.
Как упоминалось ранее, риск разрыва для малых АБА низкий, что говорит в пользу ожидательной тактики в таком случае. Исключения из этого правила включают пациентов с сахарным диабетом или заядлых курильщиков, чей риск разрыва выше. Более низкий порог выполнения операции для женщин также рассматривается, учитывая то, что у них более высокие темпы роста аневризмы и риск разрыва.
Типы АБА
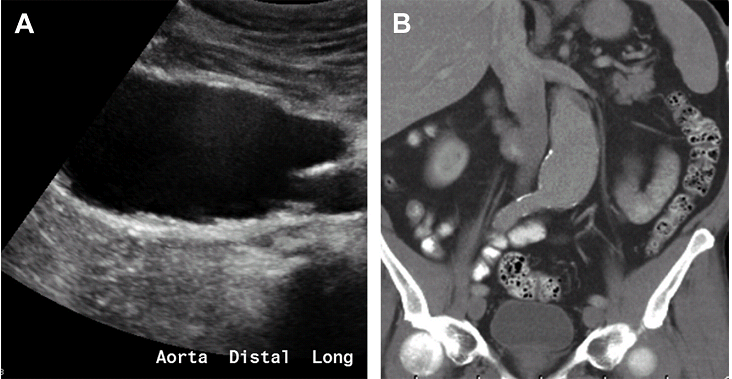
АБА можно разделить по местоположению, морфологии и причине. Что касается расположения, АБА могут быть класифицированны на супраренальные (наименее встречающиеся: травмы, инфекции, ятрогенные причины), юкстаренальные и инфраренальные (наиболее распространенные). Морфологические подкатегории включают: мешотчатые, веретеновидные, или по типу песочных часов (2 смежные, прерывающиеся аневризмы, разделенные нормальным сегментом аорты) аневризмы (Рис. 9).
Рис. 9. Веретенообразная аневризма аорты. Сагиттальный (А) и коронарный (В) КТ скан без контраста дистальной аорты показывает веретенообразное расширение аорты.