какие существуют медицинские изображения
Какие существуют медицинские изображения
Одним из приоритетных направлений развития медицины в России является переход на собственные инновационные технологии электронной регистрации, хранения, обработки и анализа медицинских изображений органов и тканей пациентов. Это вызвано увеличением объемов информации, представленной в форме изображений, при диагностике социально значимых заболеваний, прежде всего онкологических, лечение которых в большинстве случаев имеет результат только на ранних стадиях.
При проведении диагностики изображений стандарта DICOM [6] определяется патологическая область, при подтверждении ее патологического характера решается задача классификации: отнесение к какому-либо из известных видов или выявление нового класса. Очевидная сложность – дефекты получаемого изображения, обусловленные как физическими ограничениями оборудования, так и допустимыми пределами нагрузки на организм человека. В результате именно на программные средства ложится задача дополнительной обработки изображений с целью повысить их диагностическую ценность для врача, представить в более удобном виде, выделить главное из больших объемов получаемых данных.
Цель исследования. Разрабатываются математические методы сегментации изображений стандарта Dicom для задач распознавания медицинских изображений. Диагностика заболеваний зависит от квалификации исследователя и требует от него визуально проводить сегментацию, а математические методы по обработке растровых изображений являются инструментом для данной диагностики. Обработка полученных аппаратным обеспечением медицинских изображений без предварительной обработки графических данных в большинстве случаев дает неверные результаты. Это связано с тем, что изначально изображения получены неудовлетворительного качества.
Материал и методы исследования
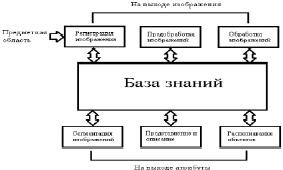
В качестве материала исследований используются компьютерные томограммы пациентов специализированного клинического учреждения. Прежде чем анализировать реальные графические данные, необходимо изображение подготовить или произвести предобработку. Этот этап решает задачу улучшения визуального качества медицинских изображений. Полезно разделить весь процесс обработки изображений на две большие категории: методы, в которых как входными данными, так и выходными являются изображения; методы, где входные данные – изображения, а в результате работы выходными данными выступают признаки и атрибуты, выявленные на базе входных данных. Этот алгоритм не предполагает, что к изображению используется каждый из вышеприведенных процессов. Регистрация данных – первый из процессов, отраженный на рис. 1.
Рис. 1. Основные стадии цифровой обработки графических данных
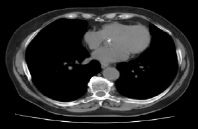
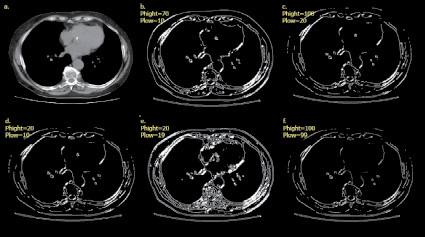
Регистрация может быть достаточно простой, как в примере, когда исходное изображение является цифровым. Обычно этап регистрации изображения предполагает предварительную обработку данных, к примеру, увеличение масштаба изображения. Улучшение изображения входит в число наиболее простых и впечатляющих направлений предварительной обработки. Как правило, за методами улучшения информативности изображений определена задача поиска плохо различимых пикселей или увеличения контрастности на исходном изображении [3]. Одним из часто используемых методов улучшения информативности изображений является усиление контраста изображения, так как усиливаются границы объекта интереса. Нужно учесть, что улучшение качества изображения – это в определенной степени субъективная задача в обработке изображений. Восстановление изображений – это задача также относится к повышению визуального качества данных. Методы восстановления изображений опираются на математические и вероятностные модели деформации графических данных. Обработку изображений как этап следует отделять от понятия обработки изображения как всего процесса изменений изображения и получения некоторых данных. Сегментация или процесс выделения объектов интереса делит изображение на составляющие объекты или части. Автоматизированное выделение объектов интереса является в определенной степени сложной задачей цифровой обработки изображений. Слишком детализированная сегментация делает процесс обработки изображения затруднительным, если необходимо выделить объекты интереса. Но некорректная или недостаточно детализированная сегментация в большинстве задач приводит к ошибкам на заключительном этапе обработки изображений. Представление и описание графических данных, как правило, следуют за этапом выделения объектов интереса на изображении, на выходе которого в большинстве случаев имеются необработанные пиксели, образующие границы области или формируют все пиксели областей. При таких вариантах требуется преобразование данных в вид, доступный для компьютерного анализа. Распознавание образов является процессом, который определяет к какому-либо объекту идентификатор (например, «лучевая кость») на основании его описаний [4]. Определим взаимосвязь базы знаний с модулями обработки изображений. База знаний (то есть информация о проблемной области) некоторым образом зашифрована внутри самой системы обработки изображений. Это знание может быть достаточно простым, как, например, детальное указание объектов изображения, где должна находиться зона интереса. Такое знание дает возможность ограничения области поиска. База знаний управляет работой каждого модуля обработки и их взаимодействием, что отражено на рис. 1 стрелками, направленными в две стороны между модулями и базой знаний. Сохранение и печать результатов часто также требует использования специальных методов обработки изображений. Недостаток этих этапов обработки изображения в системе обработки медицинских изображений заключается в том, то, что ошибки, созданные на первых этапах обработки, к примеру при вводе или выделения объектов интереса на изображении, могут привести к невозможности корректной классификации. Обработка данных производится строго последовательно, и в большинстве случаев отсутствует возможность возвращения на предыдущие этапы обработки, даже если ранее были получены некорректные результаты [2]. Методы на этапе предварительной обработки достаточно разнообразны – выделение объектов интереса, их масштабирование, цветовая коррекция, корректировка пространственного разрешения, изменение контрастности и т.п. Одно из приоритетных действий на этапе предварительной обработки изображения – это корректировка контрастности и яркости. При использовании соответствующих масок возможно объединить два этапа (фильтрация и предварительная обработка) для увеличения скорости анализа данных. Заключительный результат анализа изображений в большинстве случаев определен уровнем качества сегментации, а степень детализации объектов интереса зависит от конкретной поставленной задачи [4]. По этой причине не разработан отдельный метод или алгоритм, подходящий для решения всех задач выделения объектов интереса. Оконтуривание областей предназначено для выделения на изображениях объектов с заданными свойствами. Данные объекты, как правило, соответствуют объектам или их частям, которые маркируют диагносты. Итогом оконтуривания является бинарное или иерархическое (мультифазное) изображение, где каждый уровень изображения соответствует определенному классу выделенных объектов. Сегментация – это сложный этап в обработке и анализе медицинских данных биологических тканей, поскольку необходимо оконтуривать области, которые соответствуют разным объектам или структурам на гистологических уровнях: клеткам, органоидам, артефактам и т.д. Это объясняется высокой вариабельностью их параметров, низким уровнем контрастности анализируемых изображений и сложной геометрической взаимосвязью объектов. В большинстве случаях для получения максимально эффективного результата необходимо последовательно использовать разные методы сегментации объектов интереса на изображении. К примеру, для определения границ объекта интереса применяется метод морфологического градиента, после которого для областей, которые подходят незначительным перепадам характеристик яркости, проводится пороговая сегментация [8]. Для обработки изображений, у которых несвязанные однородные участки различны по средней яркости, был выбран метод сегментации Canny, исследования проводятся на клиническом примере. При распознавании реальных клинических изображений моделирование плохо применимо. Большое значение имеет практический опыт и экспертные заключения об итоге анализа изображений. Для тестового изображения выбран снимок компьютерной томографии, где в явном виде присутствует объект интереса, представленный на рис. 2.
Рис. 2. Снимок компьютерной томографии с объектом интереса
Для реализации сегментирования используем метод Canny [1, 5]. Такой подход устойчив к шуму и демонстрирует в большинстве случаев лучшие результаты по отношению к другим методам. Метод Canny включает в себя четыре этапа:
1) предобработка – размытие изображения (производим уменьшение дисперсии аддитивного шума);
2) проведение дифференцирования размытого изображения и последующее вычисление значений градиента по направлениям x и y;
3) реализация не максимального подавления на изображении;
4) пороговая обработка изображения [5, 7].
На первом этапе алгоритма Canny происходит сглаживание изображения с помощью маски фильтром Гаусса. Уравнение распределения Гаусса в N измерениях имеет вид
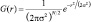
или в частном случае для двух измерений
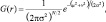
где r – это радиус размытия, r 2 = u 2 + v 2 ; σ – стандартное отклонение распределения Гаусса.
Если используем 2 измерения, то эта формула задает поверхность концентрических окружностей, имеющих распределение Гаусса от центральной точки. Пиксели с распределением, отличным от нуля, используются для задания матрицы свертки, применяемого к исходному изображению. Значение каждого пикселя становится средневзвешенным для окрестности. Начальное значение пикселя принимает максимальный вес (имеет максимальное Гауссово значение), а соседние пиксели принимают минимальные веса, в зависимости от расстояния до них [1]. Теоретически распределение в каждой точке изображения должно быть ненулевым, что следует расчету весовых коэффициентов для каждого пикселя изображения. Но практически при расчёте дискретного приближения функции Гаусса не учитываются пиксели на расстоянии > 3σ, поскольку оно достаточно мало. Таким образом, программе, обрабатывающей изображение, необходимо рассчитать матрицу [6σ]×[6σ], чтобы дать гарантию достаточной точности приближения распределения Гаусса [8].
Результаты исследования и их обсуждение
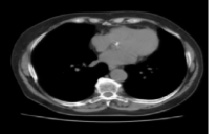
Результат работы фильтра Гаусса при данных равных 5 для размера маски гаусса и 1,9 значении параметра σ – стандартного отклонения распределения Гаусса, представлен на рис. 3. Следующим шагом осуществляется поиск градиента области интереса при помощи свертки сглаженного изображения с производной от функции Гаусса в вертикальном и горизонтальном направлениях вектора.
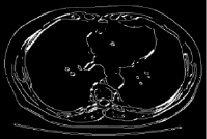
Применим оператор Собеля для решения данной задачи [7]. Процесс базируется на простом перемещении маски фильтра от пикселя к пикселю изображения. В каждом пикселе (x, y) отклик фильтра вычисляется с предварительно определённых связей. В результате происходит первоначальное выделение краев. Следующим шагом происходит сравнение каждого пикселя с его соседями вдоль направления градиента и вычисляется локальный максимум. Информация о направлении градиента необходима для того, чтобы удалять пиксели рядом с границей, не разрывая саму границу вблизи локальных максимумов градиента, которое значит, что пикселями границ определяются точки, в которых достигается локальный максимум градиента в направлении вектора градиента. Такой подход позволяет существенно снизить обнаружение ложных краев и обеспечивает толщину границы объекта в один пиксель, что эмпирически подтверждается программной реализацией алгоритма сегментирования среза брюшной полости на снимке компьютерной томографии, представленного ниже на рис. 4.
Следующий шаг – использование порога, для определения нахождения границы в каждом заданном пикселе изображения. Чем меньше порог, тем больше границ будет находиться в объекте интереса, но тем более результат будет восприимчив к шуму, и оконтуривать лишние данные изображения. Высокий порог может проигнорировать слабые края области или получит границу несколькими областями. Оконтуривание границ применяет два порога фильтрации: если значение пикселя выше верхней границы – он принимает максимальное значение (граница считается достоверной), если ниже – пиксель подавляется, точки со значением, попадающим в диапазон между порогов, принимают фиксированное среднее значение. Пиксель присоединяется к группе, если он соприкасается с ней по одному из восьми направлений. Среди достоинств метода Canny можно считать то, что при обработке изображения осуществляется адаптация к особенностям сегментирования. Это достигается через ввод двухуровневого порога отсечения избыточных данных. Определяются два уровня порога, верхний – phigh и нижний – plow, где phigh > plow. Значения пикселей выше значения phigh обозначаются как соответствующие границе (рис. 5).
Рис. 3. Применение фильтра Гаусса на компьютерной томограмме с объектом интереса
Рис. 4. Подавления не-максимумов на сегментируемом изображении
Рис. 5. Применение алгоритма сегментации Canny c разными значениями уровней порога
Практика показывает, что имеется некоторый интервал на шкале уровней порога чувствительности, при котором значение площади объекта интереса фактически неизменимое, но при этом существует определенный пороговый уровень, после которого отмечается «срыв» метода оконтуривания и итог выделения областей интереса становится неопределенным [8]. Этот недостаток алгоритма, который можно компенсировать объединением алгоритма Canny с преобразованием Хафа для поиска окружностей. Сочетание алгоритмов позволяет максимально четко выделять объекты исследования, а также устранять разрывы в контурах [7].
Выводы
Таким образом, решена задача формулирования типовых характеристик патологических объектов на медицинских изображениях, что даст возможность в дальнейшем проводить оперативный анализ данных по конкретным патологиям. Важными параметрами для определения оценки качества сегментации являются вероятности ложной тревоги и пропуска – отказа. Эти параметры определяют применение автоматизации метода анализа. Сегментация при решении задачи классификации и распознавания объектов на изображениях является одной из первостепенных. Достаточно хорошо исследованы и применяются методы оконтуривания, базирующиея на сегментировании границ областей – Sobel, Canny, Prewit, Laplassian. Такой подход определен тем, что концентрация внимания человека при анализе изображений фокусируется зачастую на границах между более или менее однородными по яркости зонами. Исходя из этого, контуры часто выполняют задачу основы определения различных характеристик для интерпретирования изображений и объектов на них. Основная задача алгоритмов сегментирования зон интересов – это построение бинарного изображения, которое содержит замкнутые структурные области данных на изображении. Относительно к медицинским изображениям данными областями выступают границы органов, вены, МКЦ, а также опухоли. Разработанные принципы компьютерного автоматизированного анализа медицинских изображений эффективно используются как для оперативных задач медицинской диагностики специализированного онкологического учреждения, так и в учебных целях.
Исследовано при поддержке программы «Дальний Восток», грант № 15-I-4-014o.
Рецензенты:
Косых Н.Э., д.м.н., профессор, главный научный сотрудник, ФГБУН «Вычислительный центр» ДВО РАН, г. Хабаровск;
Левкова Е.А., д.м.н., профессор, ГОУ ВПО «Дальневосточный государственный университет путей сообщения», г. Хабаровск.
Медицинское изображение как объект медицинской
Информатики
Все разнообразие медицинских изображений, независимо от способов их получения может быть отнесено к одной из двух основных групп: аналоговое и цифровое (матричное) изображение.
К аналоговым изображениям относятся те, которые несут в себе информацию непрерывного характера. Например, изображение на обычных рентгенограммах, сцинтиграммах, термограммах. Аналоговые сигналы – это непрерывные сигналы, в них присутствует много лишней информации.
К цифровым (матричным) изображениям относятся такие, которые получаются с помощью компьютера. Они имеют в своей основе матрицу, которая находится в памяти ПК. Матричными изображениями являются образы, которые получены при компьютерной томографии, цифровой рентгенографии, МР-томографии, ЭВМ-сцинтиграфии с компьютерной обработкой информации, ультразвуковом сканировании. Таким образом матричные изображения в отличие от аналоговых имеют дискретный характер. Поскольку в основе матричных изображений лежит компьютеризированная технология, они становятся доступными для разнообразной обработки с помощью ЭВМ.
Надо отметить, что аналоговые изображения могут быть преобразованы в матричные и, наоборот матричные – в аналоговые. С этой целью применяют специальные устройства: аналогово-цифровые (АЦП) и цифро-аналоговые (ЦАП) преобразователи.
Матричное изображение формируется путем сканирования электронным лучом по строкам. Тем самым создается возможность для восприятия изображения в реальном времени. Для этого применяется специальный дисплейный процессор, который через систему связи (интерфейс) подключен к основной ЭВМ. Память дисплейного процессора организована в виде матрицы, каждому элементу которой отвечает свой участок дисплея. Подобная элементарная единица памяти получила название «пиксель» (от англ. pixel = picture element – элементарная единица плоского изображения). Таким образом вся площадь экрана дисплея представляет собой матрицу – совокупность пикселей. В лучевой диагностике площадь дисплея может формироваться в виде следующих матриц: 32х32; 64х64; 128х128; 256х256; 512х512; 1024х1024 пикселей. Чем на большее количество пикселей разбивается площадь дисплея, тем выше разрешающая способность системы отображения.
Каждый пиксель изображения записывается в памяти различным количеством бит – от 2 до 16. Чем большим количеством бит информации представлен каждый пиксель изображения, тем лучше изображение по своим зрительным качествам и тем больше информации оно содержит об исследуемом объекте. Так, 6-битный пиксель (байтовая система записи пикселя), что чаще всего используется в ультразвуковой диагностике, содержит 2 6 = 64 оттенка серого цвета (от черного до белого). В радионуклидной диагностике используют преимущественно 8-битный пиксель, у него 2 8 = 256 градаций, то есть уровней серого. Нетрудно подсчитать, что матричное изображение 64х64 пикселей в радионуклидной диагностике требует 4096 байт памяти, а изображение 128х128 пикселей – 16384 байт.
Более совершенные системы радионуклидной диагностики имеют изображения 256х256 и даже 512х512 пикселей. Для формирования таких изображений необходимо при 8-битном пикселе порядка 64 и 256 килобайт памяти компьютера, соответственно. Увеличение объема задействованной памяти неминуемо приводит к снижению скорости обмена информацией, что сопровождается увеличением времени, необходимо для построения каждого кадра изображения. Поэтому детализованные растры (256х256 и 512х512) применяют преимущественно для получения статических изображений, т.е. в диагностике очаговых изменений в органах, тогда как грубые растры (64х64 и 128х128) используют главным образом для динамических исследований.
Все медицинские изображения в лучевой диагностике могут существовать в виде твердых копий – рентгенограмм, оттисков на бумаге, фотобумаге; на магнитных носителях-лентах, дисках; или в нефиксированном виде – на экране дисплея или рентгенодиагностического аппарата.
Объекты медицинского изображения можно разделить на твердые фрагменты (кости) и фрагменты, которые могут деформироваться (структуры мягкой ткани); или на статические фрагменты (череп) и динамические (сердце, подвижные соединения).
Дата добавления: 2018-11-24 ; просмотров: 433 ; Мы поможем в написании вашей работы!
МЕДИЦИНСКОЕ ИЗОБРАЖЕНИЕ КАК ОБЪЕКТ ИНФОРМАТИКИ
Главным источником диагностической информации, получаемой с помощью средств лучевой диагностики, являются медицинские изображения органов (medical images). Многообразные медицинские образы независимо от способа их получения — рентгенологического, ультразвукового, радионуклидного или магнитно-резонансного — могут быть объединены в две основные группы: аналоговые и цифровые (дигитальные); имеется также промежуточный вариант — аналого-цифровые.
К аналоговым изображениям относят такие, в которых заключена информация непрерывного характера. Подобные изображения являются основными при восприятии человеком окружающего его мира. Эти изображения предъявляют врачу для распознавания заболеваний. Всем аналоговым изображениям, включая медицинские, свойствен ряд недостатков. В частности, затруднены их компактное хранение, обработка в соответствии с потребностями диагностики, передача от пользователя к пользователю. В них всегда много лишних сигналов, или шумов, которые ухудшают их качество.
Всеэтих недостатков лишены дигитальные (цифровые) медицинские изображения. Они имеют в своей основе ячеистую структуру (матрицу), содержащую информацию (в виде цифр) об органе, которая поступила из датчиков диагностического аппарата. С помощью компьютера из хранящихся в матрице сигналов по сложным алгоритмам создается (реконструируется) изображение органов. Дигитальные изображения характеризуются высоким качеством, отсутствием посторонних сигналов (шумов). Их легко сохранять на различных магнитных, оптических и магнитно-оптических цифровых носителях, легко обрабатывать на компьютере и пересылать на большие расстояния по сетям телекоммуникации.
Аналого-цифровые изображения имеют сложную «историю». Первоначально они создаются как аналоговые, затем в процессе передачи от детектора до дисплея оцифровываются и на этом этапе как всякие дигитальные изображения имеют все перечисленные выше достоинства. Вместе с тем наличие обязательного аналогового этапа неизбежно обусловливает все уже отмеченные недостатки, характерные для изображений такого рода.
Необходимо отметить, что аналоговые изображения могут быть преобразованы в матричные и, наоборот, матричные — в аналоговые. Оцифровку аналоговых изображении и ввод их в память компьютера осуществляют с помощью специальных считывающих устройств — сканеров.
Ниже сгруппированы медицинские изображения и методы лучевой диагностики, с помощью которых их получают.
• традиционная пленочная рентгенография, в том числе линейная томография,
• сонография (некоторые разновидности).
• цифровая рентгенография (вторичная оцифровка рентгенограмм),
• цифровая субтракционная ангиография,
• сонография (некоторые разновидности),
• первично-цифровые методы рентгенографии,
• эмиссионная томография (одно- и двухфотонная),
Представление диагностических изображений на дисплее может иметь двоякий характер. Векторные изображения состоят из набора элементарных линий и кривых, описываемых математическими формулами в виде математических объектов, называемых векторами. Последние имеют графическую характеристику и могут изменяться врачом в соответствии с выбранными программами без ухудшения качества изображения.
Матричные изображения имеют в своей основе растр, состоящий из большого числа ячеек — пикселов (от англ. picture — картина, cell — клетка, наименьший визуальный элемент на экране дисплея). Пространственное разрешение матричных изображений тесно связано с количеством содержащихся в них пикселов. Вследствие этого при обработке такого изображения, связанной с изменением его размеров (всего или отдельных деталей), распечаткой на принтере с разрешающей способностью, отличающейся от таковой на экране, оно может в значительной степени деформироваться —-появляется зубчатость контуров, исчезают детали изображения. Матричные изображения формируются на растровом дисплее аналогично тому, как это происходит на экране телевизора, т.е. путем сканирования электронным лучом по строкам. Тем самым создается режим восприятия изображения в реальном времени. Для создания матричного изображения применяют специальный дисплейный процессор, который через систему связи (интерфейс) подключен к оперативной памяти компьютера.
Каждому из элементов матрицы изображения на экране дисплея соответствует определенный участок адресуемой памяти. Таким образом, вся площадь растрового дисплея содержит совокупность пикселов, имеющую свою размерность. В лучевой диагностике экранная площадь дисплея обычно формируется в виде следующих матриц: 64×64, 128×128, 256×256, 512×512, 1024×1024 пикселов. Чем больше число пикселов, на которое разбивается экранная площадь дисплея, тем выше разрешающая способность системы отображения. Чем крупнее матрица изображения, тем более фрагментарным оно представляется наблюдателю (рис. 11.60).
Каждый пиксел изображения формируется в памяти дисплейного процессора различным числом бит — от 1 до 24. Чем большим количеством бит информации представлен каждый пиксел изображения, тем богаче изображение по своим зрительным свойствам и тем больше информации об исследуемом объекте оно содержит. Так, 2-битный пиксел содержит всего 2 2= 4 уровня передачи изображения, 8-битный (однобайтный) —- 256, 24-битный пиксел имеет свыше 16 млн вариантов. Количество бит, содержащихся в одном пикселе, называют его глубиной. Чем больше глубина пиксела, тем качественнее изображение. Оптимальным вариантом черно-белого изображения является однобайтный пиксел, который содержит 256 градаций серого цвета (от белого — 0 до черного — 256),— так называемая стандартная серая шкала.
При изображении в цвете наилучшим вариантом является трехбайтный пиксел, который содержит 16,7 млн цветов <стандарт RGB — Red, Green, Blue — красный, зеленый, голубой). Однако такая палитра цветов требует большого объема памяти компьютера, поэтому в медицинской практике чаще применяют упрощенный, так называемый индексированный, цвет — однобайтный, который содержит 256 цветов. Он несколько хуже по качеству, зато намного рациональнее расходует память компьютера. Кроме того, он быстрее и проще передается по линиям компьютерной связи. И все же 156
Рис. 11.60. Влияние величины матрицы на качество изображения.
а — матрица размером 64×64; б — 128×128; в — 256×256; г — 512×512 пикселов.
для ускорения передачи изображений и более рационального хранения в компьютерной памяти их сжимают (т.е. производят их компрессию) специальными программами в несколько раз, или архивируют. При обратном процессе — разархивировании — качество изображения восстанавливается практически до исходного. Для передачи изображений от компьютера к компьютеру их рекомендуется переводить в один из стандартных форматов, наиболее универсальным из которых является TIFF (Target-Image File Format — целевой файловый формат изображения).
В ультразвуковой диагностике чаще используют 6-битный пиксел, у которого 2 6 =64 оттенка серого цвета (от черного до белого). В радионуклидной диагностике применяют преимущественно 8-битный пиксел (байтная система формирования пиксела), в котором 2 8 =256 вариантов оценок, т.е. уровней серой шкалы или цвета. Нетрудно подсчитать, что матричное изображение размером 64×64 пикселов в радионуклидной диагностике требует
4096 байт памяти, а изображение размером 128×128 пикселов — 16 384 байт, т.е. около 16 Кбайт (приблизительно столько, сколько занимает одна страница машинописного текста).
Более совершенные системы радионуклидной диагаостики имеют изображение размером 256×256, 512×512 и даже 1024×1024 пикселов. Для формирования таких образов при соответствующем 8-битном пикселе нужно занять в памяти компьютера соответственно 64, 256 и около 1000 Кбайт (1 Мбайт) памяти. Увеличение объема памяти неизбежно приводит к снижению скорости обмена информацией, что сопровождается увеличением времени, необходимого для построения каждого кадра изображения. В связи с этим мелкие растры (256×256 и 512×512) применяют преимущественно для получения статических изображений с высоким пространственным разрешением, т.е. в диагностике очаговых поражений в органах, тогда как крупные матрицы (64×64 и 128×128) используют главным образом для динамических исследований.
В компьютерной томографии используют 2-баЙтные пикселы (16-битные). При размерах матрицы 512×512 на получение одной компьютерной томограммы будет затрачиваться 412 кбайт памяти компьютера. Приблизительно такой же объем памяти необходим для получения МР-томограммы.
В дигитальной рентгенографии и рентгеноскопии применяют дисплей с очень мелкой матрицей — 1024×1024 пикселов. Такое изображение практически неотличимо от обычного полутонового аналогового. Однако для получения этого изображения нужно свыше 1 Мбайт памяти компьютера. Еще больший объем компьютерной памяти — свыше 2 Мбайт — необходим для построения одного кадра в дигитальной субтракционной ангиографии.
Для работы цветных дисплеев, наиболее широко применяемых в радионуклидной диагностике и допплеровском картировании, требуется память компьютера, в 3 раза большая, чем для черно-белых, по количеству основных цветов <стандарт RGB). Понятно, что для реализации такой задачи нужны высокопроизводительные компьютеры с большим объемом дисковой и оперативной памяти и развитым программным обеспечением.
Все медицинские изображения в лучевой диагностике могут существовать в двух вариантах: в виде твердых копий — рентгенограмм, отпечатков на бумаге, фотобумаге — ив электронном виде — на экране дисплея, магнитных носителях, оптических дисках и пр. Здесь уместно еще раз напомнить, что емкость одной стандартной трехдюймовой дискеты составляет 1,44 Мбайта, оптического диска CD-ROM — 640 Мбайт, магнитно-оптического диска — 2 Гбайт, жесткого диска (винчестера) персонального компьютера — несколько Гбайт. Скорость передачи информации по современным коммуникационным системам в настоящее время обычно не превышает 1200—3600 бит/с. Таковы «взаимоотношения» медицинских изображений и современных цифровых способов их хранения и передачи.
Получить функциональное изображение I типа, т.е. исследовать двигательную активность органов, можно на экране рентгенодиагностического
Функциональные изображения II типа получают для изучения экскреторной функции органа. С этой целью применяют радиофармпрепараты и рентгеноконтрастные вещества, избирательно и быстро захватываемые из крови исследуемыми органами. Таким путем изучают, например, функцию печени, почек, желчевыделительной системы.
Функциональные изображения III типа — метаболические. Их применяют преимущественно в радионуклидной диагностике. С этой целью в организм пациента вводят РФП, включающийся в обмен веществ в исследуемом органе. Так, например, в сердечной мышце активно поглощается и утилизируется меченая глюкоза, поэтому интенсивность изображения сердечной мышцы на сцинтиграммах после введения в организм этого РФП будет отражать перфузию миокарда и метаболическую активность сердечной мышцы. Этот же РФП активно метаболизируется мозговой тканью, в связи с чем он может быть использован для получения функциональных изображений головного мозга.
Существенным преимуществом дигитальных изображений является возможность их компьютерной обработки. Первый этап такой обработки — предварительный. Его осуществляют во время сбора информации, т.е. в момент получения самого изображения. С этой целью проводят коррекцию изображения с целью «выправления» технических дефектов детекторов излучений, например неоднородности в чувствительности по полю большого сцинтилляционного кристалла гамма-камеры или линейки ультразвуковых датчиков. На этом же этапе осуществляют коррекцию физиологических факторов, ухудшающих изображение. Например, при радионуклидном исследовании почек исключают влияние радиоактивности, находящейся в кровеносных сосудах и окружающих мягких тканях, при исследовании печени необходимо учесть и исключить динамическую нерезкость, вызванную ее дыхательными перемещениями.
Следующий этап обработки изображений — аналитический. Его проводят во время анализа изображений. Так, с целью улучшения качества изображения можно провести процедуру сглаживания, т.е. выравнивание не-однородностей, контрастирование органов путем отсечения окружающего орган фона, который мешает зрительному восприятию исследуемого органа. Можно выполнить также дополнительное раскрашивание отдельных участков изображения, что также улучшит качество его восприятия.
Для того чтобы улучшить выявление патологических очагов в органе, проводят изосчетные кривые, т.е. линии, соединяющие точки изображения с одинаковым накоплением РФП или одинаковой оптической плотностью. Иногда целесообразно построить профилограмму — горизонтальную линию, проходящую через весь исследуемый орган. Такая линия покажет распреде-
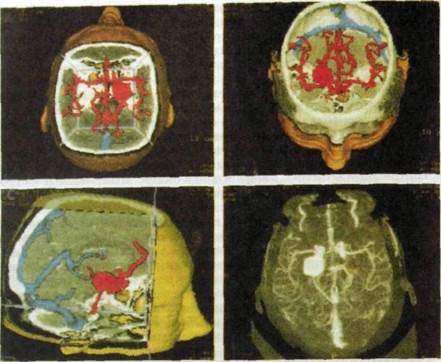
рис. 11.61. Компьютерное совмещение изображений сосудистой системы головного мозга, полученных с помощью магнитно-резонансной и компьютерной рентгеновской томографии (так называемые спаянные изображения).
ление РФП вдоль горизонтальной или вертикальной оси, т.е. получится как бы срез органа по этой линии. С помощью специальных алгоритмов можно построить аксонометрическое, или псевдообъемное, изображение органа. Естественно, все указанные выше преобразования выполняют с помощью компьютера по заложенным в него прикладным программам.
Своеобразной формой обработки изображения является «алгебра кадров*: сложение или вычитание нескольких изображений органа с помощью компьютера. Таким путем, например, получают изолированное изображение сосудов при дигитальной субтракнионной ангиографии или изображение пара щитовидных желез при сцинти графин.
Аналогичный прием используют для повышения контрастности изображения опухолей и «привязки» его к анатомическим ориентирам. При этом складывают два кадра — изображения опухоли и того участка тела, где эта опухоль выявлена. Новое направление обработки изображений — совмещение изображений, полученных посредством разных методов исследования, например компьютерно-томографического и магнитно-резонансного (рис. 11.61). Такие суммарные изображения носят название «спаянные».
С помощью компьютера можно обрабатывать кривые, полученные при анализе медицинских изображений. Можно, например, сгладить (апрокси-
мировать) эти кривые, т.е. сделать их визуально более наглядными. Специальные прикладные программы позволяют провести на компьютере математическое моделирование изучаемых функций, что помогает выявить патологические изменения и оценить степень их выраженности.
Выделение «зон интереса» — один из основных этапов обработки диагностических изображений на компьютере. «Зона интереса» — это участок изображения органа (рентгенологического, ультразвукового, магнитно-резонансного, радионуклидного), который представляет наибольший интерес для диагностики.
«Зоной интереса» может быть весь орган или его часть. На одном изображении возможно несколько «зон интереса», например исследуемый орган, окружающие его ткани, пучок питающих орган сосудов, соседние органы. Применительно к отдельному органу такими «зонами интереса» могут быть, в частности, кортикальный слой и выделительная система органа (например, у почки — см. рис. 1.16).
Форму, размеры и количество «зон интереса» врач выбирает произвольно в зависимости от вида исследования и конкретных задач диагностики; делается это с помощью курсора на экране дисплея либо автоматически по специальным программам обработки изображений. Выбранную «зону интереса» изучают отдельно или же во взаимосвязи с другими. В этой зоне с помощью компьютера можно проследить прохождение рентгеноконтраст-ного вещества или РФП. Построенные на основании результатов такого анализа кривые — гистограммы отражают функцию органа (или его части). В «зонах интереса» можно определить оптическую плотность изображения органа, выявить и оценить степень неоднородности его ткани.
Перспективным направлением использования компьютера для анализа медицинских изображений является их автоматизированный анализ. Особенно эффективна такая обработка при массовых проверочных исследованиях, например при флюорографии грудной полости или маммографии. С помощью особо сложных компьютерных систем, состоящих из нескольких десятков и даже сотен высокопроизводительных процессоров (так называемые нейрокомпьютеры), удается автоматизировать процесс распознавания заболеваний. Для этого такие системы предварительно длительное время «обучают» на большом клиническом материале, т.е. создают «базу знаний» по данному предмету.
Вычислительную технику все шире используют в медицинской практике. В некоторых клиниках более половины информации о больном поступает к врачу после компьютерной обработки. Это не только медицинские изображения, но и электронная система документооборота, локальные внутри-больничные, региональные и мировые компьютерные сети. Все большее распространение получает телемедицина как средство общения и профессиональной деятельности. Традиционная система врач—больной заменяется на более сложную: больной — компьютер — врач. В связи с этим уже на студенческой скамье чрезвычайно важно овладеть основами медицинской информатики и компьютерной техники, научиться использовать компьютерную технологию в повседневной врачебной деятельности.
Конечно, компьютеризация медицины ни в коей мере не умаляет роли врача. Это была, есть и будет гуманитарная специальность! Никогда — ни
сейчас, ни в будущем — компьютер не заменит врача у постели больного, хотя бы потому, что он лишен важнейшего свойства человеческой личности — сострадания! Как остроумно заметил один ученый: «Отвечать на вопросы, которых никто не задавал,— это то, чего не может машина, а человеческий мозг может». Более того, умелое применение вычислительной техники подчеркивает значение деонтологии, гуманизм врача. В компьютерный век только от него зависит, сколько останется «человеческой» медицины. Политику в лучевой диагностике должен определять врач: «Но о главном не забудь: ты владыка, в этом суть!» (Г. Абашидзе).
Медицинские научные деятели происходят из всей массы медицинского сословия: всякий практический врач, раз он обладает умом, энергией и талантом, может проявить свое участие в общей медицинской наше и сложиться в постоянного и крупного медицинского деятеля.
Как-то Владимир Маяковский не без иронии заметил, что книги пишут для того, чтобы случилось что-нибудь новое, а редакторы существуют для того, чтобы ничего не случилось. Почему нам вспомнились эти слова? Потому что мы опасались, что рецензенты учебника (а от них зависит решение о его издании) предложат нам отказаться от данного раздела во второй части книги. С мягкой укоризной они укажут, что для разработки и усовершенствования методов и средств исследования требуются глубокие знания предмета и наивно предлагать соответствующие задания студентам.
Тогда мы на очередной лекции, рассказав об основных способах получения лучевых изображений, предложили студентам 3-го курса тут же придумать новые методы, которые можно было бы использовать для этой цели. Из всех полученных в ответ записок приведем три (без изменения стиля авторов).
1. «Почему бы органы не зазвучали? Пропускаем узкий пучок электромагнитных волн. Меняя частоту, достигаем резонанса в той или иной ткани, органе и т.д. Регистрируя резонансное излучение, преобразуем электромагнитные волны в звуковые. Сравниваем с эталоном (лучше всего для парных органов). Любовь — мелодия, жизнь — серенада, пусть болезнь станет симфонией!».
2. «Для диагностики новообразований. Слабый электрический ток проходит сквозь тело. Опухоль имеет большее сопротивление. Экран с помощью осциллографа регистрирует».
3. «А что если сделать радионуклидное исследование отдельной клетки, сравнивая с электронограммой и радионуклидной сканограммой нормальной клетки. При тадсом способе мы сможем проникнуть не только в отдельные структурные компоненты клетки, выделяя какие-то патологические процессы в ней, но и еще глубже. Но насколько это технически осуществимо?»
Заметьте, что эти записки были получены нами более 15 лет назад, до выхода первого издания данного учебника! Поэтому мы смело выдвигаем несколько проблем и в заключение второй части учебника.
Первое и главное предложение: не на ходу или во время лекции, а после глубокого обдумывания попытайтесь отыскать идею принципиально нового метода получения лучевых изображений. Сумел же это сделать А. Кор-мак (идея компьютерной томографии) или Пауль Лаугербур (идея магнитно-резонансного изображения).
Второе предложение: изучение экономики лучевых исследований. В России этой проблемой долгое время никто не интересовался. Только в связи с развитием страховой медицины появились расчеты стоимости рентгенологических, ультразвуковых, радионуклидных и других процедур. Однако, во-первых, эти расчеты далеко не просты и не всегда корректны. Во-вторых, не проведено сопоставление экономичности разных лучевых методик в зависимости от их эффективности при конкретных патологических состояниях.
Третье предложение: необходимо, исходя из теории массового обслуживания, определить потребность во всех видах лучевой диагностики в различных регионах страны, в лечебных учреждениях разного типа и т.д.
Разумеется, все это — крупные проблемы, но ведь «великая энергия рождается для великих целей». Однако важно решать и частные задачи. Их в данной области неисчислимое количество. Речь идет об отдельных изобретениях и рационализаторских предложениях по усовершенствованию существующих лучевых методик. В качестве примера укажем некоторые направления таких исследований: 1) улучшение подготовки больных, в частности для рентгенологических и ультразвуковых процедур; 2) усовершенствование средств защиты пациентов и персонала при рентгенологических исследованиях; 3) повышение качества и надежности детекторов излучения; 4) разработка способов обработки материалов лучевых исследований для повышения их информативности; 5) разработка оптимальных средств и способов передачи лучевых изображений по локальным и национальным сетям.
Часть

От нЩ) кфной феЗи до Sbtcmd moliat стояния Сатфш ЯраЗ^вшнл все трудности З&сшннотк. Я^сколъЗнр от olcoS tax xnmjjocmei н уловок. КтфднЛ yfat стал ^аМяЗан, <фот ука емфтн.