какие типы гибридизации атомов углерода бывают
3.2. Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа.
Большинство органических соединений имеют молекулярное строение. Атомы в веществах с молекулярным типом строения всегда образуют только ковалентные связи друг с другом, что наблюдается и в случае органических соединений. Напомним, что ковалентным называется такой вид связи между атомами, который реализуется за счет того, что атомы обобществляют часть своих внешних электронов с целью приобретения электронной конфигурации благородного газа.
По количеству обобществлённых электронных пар ковалентные связи в органических веществах можно разделить на одинарные, двойные и тройные. Обозначаются данные типы связей в графической формуле соответственно одной, двумя или тремя чертами:
Кратность связи приводит к уменьшении ее длины, так одинарная С-С связь имеет длину 0,154 нм, двойная С=С связь – 0,134 нм, тройная С≡С связь – 0,120 нм.
Типы связей по способу перекрывания орбиталей
Как известно, орбитали могут иметь различную форму, так, например, s-орбитали имеют сферическую, а p-гантелеобразную форму. По этой причине связи также могут отличаться по способу перекрывания электронных орбиталей:
• ϭ-связи – образуются при перекрывании орбиталей таким образом, что область их перекрывания пересекается линией, соединяющей ядра. Примеры ϭ-связей:
• π-связи – образуются при перекрывании орбиталей, в двух областях – над и под линией соединяющей ядра атомов. Примеры π-связей:
Как узнать, когда в молекуле есть π- и ϭ-связи?
При ковалентном типе связи ϭ-связь между любыми двумя атомами есть всегда, а π-связь имеет только в случае кратных (двойных, тройных) связей. При этом:
Укажем данные типы связей в молекуле бутин-3-овой кислоты:
Гибридизация орбиталей атома углерода
Гибридизацией орбиталей называют процесс, при котором орбитали, изначально имеющие разные формы и энергии смешиваются, образуя взамен такое же количество гибридных орбиталей, равных по форме и энергии.
В случае атомов углерода в гибридизации всегда принимает участие s-орбиталь, а количество p-орбиталей, которые могут принимать участие в гибридизации варьируется от одной до трех p-орбиталей.
Как определить тип гибридизации атома углерода в органической молекуле?
| Количество атомов, с которыми связан атом углерода | Тип гибридизации атома углерода | Примеры веществ |
| 4 атома | sp 3 | CH4 – метан |
| 3 атома | sp 2 | H2C=CH2 – этилен |
| 2 атома | sp | HC≡CH — ацетилен |
Потренируемся определять тип гибридизации атомов углерода на примере следующей органической молекулы:
Радикал. Функциональная группа
Под термином радикал, чаще всего подразумевают углеводородный радикал, являющийся остатком молекулы какого-либо углеводорода без одного атома водорода.
Название углеводородного радикала формируется, исходя из названия соответствующего ему углеводорода заменой суффикса –ан на суффикс –ил.
| Формула углеводорода | Название углеводорода | Формула радикала | Название радикала |
| CH4 | метан | -CH3 | метил |
| C2H6 | этан | -С2Н5 | этил |
| C3H8 | пропан | -С3Н7 | пропил |
| СnН2n+2 | …ан | -СnН2n+1 | … ил |
Функциональная группа — структурный фрагмент органической молекулы (некоторая группа атомов), который отвечает за её конкретные химические свойства.
В зависимости того, какая из функциональных групп в молекуле вещества является старшей, соединение относят к тому или иному классу.
R – обозначение углеводородного заместителя (радикала).
Радикалы могут содержать кратные связи, которые тоже можно рассматривать как функциональные группы, поскольку кратные связи вносят вклад в химические свойства вещества.
Если в молекуле органического вещества содержится две или более функциональных группы, такие соединения называют полифункциональными.
Гибридизация атомных орбиталей
Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа.
Типы связей в молекулах органических веществ
Одна из характеристик химических связей — тип перекрывания орбиталей атомов в молекуле.
По характеру перекрывания различают σ-(сигма) и π‑(пи) связи.
| σ-Связь — это связь, в которой перекрывание орбиталей происходит вдоль оси, соединяющей ядра атомов. |
σ-Связь может быть образована любыми типами орбиталей (s, p, d, гибридизованными).
σ-Связь — это основная связь в молекуле, которая преимущественно образуется между атомами.
Между двумя атомами возможна только одна σ-связь.
 |  |
 |  |
 |  |
| π-Связь — это связь, в которой перекрывание орбиталей происходит в плоскости, перпендикулярной оси, соединяющей ядра атомов, сверху и снизу от оси связи. |
π-Связь образуется при перекрывании только р- (или d) орбиталей, перпендикулярных линии связи и параллельных друг другу.
π-Связь является дополнительной к σ-связи, она менее прочная и легче разрывается при химических реакциях.
С–С, С–Н, С–О
С=С, С=О
С≡С, С≡N
Гибридизация атомных орбиталей углерода
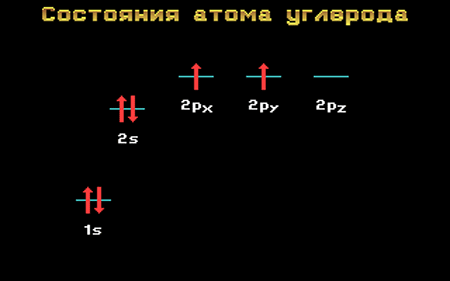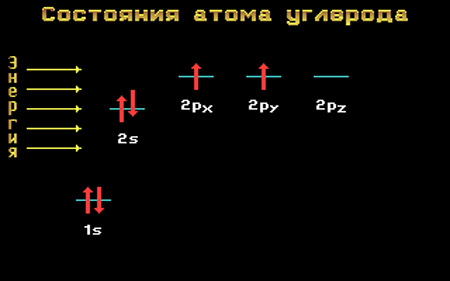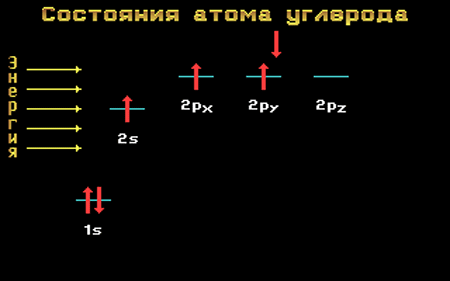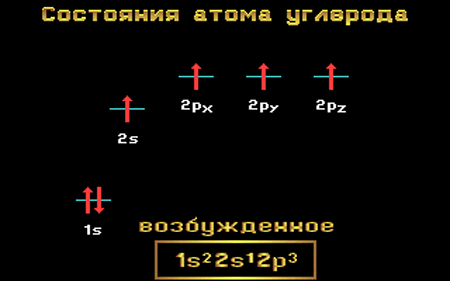
Электронная формула атома углерода в основном состоянии:
+6С 1s 2 2s 2 2p 2
+6С 1s 

В возбужденном состоянии: один электрон переходит с 2s-подуровня на 2р-подуровень.
+6С * 1s 2 2s 1 2p 3
+6С * 1s 2 

Таким образом, в возбужденном состоянии углерод содержит четыре неспаренных электрона, может образовать четыре химические связи и проявляет валентность IV в соединениях.
При образовании четырех химических связей атомом углерода происходит гибридизация атомных орбиталей.
| Гибридизация атомных орбиталей — это выравнивание электронной плотности атомных орбиталей разного типа с образованием новых, молекулярных орбиталей, форма и энергия которых одинаковы. |
Изображение с портала orgchem.ru
| Например, в молекуле метана CH4 атомы водорода располагаются в пространстве в вершинах тетраэдра, центром которого является атом углерода. Валентный угол Н–С–Н в метане равен 109 о 28’ |
Молекулам линейных алканов с большим числом атомов углерода соответствует зигзагообразное расположение атомов углерода.
| Например, пространственное строение н-бутана |
При этом негибридная р-орбиталь располагается перпендикулярно плоскости, в которой расположены три гибридные sp 2 — орбитали.
Изображение с портала orgchem.ru
Модель молекулы этилена:
sp-Гибридизация
В sp-гибридизацию вступают одна s-орбиталь и одна p-орбиталь. Две p-орбитали не вступают в гибридизацию:
| Две sp-гибридные орбитали атома углерода направлены в пространстве под углом 180 о друг к другу, что соответствует линейному строению. |
Изображение с портала orgchem.ru
При этом две р-орбитали располагаются перпендикулярно друг другу и перпендикулярно линии, на которой расположены гибридные орбитали.
| Например, молекула ацетилена имеет линейное строение. |
Добавить комментарий Отменить ответ
Этот сайт использует Akismet для борьбы со спамом. Узнайте, как обрабатываются ваши данные комментариев.
Какие типы гибридизации атомов углерода бывают
Гибридизация – это смешение атомных орбиталей (электронных облаков) разной формы, обладающих различной энергией; в результате образуются гибридные орбитали (облака) одинаковые по форме и энергии. Число образующихся гибридных орбиталей равно числу орбиталей, участвующих в гибридизации.
Гибридизация атомных орбиталей — гипотетический процесс смешения разных (s, p, d, f) орбиталей центрального атома многоатомной молекулы с возникновением одинаковых орбиталей, эквивалентных по своим характеристикам.
Объяснение этого факта впервые дал американский химик Лайнус Полинг.
Ввиду относительной близости значений энергии 2s- и 2р-электронов, эти электроны могут взаимодействовать между собой в ходе образования химической связи с электронами другого атома, давая четыре новых равноценных гибридных электронных облака.
Атом С в органических соединениях может находиться в трех валентных состояниях. Этим валентным состояниям соответствуют различные типы гибридизации электронных орбиталей атома углерода.
Модель атома углерода
Валентные электроны атома углерода располагаются на одной 2s-орбитали и двух 2р-орбиталях.
Электронная формула атома углерода в основном (стационарном) состоянии 1s 2 2s 2 2p 2 указывает на то, что внешние электроны углерода неодинаковы: s-электрон имеет орбиталь в виде шара, р-электроны – в виде объемных восьмерок, расположенных под углом 90 0 друг к другу.
Если бы такое различие существовало, то у четырехвалентного углерода должна была бы наблюдаться неравноценностей связей. На самом же деле все четыре связи равноценны.
Да и сама четырехвалентность углерода не согласуется с приведенной выше электронной формулой: ведь валентность равна числу неспаренных внешних электронов, которых в приведенной формуле только два.
Переход атома углерода из основного состояния в возбужденное.
Электронная конфигурация атома углерода в основном и возбужденном состоянии
Основное и возбужденное состояния атома углерода
Образовавшиеся электронные облака четырех неспаренных электронов гибридизируются — смешиваются.
Гибридизация атомных орбиталей углерода
Модель атома углерода
Валентные электроны атома углерода располагаются на одной 2s-орбитали и двух 2р-орбиталях. 2р-Орбитали расположены под углом 90° друг к другу, а 2s-орбиталь имеет сферическую симметрию. Таким образом, расположение атомных орбиталей углерода в пространстве не объясняет возникновения в органических соединениях валентных углов 109,5°, 120° и 180°.
Чтобы разрешить это противоречие, было введено понятие гибридизации атомных орбиталей. Для понимания природы трех вариантов расположения связей атома углерода понадобились представления о трех типах гибридизации.
Возникновением концепции гибридизации мы обязаны Лайнусу Полингу, много сделавшему для развития теории химической связи.
Концепция гибридизации объясняет, каким образом атом углерода видоизменяет свои орбитали при образовании соединений. Ниже мы будем рассматривать этот процесс трансформации орбиталей постадийно. При этом надо иметь в виду, что расчленение процесса гибридизации на стадии или этапы есть, на самом деле, не более чем мысленный прием, позволяющий более логично и доступно изложить концепцию. Тем не менее заключения о пространственной ориентации связей углеродного атома, к которым мы в итоге придем, полностью соответствуют реальному положению дел.
Электронная конфигурация атома углерода в основном и возбужденном состоянии
sp3 — гибридизация. Молекула метана.
Образование трех sр2-гибридных орбиталей
Образование сигма — и пи-связей в молекуле этилена
Двойная связь в молекуле этилена
Третий, последний тип гибридизации, показан на примере простейшей молекулы, содержащей тройную связь,- молекулы ацетилена. Первый шаг — возбуждение атома, такой же, как раньше. На втором этапе происходит гибридизация одной 2s- и одной 2р-орбиталей с образованием двух sр-гибридных орбиталей, которые располагаются под углом 180°. И остаются не измененными две 2р-орбитали, необходимые для образования двух π-связей.
Образование двух sр-гибридных орбиталей
Следующий шаг — образование σ-связи между двумя sр-гибридизованными углеродными атомами, затем образуются две π-связи. Одна σ-связь и две π-связи между двумя атомами углерода вместе составляют тройную связь. И наконец, образуются связи с двумя атомами водорода. Молекула ацетилена имеет линейное строение, все четыре атома лежат на одной прямой.
Мы показали, каким образом три основных в органической химии типа геометрии молекул возникают в результате различных трансформаций атомных орбиталей углерода.
Можно предложить два способа определения типа гибридизации различных атомов в молекуле.
Способ 1. Наиболее общий способ, пригодный для любых молекул. Основан на зависимости валентного угла от гибридизации:
в) валентный угол 180°-sp-гибридизация.
Способ 2. Пригоден для большинства органических молекул. Поскольку тип связи (простая, двойная, тройная) связан с геометрией, можно по характеру связей данного атома определить тип его гибридизации:
в) одна тройная связь — sp-гибридизация.
Гибридизация — это мысленная операция превращения обычных (энергетически наиболее выгодных) атомных орбиталей в новые орбитали, геометрия которых соответствует экспериментально определенной геометрии молекул.
Один комментарий в “Гибридизация атомных орбиталей углерода”
Спасибо тебе, умный человек! Долбилась часа 2, пока на этот материал не наткнулась. Простым, человеческим языком написано. Ура-ура, я разобралась!
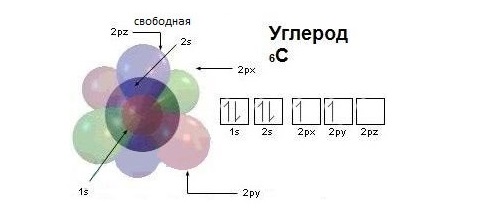
Урок 5. Гибридизация
атомных орбиталей углерода
Ковалентная химическая связь образуется при помощи общих связывающих электронных пар по типу:
Напомним, что в электронной формуле атома (например, для углерода 6С – 1s 2 2s 2 2p 2 ) большие цифры перед буквами – 1, 2 – обозначают номер энергетического уровня. Буквы s и р указывают форму электронного облака (орбитали), а цифры справа над буквами говорят о числе электронов на данной орбитали. Все s-орбитали сферические:
На втором энергетическом уровне кроме 2s-орбитали имеются три 2р-орбитали. Эти 2р-орбитали имеют эллипсоидную форму, похожую на гантели, и ориентированы в пространстве под углом 90° друг к другу. 2р-Орбитали обозначают 2рх, 2рy и 2рz в соответствии с осями, вдоль которых эти орбитали расположены.




















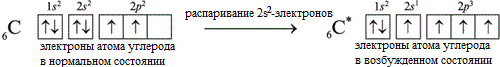
















 )-связью.
)-связью. -связь.
-связь. 
 С состоит из
С состоит из 



