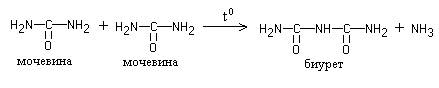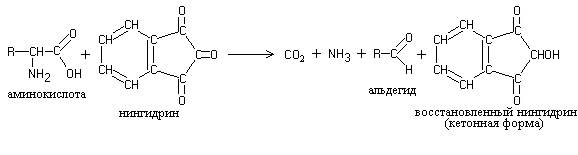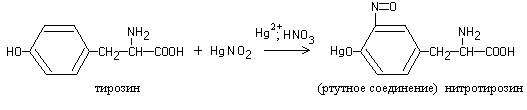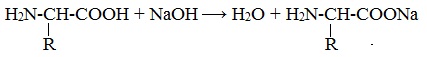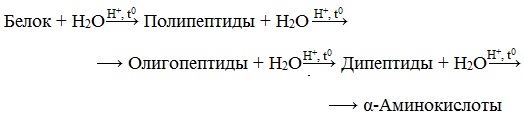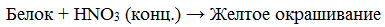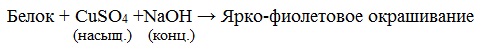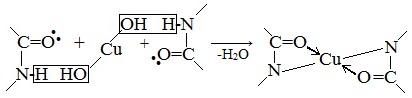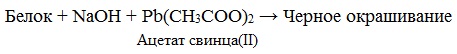какие цветные реакции характерны для белков
ЦВЕТНЫЕ И ИМЕННЫЕ КАЧЕСТВЕННЫЕ РЕАКЦИИ НА БЕЛКИ
История химии в школьном курсе
РЕАКЦИЯ ПИОТРОВСКОГО (БИУРЕТОВАЯ РЕАКЦИЯ)
В белках аминокислоты связаны друг с другом по типу полипептидов и дикетопиперазинов. Образование полипептидов из аминокислот происходит путем отщепления молекулы воды от аминогруппы одной молекулы аминокислоты и карбоксильной группы другой молекулы:
Образующаяся группа –С(О)–NН– называется пептидной группой, связь С–N, соединяющая остатки млекул аминокислот, – пептидной связью.
При взаимодействии дипептида с новой молекулой аминокислоты получается трипептид и т. д.
Дикетопиперазины образуются при взаимодействии двух молекул аминокислот с отщеплением двух молекул воды:
Дикетопиперазины были выделены из белков Н.Д.Зелинским и В.С.Садиковым в 1923 г.
Наличие в белке повторяющихся пептидных групп подтверждается тем, что белки дают фиолетовое окрашивание при действии небольшого количества раствора медного купороса в присутствии щелочи (биуретовая реакция).
Реакция идет по схеме:
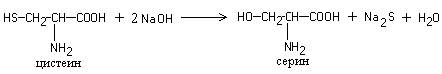
Это реакция на цистеин и цистин. При щелочном гидролизе «слабосвязанная сера» в цистеине и цистине достаточно легко отщепляется, в результате чего образуется сероводород, который, реагируя со щелочью, дает сульфиды натрия или калия. При добавлении ацетата свинца(II) образуется осадок сульфида свинца(II) серо-черного цвета.
Описание опыта. В пробирку наливают 1 мл раствора цистина, прибавляют 0,5 мл 20%-го раствора гидроксида натрия. Смесь нагревают до кипения, а затем добавляют 0,5 мл раствора ацетата свинца(II). Наблюдается выпадение серо-черного осадка сульфида свинца(II):
Описание опыта. В пробирку наливают 5 капель 1%-го раствора глицина и прибавляют 1 каплю индикатора метилового красного. Раствор окрашивается в желтый цвет (нейтральная среда). К полученной смеси добавляют равный объем 40%-го раствора формальдегида (формалин). Появляется красное окрашивание (кислая среда):
Это реакция на аминокислоту глицин.
В таких солях ион меди координационными связями соединен с аминогруппами.
Описание опыта. В пробирку наливают 3 мл 3%-го раствора сульфата меди(II), добавляют несколько капель 10%-го раствора гидроксида натрия до образования голубого осадка. К полученному осадку гидроксида меди(II) приливают 0,5 мл концентрированного раствора глицина. При этом образуется темно-синий раствор глицината меди:
Описание опыта. В пробирку наливают 1 мл раствора тирозина и добавляют 0,5 мл концентрированной азотной кислоты. Смесь нагревают до появления желтой окраски. После охлаждения добавляют 1–2 мл 20%-го раствора гидроксида натрия до появления оранжевой окраски раствора:
Описание опыта. В пробирку наливают около
0,5 мл раствора уксуснокислого свинца и прибавляют раствор едкого кали до растворения образовавшегося осадка гидроксида свинца. В другую пробирку наливают
Триптофан, реагируя в кислой среде с альдегидами, образует окрашенные продукты конденсации. Например, с глиоксиловой кислотой (являющейся примесью к концентрированной уксусной кислоте) реакция протекает по уравнению:
По аналогичной схеме протекает и реакция триптофана с формальдегидом.
В ходе проведенного исследования мы выявили по литературным источникам имеющуюся информацию о цветных качественных реакциях на белковые аминокислоты; выполнили ряд перечисленных реакций и составили базу данных. Эта база может быть использована в школьной практике как в теоретическом плане, так и в практическом, т. к. мы приводим краткие, но подробные описания выполнения всех опытов.
Из предложенных 18 качественных реакций каждая практически осуществима в школьном курсе химии и имеет важное практическое значение. Сопровождение реакций химическими уравнениями конкретизирует и углубляет знания по биологической и органической химии, особенно знания учащихся специализированных биологических и химических классов.
Использованная литература
Ермаков А.Н., Арасимович В.В., Смирнова-Иконникова М.И., Мирри И.К. Методы биохимического исследования растений. М.,1952, 520 с.
Полянская А.С., Шевелева А.О. Методическая разработка по лабораторным работам: «Аминокислоты» и «Белки». Л., 1976, 37 с.
Пустовалова Л.М. Практикум по биохимии. 1999, 541 с.
Руководство к практическим занятиям по органической химии. Под ред. В.М.Родионова. М., 1954, 111 с.
Соловьев Н.А. Лабораторные работы по биологической химии. Методическая разработка. СПб., 1996, 70 с.
Филиппович Ю.Б., Егорова Т.А., Севастьянова Г.А. Практикум по общей биохимии. М., 1982, 311 с.
З.Саитов, С.В.Телешов, Б.Харитонцев,
секция «Юный химик» РХО им. Д.И.Менделеева (г. Тобольск)
Цветные реакции
КАЧЕСТВЕННЫЕ РЕАКЦИИ НА АМИНОКИСЛОТЫ И БЕЛКИ
Цель работы:изучить качественные реакции, используемые для обнаружения белков и определения их аминокислотного состава
Цветные реакции
Для обнаружения белка применяют цветные реакции, которые делят на два типа: общие или универсальные и специфические. К универсальным реакциям относятся биуретовая (на пептидную связь) и нингидрировая (на α-аминокислоты). С их помощью можно обнаружить любой белок. К специфическим относятся реакции на отдельные аминокислоты, которые позволяют обнаружить специфические функциональные группы в составе радикалов аминокислот.Цветные реакции на белки лежат в основе методов установления белковой природы веществ, изучения аминокислотного состава и количественного содержания белков.
Работа 1. Биуретовая реакция (реакция Пиотровского).
В щелочной среде белки, а также продукты их гидролиза (полипептиды) дают фиолетовое или красно-фиолетовое окрашивание с сульфатом меди. Реакция обусловлена присутствием в балках пептидных связей, которые образуют окрашенные солеобразные комплексные соединения. Интенсивность окраски зависит от количества пептидных связей в молекуле и количества медной соли.
Свое название реакция получила от производного мочевины – биурета, который дает эту реакцию. Биурет образуется при нагревания мочевины с отщеплением от нее аммиака:
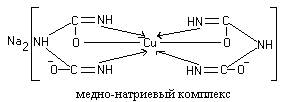
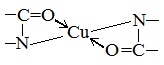
Две молекулы диенольной формы биурета взаимодействуют с образующимся в щелочной среде гидроксидом меди (II). Продуктом реакции является комплексное соединение (окрашенная медно-натриевая соль биурета), в котором координационные связи образованы за счет электронных пар атомов азота иминных групп:
Подобным образом построены окрашенные медно-натриевые соли пептидов и белков.
Биуретовую реакцию дает также аспарагин (амид аспарагиновой кислоты) и аминокислоты гистидин, серии, треонин.
Ход работы. В одну пробирку наливают 10-12 капель раствора яичного или растительного белка, в другую насыпают 20-30 мг мочевины и нагревают на спиртовке до исчезновения запаха аммиака и охлаждают. В обе пробирки добавляют по 10 капель 10-процентного раствора гидроксида натрия и по 1-2 капли 1-процентного раствора сульфата меди (II). В обеих пробирках появляется сине-фиолетовое или красно-фиолетовое окрашивание.
Работа 2. Нингидриновая реакция.
Белки, полипептиды и аминокислоты при нагревании с нингидрином дают синее и сине-фиолетовое окрашивание. Нингидриноваяреакция обусловлена наличием α-аминокислот и является одной из наиболее чувствительных для обнаружения α-аминогрупп.
Сущность реакции заключается в том, что α-аминокислоты и пептиды, реагируя с нингидрином, подвергаются окислительному дезаминированию и декарбоксилированию:
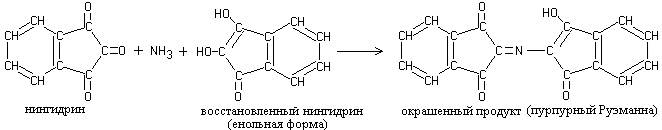
Восстановленный нингидрин взаимодействует с аммиаком и второй молекулой нингидрина, в результате чего образуется сложное окрашенное соединение мурексидного строения:
Ход работы. В две пробирки наливают: в одну 10 капель раствора яичного или растительного белка, в другую 10 капель 0,1-процентного раствора глицина. В каждую из них добавляют по 2-3 капли 0,1-процентного раствора нингидрина и нагревают. Через 1-2 мин появляется розовое, затем красное, а затем синее окрашивание.
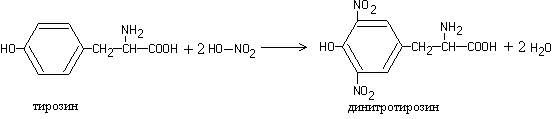
Работа 3. Ксантопротеиновая реакция (реакция Мульдера)
При нагревании растворов большинства белков с концентрированной азотной кислотой образуется желтое окрашивание, переходящее в щелочном растворе в оранжевое.
Реакция обусловлена присутствием циклических аминокислот, которые при взаимодействии с азотной кислотой образуют нитропроизводные желтого цвета, например:
Продукты нитрования циклических аминокислот, реагируя с едким натром или гидроксидом аммония, образуют соответствующие соли, имеющие оранжевую окраску:
Ход работы. В пробирку наливают 8-10 капель яичного или растительного белка, добавляют З-5 капель концентрированной азотной кислоты и нагревают. В пробирке появляется желтое окрашивание. После охлаждения к смеси добавляют избыток концентрированного раствора аммиака или 30-процентного раствора гидроксида натрия. Желтая окраска переходит в оранжевую.
Работа 4. Реакция на тирозин (реакция Миллона)
Нагревание большинства белков с реактивом Миллона (раствор нитратов и нитритов ртути (I) и (II) в азотной кислоте) приводит к образованию красного осадка.
Реакция обусловлена присутствием в белке аминокислоты тирозина, которая при взаимодействии с реактивом Миллона дает нитрозопроизводное, ртутное соединение которого окрашено в красный цвет:
Ход работы.К 8-10 каплям раствора белка добавляют 2-3 капли реактиваМиллона и осторожно нагревают. Жидкость окрашивается в красный цвет и выпадает красно-коричневый осадок.
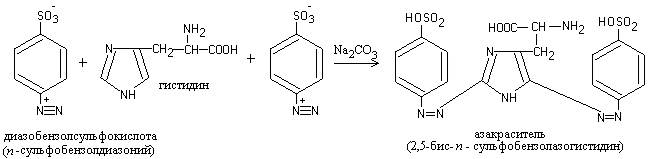
Работа 5. Диазореакция на гистидин и тирозин (реакция Паули)
При добавлении к щелочному раствору белка диазореактива жидкость приобретает оранжево-красное окрашивание.
Реакция обусловлена присутствием в белке аминокислот гистидина и тирозина, которые, реагируя с диазобензолсульфокислотой,образуют азокраситель красного цвета:
Ход работы.К свежеприготовленномудиазореактиву (3 капли 1-процентного раствора сульфаниловой кислоты в 2-процентном растворе соляной кислоты и 3 капли 5-процентного раствора нитрита натрия) добавляют 6-8 капель раствора белка и после перемешивания 3-5 капель 10-процентного раствора карбоната натрия. Развивается интенсивная красная окраска.
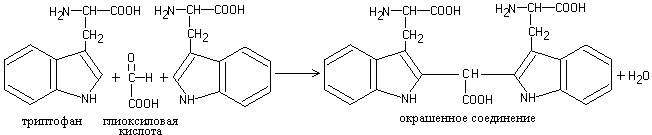
Работа 6. Реакции на триптофан
Реакции основаны на способности триптофана в кислой среде вступать во взаимодействие с альдегидами, образуя при этом окрашенные продукты конденсации.
а) Реакция Адамкевича. Взаимодействие триптофана с глиоксиловой кислотой (которая всегда присутствует в ледяной уксусной кислоте) приводит к образованию соединения красно-фиолетового цвета:
Ход работы. К 5-6 каплям раствора белка добавить 5 капель концентрированной уксусной кислоты, слегка подогреть и подслоить (осторожно. по стенке наклоненной пробирки) равный объем концентрированной серной кислота. На границе двух слоев жидкости появляется красно-фиолетовое кольцо.
б) Реакция Шульца-Распайля. Триптофан, взаимодействуя с оксиметилфурфуролом (образующимся при гидролизе сахарозы и обезвоживании моносахаридов под действием концентрированной серной кислоты) образует комплекс вишнево-красного цвета.
Ход работы.К 5-6 каплям раствора белка приливают 1 каплю 10- процентного раствора сахарозы и подслаивают 1 мл концентрированной серной кислоты. На границе раздела жидкостей появляется вишнево-красное окрашивание.
Работа 7. Реакция Фоля на содержащие серу аминокислоты
Нагревание белка со щелочью и плюмбитом приводит к появлению бурого или черного осадка. Реакция обусловлена наличием в белке содержащих серу аминокислот, которые под действием щелочи разрушаются с образованием сульфида щелочного металла; последний с плюмбитом дает осадок сульфида свинца:
Ход работы.К 5-6 каплям раствора белка добавляют 10 капель 30-процентного раствора гидроксида натрия и 1каплю 5-процентного раствора ацетата свинца. При длительном нагревании выпадает черный осадок сульфида свинца.
Цветные реакции на белки
Ищем педагогов в команду «Инфоурок»
Белок и всё о нём в биологии и химии < belok-s.narod.ru >
Цветные реакции на белки
Цветные реакции применяются для установления белковой природы веществ, идентификации белков и определение их аминокислотного состава в различных биологических жидкостях. В клинической лабораторной практике эти методы используются для определения количества белка в плазме крови, аминокислот в моче и крови, для выявления наследственных и приобретенных патологий обмена у новорожденных.
Ход определения. В пробирку вносят 5 капель р-ра яичного белка, 3 капли NaOH, 1 каплю Cu ( OH )2, перемешивают. Содержимое пробирки приобретает сине-фиолетовое окрашивание.
Реактивы: 1) яичный белок, 1% р-р; 2) нингидрин, 0,5% водный р-р.
Ход определения. В пробирку вносят 5 капель р-ра яичного белка, затем 5 капель нингидрина, нагревают смесь до кипения. Появляется розово-фиолетовое окрашивание, переходящее с течением времени в сине-фиолетовое.
Реакция выявляет наличие в белке циклических аминокислот.
Реакция Адамкевича. Аминокислота триптофан в кислой среде, взаимодействуя с альдегидами кислот, образует продукты конденсации красно-фиолетового цвета.
Реактивы: 1) неразбавленные яичный белок; 2) конц. (ледяная) уксусная к-та; 3) конц. серная к-та.
Ход определения. К одной капле белка прибавляют 10 капель уксусной к-ты. Наклонив пробирку, осторожно по стенке добавляют по каплям 0,5 мл серной к-ты так, чтобы жидкости не смешивались. При стоянии пробирки на границе жидкостей появляется красно-фиолетовое кольцо.
Ход определения. К 5 каплям р-ра белка прибавляют 5 капель реактива Фоля и кипятят 2-3 мин. После отстаивания 1-2 мин появляется черный или бурый осадок.
Какие цветные реакции характерны для белков
По химическому составу белки делятся на две группы:
а) простые белки – протеины, которые при гидролизе распадаются только на аминокислоты;
б) сложные белки или протеиды, образующие при гидролизе аминокислоты и вещества небелковой природы (углеводы, нуклеиновые кислоты и др.) — соединения белковых веществ с небелковыми.
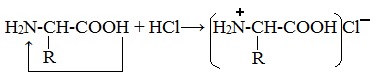
1. Амфотерные свойства белков
Так, при действии щелочей белок реагирует в форме аниона – соединяется с катионом щелочи:
При действии же кислот он выступает в форме катиона:
Если в молекуле белка преобладают карбоксильные группы, то он проявляет свойства кислот, если же преобладают аминогруппы, — свойства оснований.
Очень важным для жизнедеятельности живых организмов является буферное свойство белков, т.е. способность связывать как кислоты, так и основания, и поддерживать постоянное значение рН различных систем живого организма.
Белки обладают и специфическими физико-химическими свойствами.
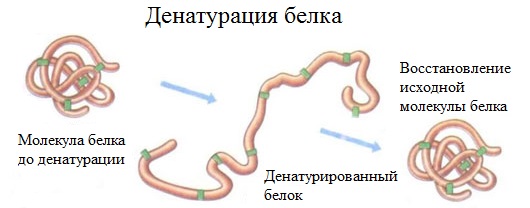
2. Денатурация белка (необратимое осаждение, свертывание)
Денатурация – это разрушение вторичной и третичной структуры белка (полное или частичное) и изменение его природных свойств с сохранением первичной структуры белка.
Сущность денатурации белка сводится к разрушению связей, обусловливающих вторичную и третичную структуры молекулы (водородных, солевых и других мостиков). А это приводит к дезориентации конфигурации белковой молекулы.
Денатурация бывает обратимой и необратимой.
Обратимая денатурация белка происходит при употреблении алкоголя, солёной пищи.
Например, яичный белок альбумин осаждается из раствора (свертывается) при варке яиц (при температуре 60-70 0 С), теряя способность растворяться в воде.
Видеоопыт «Свертывание белков при нагревании»
Видеоопыт «Осаждение белков солями тяжелых металлов»
Видеоопыт «Осаждение белков спиртом»
3. Гидролиз белков
Гидролиз белков – это необратимое разрушение первичной структуры в кислом или щелочном растворе с образованием аминокислот.
Анализируя продукты гидролиза, можно установить количественный состав белков.
Переваривание белков в организме по своей сути представляет ферментативный гидролиз белковых молекул.
В лабораторных условиях и в промышленности проводится кислотный гидролиз.
В ходе гидролиза белков происходит разрушение пептидных связей. Гидролиз белка имеет ступенчатый характер:
4. Цветные (качественные) реакции на белки
Для белков известно несколько качественных реакций.
а) Ксантопротеиновая реакция (на остатки аминокислот, содержащих бензольные кольца)
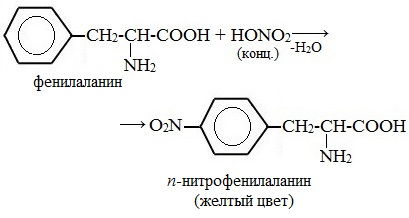
Белки, содержащие остатки ароматических аминокислот (фенилаланина, тирозина), дают желтое окрашивание при действии концентрированной азотной кислоты.
Причина появления окраски – образование нитропроизводных ароматических аминокислот, например, фенилаланина:
Видеоопыт «Ксантопротеиновая реакция на белки»
б) Биуретовая реакция (на пептидные связи)
Все соединения, содержащие пептидную связь, дают фиолетовое окрашивание при действии на них солей меди (II) в щелочном растворе.
Причина появления окраски – образование комплексных соединений с координационным узлом:
Видеоопыт «Биуретовая реакция белков»
Видеоопыт «Качественные реакции на белки: биуретовая и ксантопротеиновая»
в) Цистеиновая реакция (на остатки аминокислот, содержащих серу)
Причина появления окраски – образование черного осадка сульфида серебра (II) PbS.
Видеоопыт «Качественное определение азота в органических соединениях»
Презентация «Качественные реакции на белки. Биологическая роль белков в организме»
Ищем педагогов в команду «Инфоурок»
Описание презентации по отдельным слайдам:
Описание слайда:
Качественные реакции на белки
Биологическая роль белков в организме
Говырина А.Р.
учитель биологии
МБОУ «Школа №73»
Описание слайда:
Качественные реакции – это реакции, позволяющие определить наличие того или иного вещества (компонента) в среде.
Цветные реакции применяются для установления белковой природы веществ, идентификации белков и определение их аминокислотного состава в различных биологических жидкостях. В клинической лабораторной практике эти методы используются для определения количества белка в плазме крови, аминокислот в моче и крови, для выявления наследственных и приобретенных патологий обмена у новорожденных.
Описание слайда:
Определение
Пептиды и белки представляют собой высокомолекулярные органические соединения, построенные из остатков α- аминокислот, соединенных между собой пептидными связями.
Описание слайда:
Аминокислота триптофан в кислой среде, взаимодействуя с альдегидами кислот, образует продукты конденсации красно-фиолетового цвета.
Реактивы:
1) неразбавленные яичный белок,
2) концентрированная (ледяная) уксусная кислота;
3) концентрированная серная кислота.
Ход определения. К одной капле белка прибавляют 10 капель уксусной кислоты. Наклонив пробирку, осторожно по стенке добавляют по каплям 0,5 мл серной кислоты так, чтобы жидкости не смешивались. При стоянии пробирки на границе жидкостей появляется красно-фиолетовое кольцо.
Описание слайда:
При добавлении к раствору белка концентрированной азотной кислоты и нагревании появляется желтое окрашивание, переходящее в присутствии щелочи в оранжевое. Сущность реакции состоит в нитровании бензольного кольца циклических аминокислот азотной кислотой с образованием нитросоединений, выпадающих в осадок. Реакция выявляет наличие в белке циклических аминокислот.
Реактивы:
1) яичный белок, 1% раствор;
2) концентрированная азотная кислота;
3) NaOH,10% раствор.
Ход определения. К 5 каплям раствора яичного белка добавляют 3 капли азотной кислоты и (осторожно!) нагревают. Появляется осадок желтого цвета. После охлаждения добавляют (желательно на осадок) 10 капель NaOH, появляется оранжевое окрашивание.
Описание слайда:
Биуретовая реакция на пептидную связь
В основе ее лежит способность пептидных связей (-CO-NH-) образовывать с сульфатом меди в щелочной среде окрашенные комплексные соединения, интенсивность окраски которых зависит от длины полипептидной цепи. Раствор белка дает сине-фиолетовое окрашивание.
Реактивы:
1) яичный белок, 1% раствор (белок куриного яйца фильтруют через марлю и разводят дистиллированной водой 1:10);
2) NaOH, 10% раствор;
3) Cu(OH)2, 1% раствор.
Ход определения. В пробирку вносят 5 капель раствор яичного белка, 3 капли NaOH, 1 каплю Cu(OH)2, перемешивают. Содержимое пробирки приобретает сине-фиолетовое окрашивание.
Описание слайда:
Ход определения. В пробирку вносят 5 капель раствора яичного белка, затем 5 капель нингидрина, нагревают смесь до кипения. Появляется розово-фиолетовое окрашивание, переходящее с течением времени в сине-фиолетовое.
Описание слайда:
Ход определения. К 5 каплям раствора белка прибавляют 5 капель реактива Фоля и кипятят 2-3 мин. После отстаивания 1-2 мин. появляется черный или бурый осадок.
Описание слайда:
Белки в живом организме постоянно расщепляются на исходные аминокислоты (с непременным участием ферментов).
Одни аминокислоты переходят в другие, затем белки вновь синтезируются (также с участием ферментов), т.е. организм постоянно обновляется.
Некоторые белки (коллаген кожи, волос) не обновляются, организм непрерывно их теряет и взамен синтезирует новые.
Белки как источники питания выполняют две основные функции: они поставляют в организм строительный материал для синтеза новых белковых молекул и, кроме того, снабжают организм энергией (источники калорий).
Описание слайда:
Спасибо за внимание!
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
Курс повышения квалификации
Современные педтехнологии в деятельности учителя
Курс повышения квалификации
Современные образовательные технологии в преподавании химии с учетом ФГОС
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
также Вы можете выбрать тип материала:
Общая информация
Международная дистанционная олимпиада Осень 2021
Похожие материалы
«Изучение свойств карбоновых кислот на примере лимонной кислоты»
Урок химии с интеграцией самопознания в 9 классе. Лабораторная работа «Гидролиз солей»
Практическая работа «Урок химии в 9 классе по теме «Реакции ионного обмена». Проверочная работа. «Гарри Поттер в химической лаборатории»
Урок химии в 8 классе по теме «Движение электронов в атомах». Проверочная работа. Квест «В микромире атомов».
Урок химии в 7 классе.Проверочная работа по теме «Введение в химию.Чистые вещества и смеси». Квест «На шоколадной фабрике Вили Вонка»
Вероятность протекания химических реакций
Рабочая программа по учебному курсу «Вещества» (7 класс)
Презентация по химии на тему «Школьный эксперимент»
Не нашли то что искали?
Воспользуйтесь поиском по нашей базе из
5281517 материалов.
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Безлимитный доступ к занятиям с онлайн-репетиторами
Выгоднее, чем оплачивать каждое занятие отдельно
Кабмин утвердил список вузов, в которых можно получить второе высшее образование бесплатно
Время чтения: 2 минуты
СК предложил обучать педагогов выявлять деструктивное поведение учащихся
Время чтения: 1 минута
В Воронежской области ввели масочный режим в школах
Время чтения: 2 минуты
В Тюменской области студенты и школьники перейдут на дистанционное обучение
Время чтения: 2 минуты
В Туве предложили ввести антиковидные паспорта для школьников
Время чтения: 2 минуты
В Башкирии школьные каникулы продлили до 14 ноября
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.