какие углеводороды называют непредельными
Какие углеводороды называют непредельными
г) гидрогалогенирование (гидрохлорирование):
Присоединение молекул галогеноводородов протекает по правилу Марковникова (водород присоединяется к наиболее гидрогенизированному атому углерода).
4. Качественные реакции на алкены: обесцвечивание бромной воды (см. уравнение 2 б ) и раствора перманганата калия
Алкины – это непредельные углеводороды, в молекулах которых есть одна тройная связь между атомами углерода
Физические свойства алкинов
Химические свойства алкинов
В этой реакции температура пламени может достигать 3000 o С, поэтому она применяется для сварки металлов.
в) гидрогалогенирование (первая стадия):
CH CH + HCl CH 2 = CHCl
г) гидратация (реакция Кучерова):
ацетальдегид
(уксусный альдегид)
5. Качественные реакции на алкины: обесцвечивание бромной воды (см. реакцию 2 б ) и раствора перманганата калия; образование осадка ацетиленида серебра (см. реакцию 4).
Алкадиены – это непредельные углеводороды, в молекулах которых есть две двойные связи между атомами углерода
Физические свойства алкадиенов
Химические свойства алкадиенов
Такой же состав, как полиизопрен, (C5H8)n – имеет и природный полимер − натуральный каучук.
Алкадиены, как алкены и алкины, обесцвечивают бромную воду (реакция 2 б ) и раствор перманганата калия.
Получение непредельных углеводородов
Алгоритм составления названий непредельных углеводородов
Химия. 10 класс
Конспект урока
Урок № 3 Непредельные углеводороды – алкены
Перечень вопросов, рассматриваемых в теме
Урок посвящён непредельным углеводородам, их номенклатуре, физическим и химическим свойствам, а также роли в жизни человека. В ходе урока учащиеся познакомятся с представителями данного класса органических веществ.
Алкены – непредельные углеводороды ряда этилена, имеющие одну двойную углерод-углеродную связь
Гибридизация – процесс взаимодействия разных, но близких по энергии электронных орбиталей, приводящий к их выравниванию по форме и энергии.
Гомология – явление сходства по составу, строению, химическим свойствам и принадлежности к тому же классу одного вещества с другим веществом, но различающиеся дуг от друга на одну или несколько групп СН2. Группу СН2 называют гомологической разностью.
Горение – быстро протекающий процесс окисления вещества, сопровождающийся большим выделением тепла и ярким свечением.
Полимеризация – реакция, при которой одинаковые молекулы соединяются между собой в более крупную молекулу
Изомерия – явление существования веществ, одинаковых по составу и молекулярной массе, но различающихся по строению или расположению атомов в пространстве и вследствие этого по физическим и химическим свойствам. Такие вещества называются изомерами.
Формула структурная – изображение молекулы, в котором показан порядок связывания атомов между собой. Химические связи в таких формулах обозначаются черточками.
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
1. Рябов, М.А. Сборник задач, упражнений и тестов по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс : учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М. : Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
Единое окно доступа к информационным ресурсам [Электронный ресурс]. М. 2005 – 2018. URL: http://window.edu.ru/ (дата обращения: 01.06.2018).
ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ
Алкены – непредельные углеводороды, в молекулах которых между атомами углерода имеется одна двойная углерод-углеродная связь. Общая формула алкенов СnH2n, где n≥2.
Простейшим представителем алкенов является этен, или этилен С2Н4.
Структурная формула этилена:
Особенности пространственного и электронного строения алкенов на примере молекулы этилена
Каждый атом углерода в молекуле этилена имеет треугольное строение.
Особенности номенклатуры алкенов заключаются в следующем:
1. Нумерация углеродной цепи начинается с того конца, где ближе расположена двойная связь
1. Нумерация главной цепи начинается слева направо, так как двойная связь ближе к левой части молекулы.
2. Называем радикал, расположенный у второго атома углерода: 2-метил
3. В главной цепи находится четыре атома углерода, следовательно, она соответствует предельному углеводороду – бутану.
5. Соединяем суффикc с корнем и получаем название 2-матилбутен-1.
Гомология алкенов и изомерия алкенов.
Ближайшие гомологи этилена:
Для алкенов характерны следующие виды изомерии:
1. Изомерия углеродного скелета
2. Изомерия положения кратной связи
3. Пространственная геометрическая изомерия
4. Межклассовая (с циклоалканами)
Рассмотрим каждый вид изомерии на примере вещества состава С4Н8:
При построении структурной формулы данного вещества возможно расположение двойной связи как между первым и вторым атомами углерода, так и между вторым и третьим, тогда возможно получить две структурные формулы
Данный вид изомерии называется изомерией положения кратных связей.
Для данного вещества возможно построить единственный разветвлённый изомер – изомер углеродного скелета – 2-метилпропен:
Межклассовый изомер бутена – циклобутан:
Физические свойства алкенов
Этилен – бесцветный газ, почти без запаха, легче воздуха, плохо растворим в воде. Пропен и бутен – также газы. От пентена до октадецена – жидкости. Остальные – твердые вещества. Все агрегатные состояния указаны при нормальных условиях.
Способы получения алкенов
1. Внутримолекулярная дегидратация спиртов:
Данный способ является основным способом получения этилена в лабораторных условиях. Реакция протекает при температуре выше 140 градусов и в присутствии концентрированной серной кислоты, выполняющей роль катализатора. При дегидратации этанола получают этилен, а при дегидратации пропанола – пропилен:
2. Дегидрирование предельных углеводородов.
Данная реакция протекает при нагревании в присутствии катализаторов: никеля, платины, оксида хрома (III). При этом получают соответствующие алкены:
Химические свойства алкенов
Химические свойства алкенов обусловлены наличием в их молекулах двойных углерод-углеродных связей. Дело в том, что пи-связь, как было сказано ранее, является менее устойчивой, чем сигма связь. Поэтому при атаке её каким-либо реагентом она легко разрывается. Это объясняет основные химические свойства алкенов: они способны вступать в реакции присоединения и окисления.
Гидрирование – присоединение водорода
Протекает при нагревании в присутствии катализаторов: платина, никель, оксид хрома (III). Продуктом реакции всегда является алкан.
Галогенирование – присоединение галогенов
Признак реакции – обесцвечивание раствора брома, поэтому данную реакцию используют как качественную на двойную связь.
Гидрогалогенирование – присоединение галогенводородов
Продукт реакции – галогеналкан (хлорэтан)
Гидратация – присоединение воды
Полимеризация – реакция, при которой одинаковые молекулы соединяются в более крупные молекулы.
Условия реакции – высокая температура и давление
Продукт реакции – полимер (полиэтилен)
Продукты реакции полимеризации используются для производства пластмасс и синтетических волокон
Продукт реакции – многоатомный спирт (этиленгликоль)
Каталитическое – окисление кислородом в присутствии катализаторов
Продукт реакции – оксид алкена (оксид этилена)
Продуктами полного горения алкенов являются углекислый газ и вода
Особенности реакций гидрогалогенирования и гидратации у пропилена и других гомологов этилена
Реакции присоединения галогеналканов и воды у гомологов этилена протекают по правилу Марковникова: водород присоединяется по месту разрыва двойной связи к более гидрированному атому углерода. Например, при присоединении хлороводорода к молекуле пропилена, образуется не 1-хлорпропан, а 2-хлорпропан:
Аналогично протекает реакция гидратации:
Применение этилена и его соединений
Производство пластмасс, взрывчатых веществ, антифриза, растворителей, синтетического каучука, ацетальдегида, для ускорения созревания плодов.
ПРИМЕРЫ И РАЗБОР РЕШЕНИЯ ЗАДАНИЙ ТРЕНИРОВОЧНОГО МОДУЛЯ
Масса 2%-го раствора бромной воды, которая вступает в реакцию с 2,24 л пропилена равна
Шаг второй: Находим количество вещества пропилена по формуле n=V\Vm= 2,24 л / 22,4 л/моль = 0,1 моль
Шаг третий: По уравнению реакции количество вещества пропилена равно количеству вещества брома: n(С2Н4)=n(Br2)=0,1 моль
Шаг четвёртый: Находим массу брома по формуле: m=Mn=160 г/моль*0,1 моль= 16 г
Шаг пятый: Находим массу раствора бромной воды по формуле: m (раствора)=m/ω = 16г / 0,02 = 800г
Вставьте в таблицу пропущенные продукты реакции
Варианты ответов: этан, пропан, бутан, 1,2-дибромэтан, 1,2-дибромпропан, 1,3-дибромпропан, этанол, пропанол-1, пропанол-2, хлорэтан, 1-хлорпропан, 2-хлорпропан.
Первый шаг: При гидрировании алкенов водородом образуются предельные углеводороды – алканы с соответствующим числом атомов углерода. Поэтому первая колонка заполняется продуктами реакции – этан и пропан:
Второй шаг: При галогенировании алкенов галогены, в данном случае бром, присоединяются по месту разрыва двойной связи, образуя дигалогенпроизводные, например:
Поэтому второй столбец заполняется следующими веществами: 1,2-дибромэтан, 1,2-дибромпропан.
Третий шаг: При гидратации (присоединении воды) образуются спирты. При реакции пропилена с водой важно помнить о правиле Марковникова, поэтому продуктами реакции будут этанол и пропанол-2:
4. При гидрогалогенировании алкенов продуктом реакции будут галогеналканы. И опять нужно помнить о правиле Марковникова для гидрогалогенирования пропилена:
Поэтому правильный ответ в этом задании: хлорэтан и 2-хлорпропан
Урок №61. Непредельные (ненасыщенные) углеводороды
АЛКЕНЫ
Углеводородами ряда этилена, или этиленовыми углеводородами ( олефинами или алкенами ) называют ненасыщенные углеводороды, строение которых отличается наличием в их молекулах одной двойной связи между углеродными атомами
Этиленовые углеводороды образуют гомологический ряд, состав каждого члена которого выражается общей эмпирической формулой
C n H 2n
Гомологический ряд алкенов
Структурная формула этилена
Физические свойства алкенов
С 5 – С 18 (жидкости)
Алкены не растворяются в воде, растворимы в органических растворителях (бензин, бензол и др.)
С увеличением Mr температуры плавления и кипения увеличиваются
Реакции присоединения алкенов
Химические свойства алкенов
Как и предельные углеводороды, алкены горят на воздухе :
Применение алкенов
Этилен является одним из базовых продуктов промышленной химии и стоит в основании ряда цепочек синтеза.
Этилен используют для ускорения созревания плодов — например, помидоров, дынь, апельсинов, мандаринов, лимонов, бананов; дефолиации растений, снижения предуборочного опадения плодов, для уменьшения прочности прикрепления плодов к материнским растениям, что облегчает механизированную уборку урожая.
АЦЕТИЛЕНОВЫЕ УГЛЕВОДОРОДЫ
Ацетиленовыми углеводородами ( алкинами ) называются непредельные (ненасыщенные) углеводороды, содержащие в молекуле одну тройную связь и имеющие общую формулу
C n H 2n-2
Родоначальником гомологического ряда этих углеводородов является ацетилен
H-C≡C-H
Физические свойства
С 2 Н 2 – газ без цвета и почти без запаха, легче воздуха, мало растворим в воде
Получение в лаборатории
Из карбида кальция гидролизом ( взаимодействие с водой )
CaC 2 + 2H 2 O → Ca(OH) 2 + H-C≡C-H
Получение в промышленности
Термическим разложением метана (пиролиз)
2CH 4 1500˚С → HC≡CH + 3H 2
Применение
Из всех ацетиленовых углеводородов большое промышленное значение имеет ацетилен, который является важнейшим химическим сырьём.
При горении ацетилена выделяется много тепла, что используется для резки и сварки металлов в ацетилен-кислородной сварке (расходуется до 30 % всего производимого ацетилена).
для газовой сварки и резки металлов,
как источник очень яркого, белого света в автономных светильниках, где он получается реакцией карбида кальция и воды ( см. карбидная лампа ),
для получения уксусной кислоты, этилового спирта, растворителей, пластических масс, каучука, ароматических углеводородов.
для получения технического углерода,
в атомно-абсорбционной спектрофотометрии при пламенной атомизации,
в начале XX века широкое распространение имели автомобильные ацетиленовые фары, которые только в 1920-е были вытеснены электрическими.
В конце 19-го — начале 20-го века широкой популярностью пользовались многочисленные ацетиленовые светильники ( источником ацетилена служил дешевый карбид кальция ), используемые на железнодорожном и водном транспорте, для освещения улиц, в быту. Несмотря на то, что сегодня массовое использование ацетиленовых фонарей ушло в прошлое, их выпуск и потребление не прекратились. Они производятся в небольших количествах как походное снаряжение.
ДИЕНЫ
Общая формула алкадиенов
C n H 2n-2
Наибольший интерес представляют углеводороды с сопряженными двойными связями, их используют для производства синтетических каучуков.
Наиболее массовое применение каучуков — это производство резин для автомобильных, авиационных и велосипедных шин.
Из каучуков изготавливаются специальные резины огромного разнообразия уплотнений для целей тепло- звуко- воздухо- гидроизоляции разъёмных элементов зданий, в санитарной и вентиляционной технике, в гидравлической, пневматической и вакуумной технике.
Каучуки применяют для электроизоляции, производства медицинских приборов.
ЦИКЛОАЛКАНЫ (ЦИКЛОПАРАФИНЫ)
В отличие от предельных углеводородов, характеризующихся наличием открытых углеродных цепей, существуют углеводороды с замкнутыми цепями (циклами). По своим свойствам они напоминают обычные предельные углеводороды алканы (парафины), отсюда и произошло их название – циклоалканы (циклопарафины).
Общая формула гомологического ряда циклоалканов
C n H 2n
Циклоалканы изомерны этиленовым углеводородам. В природе встречаются в составе нефти.
Представителями этого ряда соединений являются циклопропан, циклопентан, циклогексан.
Наибольшее практическое значение имеют циклогексан, этилциклогексан. Циклогексан используется в химическом синтезе, а также в качестве растворителя. Циклопропан используется в медицинской практике в качестве ингаляционного анестезирующего средства.
АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ (АРЕНЫ)
Типичными представителями ароматических углеводородов являются производные бензола, т.е. такие карбоциклические соединения, в молекулах которых имеется особая циклическая группировка из шести атомов углерода, называемая бензольным или ароматическим ядром.
Общая формула ароматических углеводородов
С 6 H 5 – CH 3 – толуол (метилбензол)
С 6 H 5 – CH=СH 2 – стирол (винилбензол)
Физические свойства :
1. Бензол – легкокипящая (t кип = 80,1°С), бесцветная жидкость, не растворяется в воде
3. Большинство ароматических углеводородов опасны для жизни, токсичны.
Применение
Ароматические углеводороды являются важным сырьем для производства различных синтетических материалов, красителей, физиологически активных веществ. Так, бензол – продукт для получения красителей, медикаментов, средств защиты растений и др. Толуол используется как сырье в производстве взрывчатых веществ, фармацевтических препаратов, а также в качестве растворителя. Винилбензол (стирол) применяется для получения полимерного материала – полистирола.
Ненасыщенные углеводороды
Смотреть что такое «Ненасыщенные углеводороды» в других словарях:
Ненасыщенные углеводороды — Непредельные углеводороды углеводороды с открытой цепью, в молекулах которых между атомами углерода имеются двойные или тройные связи. Непредельные углеводороды способны к реакциям присоединения по двойным и тройным связям в открытой цепи. Они,… … Википедия
Углеводороды — класс органических соединений, молекулы которых состоят только из атомов углерода и водорода. В зависимости от строения различают ациклические, или алифатические, У., в молекулах которых атомы углерода связаны друг с другом в линейные или … Большая советская энциклопедия
УГЛЕВОДОРОДЫ НЕНАСЫЩЕННЫЕ — см. Углеводороды насыщенные (предельные). Геологический словарь: в 2 х томах. М.: Недра. Под редакцией К. Н. Паффенгольца и др.. 1978 … Геологическая энциклопедия
Углеводороды — орг. соединения, состоящие только из углерода и водорода газообразные, жидкие и твердые в зависимости от молекулярного веса и от хим. структуры. Существуют У. с открытой цепью (см. Соединения алифатические (жирные) и циклические, Соединения… … Геологическая энциклопедия
УГЛЕВОДОРОДЫ — обширный класс газообразных, жидких и твёрдых органических соединений, в состав молекул которых входят только атомы углерода и водорода. В зависимости от строения и свойств различают У.: насыщенные, или предельные (простейший представитель метан… … Большая политехническая энциклопедия
НЕНАСЫЩЕННЫЕ СОЕДИНЕНИЯ — непредельные соединения, органич. соединения, в к рых все или нек рые атомы углерода, образующие скелет молекулы, соединены между собой кратными связями С=С или (и) С=С в открытые цепи (ациклич., или алифатич., Н. с., например этилен, бутадиен,… … Большой энциклопедический политехнический словарь
УГЛЕВОДОРОДЫ — органич. соединения, молекулы к рых построены только из атомов углерода и водорода. Атомы углерода образуют в У. открытые линейные или разветвл. цепи (напр., норм. пентан и изопентаны), а также циклы (напр., циклогексан, бензол). У. важнейшие… … Большой энциклопедический политехнический словарь
диеновые углеводороды — (диены), ненасыщенные углеводороды, содержащие в молекуле 2 двойные связи (С=С). По взаимному расположению последних различают диеновые углеводороды с кумулированными (например, аллен СН2=С=СН2), сопряжёнными (например, бутадиен СН2=СН CH=СН2) и… … Энциклопедический словарь
Какие углеводороды называют непредельными
На своем сайте я выкладываю уникальные, адаптивные, и качественные шаблоны. Все шаблоны проверяются на всех самых популярных браузерх.
Раньше я занимался простой вёрсткой одностраничных, новостных и т.п. шаблонов на HTML, Bootstrap. Однажды увидев сайты на DLE решил склеить пару шаблонов и выложить их в интернет. В итоге эта парочка шаблонов набрала неплохую популярность и хорошие отзывы, и я решил создать отдельный проект.
Кроме шаблонов я так же буду выкладывать полезную информацию для DataLife Engin и «статейки» для веб мастеров. Так же данный проект будет очень полезен для новичков и для тех, кто хочет правильно содержать свой сайт на DataLife Engine. Надеюсь моя работа вам понравится и вы поддержите этот проект. Как легко и удобно следить за обновлениями на сайте?
Достаточно просто зарегистрироваться на сайте, и уведомления о каждой новой публикации будут приходить на вашу электронную почту!
Задание 1
Какие углеводороды называют алкадиенами? Углеводороды, в молекулах которых содержатся две двойные углерод-углеродные связи и общая формула которых CnH2n-2, называют алкадиенами.
Напишите формулы одного гомолога и одного изомера пентадиена-1,3 с сопряжёнными двойными связями.
Гомолог пентадиена-1,3:
CH2=CH2―CH=CH―CH2―CH3 гексадиен-1,3
Изомер пентадиена-1,3:
CH3 ― CH=C=CH ― CH3 пентадиен-2,3
Задание 2
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
а) CH3 ― CH3 → CH3 ― CH2Br → CH3 ― CH2 ― OH → CH2=CH ― CH ― CH2
CH3 ― CH3 + Br2 ⟶ CH3 ― CH2Br + HBr
CH3 ― CH2Br + NaOH ⟶ CH3 ― CH2 ― OH + NaBr
2CH3 ― CH2 ― OH t,Al₂O₃,ZnO ⟶ H2C=CH ― CH=CH2 + 2H2O + H 2
б) CH3 ― CH(CH3) ― CH2 ― CH3 → CH2=C(CH3) ― CH=CH2 → изопреновый каучук
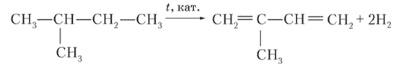 |
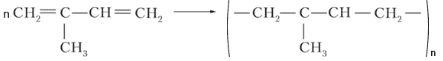 |
Задание 3
Сравните реакции присоединения алкенов и диеновых углеводородов. Ответ подтвердите уравнениями химических реакций на примере бутена-1 и бутадиена-1,3.
Реакции галогенирования.
Общее: образуются соответствующие галогеналканы.
Отличие: алкадиены реагируют с галогенами ступенчато, с промежуточным образованием галогеналкенов.
CH2=CH ― CH2 ― CH3 + Br2 ⟶ CH2Br ― CHBr ― CH2 ― CH3
Реакции гидрирования.
Общее: образуются соответствующие а лканы.
Отличие: алкадиены реагируют с водородом ступенчато, с промежуточным образованием алкенов.
CH2=CH ― CH2 ― CH3 + H2 t, кат. ⟶ CH3 ― CH2 ― CH2 ― CH3
Реакции гидрогалогенирования.
Общее: образуются соответствующие алканы, протекают согласно правилу Марковникова.
CH2=CH ― CH2 ― CH3 + HBr ⟶ CH3 ― CHBr ― CH2 ― CH3
CH2=CH ― CH=CH2 + 2HBr ⟶ CH3 ― CHBr ― CHBr ― CH3
Задание 6
Англичанин Чарлз Макинтош предложил пропитывать плащевую ткань раствором натурального каучука, поэтому плащи, сшитые из такого материала, не промокали под сильным дождём; их назвали макинтошами. Однако они не были лишены недостатков, присущих натуральному каучуку: размягчались на солнце и становились хрупкими в мороз. В чём заключалось открытие американца Чарлза Гудьира, позволившее устранить эти недостатки плащевого материала? В 1839 году американский изобретатель Чарлз Гудьир открыл процесс вулканизации, который заключался в «сшивании» молекул каучука в единую пространственную трехмерную сетку с помощью серы, благодаря чему каучук становился сильнее и эластичнее, уменьшилась его растворимость.











