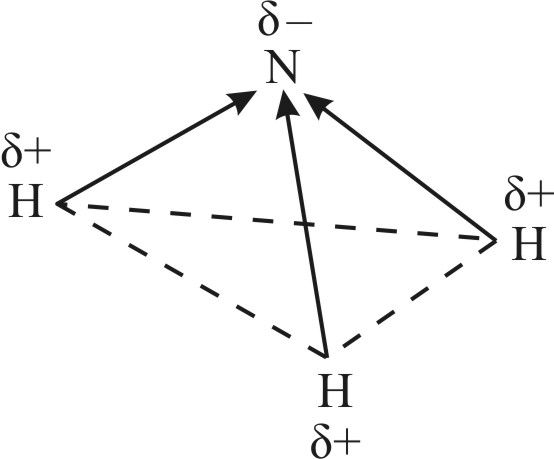
какие утверждения справедливы для молекулы аммиака
Государственное учреждение образования «Гимназия г. Калинковичи»
Фестиваль «Методическая весна»
Конкурс учебно-методических разработок
, учитель химии высшей квалификационной категории
Цель: Продолжить развитие представлений о составе и строении молекул, физических и химических свойствах, применении аммиака; развивать умения составлять уравнения реакции и решать тестовые задания.
- Обеспечить в ходе урока актуализацию и углубление знаний учащихся по строению молекулы, свойствам и применению аммиака; Создать условия для развития у учащихся умений анализировать, обобщать и делать выводы с помощью логического мышления на основе сравнения; Формирование навыков практической деятельности по применению теоретических знаний при самостоятельном выполнении учебно-познавательных заданий
Методы: Словесные: (объяснение; рассказ с элементами беседы).
Практические: (решение задач, работа с учебником ).
Вид урока: беседа с элементами рассказа.
Тип урока: Формирование новых знаний.
I. Организационный момент.
Здравствуйте, садитесь. Прежде, чем приступить к объяснению нового материала, скажите, пожалуйста, кого сегодня нет. А теперь давайте с вами вспомним, что мы уже с вами знаем о кислороде.
II. Актуализация знаний.
- Графический диктант по Теме «ФЗОТ И ФОСФОР»
2 вариант – фосфор. Да Нет
/пока учитель проверяет диктанты 1 ученик решает задачу/
III. Изучение нового материала.
Отыт №1. «Заколдованный цветок»
Берется бумажный цветок белого цвета, смоченный раствором фенолфталеина. Брызгаем на него нашатырным спиртом – лепестки меняют окраску на малиновую.
Отыт № 2. «Дым без огня».
Берется два стакана с аммиаком и хлороводородной кислотой. Стаканы подносятся друг к другу – появляется белый дым. /можно продемонстрировать немой ролик с опытом/
?? кл. 1. Какое вещество использовалось в опытах?
2. Какие вопросы у вас возникли?
Чтобы ответить на ваши вопросы нужно вспомнить об аммиаке и узнать о нем побольше.
Строение молекулы аммиака.
?? кл. Запишите молекулярную, электронную и структурную формулы аммиака; определите валентность и степень окисления элементов; укажите тип химической связи
Вспомните свойства аммиака и заполните в тетради схему /заранее написана на доске/
Каким образом необходимо держать сосуд, чтобы собирать аммиак?
Это бесцветный газ, с резким характерным запахом, хорошо растворим в воде. В быту мы знаем его как нашатырный спирт. Аммиак сжижается под небольшим давлением и имеет высокую теплоту испарения.
Учитель рассказывает учащимся, что с получением аммиака из нашатыря (хлорида аммония) и гашенной извести ( гидроксида кальция) в лабораторных условиях они познакомятся на следующем уроке при выполнение Лаб. отыта №7, а синтез аммиака в промышленности осуществляется из азота и водорода на железном катализаторе при температуре 420ОС и давлении 30- 100 Мпа. Эта реакция является обратимой и экзотермической все реакции есть в учебнике/
2NH CI + Ca(OH)2 = Ca CI2 + 2NH3 + 2H2 O
Химические свойства.
- Взаимодействие аммиака с кислородом:
- Взаимодействие аммиака с водой. Понятие о гидрате аммиака.
/демонстрация опыта «Получение аммиака и его растворение в воде/
Если аммиак можно рассматривать как основание, то с чем он будет ещё активно реагировать?
Нашатырный спирт – 3% р-р аммиака в воде,
Аммиачная вода – 25% р-р аммиака в воде.
- Взаимодействие с кислотами.
/ по ходу беседы учащиеся записывают уравнения в тертади._
- окислителями, в частности с кислородом. Реакция горения аммиака в чистом кислороде: 4NH3 + 3O2 = 2N 2 +6 H2 O.
Но аммиак может реагировать с кислородом и по-другому ( при участии катализатора): 4NH3 + O2 = 4NO + 6 H2 O.
За счет выделяющейся при реакции теплоты платиновая спираль раскаляется и ярко светится.
Помните: смеси аммиака с кислородом или воздухом могут взрываться, поэтому они опасны.
NH3 + H2 O = NH3 ∙H2 O = NH4+ + OH-
Эта реакция обратима и в растворе присутствуют нейтральные молекулы аммиака и воды, это аммиачная вода.
Аммиак проявляет свойства основания и могут образовываться, как кислые, так и средние соли:
NH 3 + H2 SO4 = NH4 HSO2
2NH3 + H2 SO4 = (NH4) 2SO4
IV. Д/з. Выучить §42 до солей аммония № 1,2,4,
V. Закрепление материала.
Решение тестового задания с самопроверкой.
На уроке я узнал(а), что Я постараюсь запомнить.
Аммиак – бесцветный газ, с резким характерным запахом, хорошо растворим в воде.
Для аммиака характерны реакции окисления и соединения.
Аммиак окисляется кислородом, проявляя при этом восстановительные свойства.
В реакции соединения аммиак вступает с водой и кислотами.
Тестовое задание «Аммиак»
При описании физических свойств аммиака верными являются характеристики: 1) плохо растворим в воде; 2) бесцветный газ (н. у.); 3) сжижается при небольшом давлении; 4) имеет высокую теплоту испарения. а) 1,2,3 б) 1,3,4 в) 2,3,4 г) 2,3 Укажите газ, который является более легким, чем аммиак: а) CH4 б) Ar в) O2 г) CO2 Массовая доля аммиака в составе нашатырного спирта составляет:
а) 20-25 % б) 5-10% в) 1-3% г) 25-30%
Для молекулы аммиака справедливы следующие утверждения: полярная; 2) плоская; 3) все связи образованы по обменному механизму; 4) может быть донором электронов. а) 1,2,4 б) 2,3,4 в) 1,2,3 г) 1,3,4 В водном растворе аммиака присутствуют частицы:
НЕВЕРНОЙ характеристикой реакции промышленного синтеза аммиака является:
а) необратимая; б) окислительно-восстановительная; в) каталитическая г) экзотермическая
В лаборатории аммиак получают при взаимодействии веществ:
а) NH4CI и CaCI2 б) NH4CI и Ca(OH)2 в) NH4CI и H2SO4 г) NH3∙H2O и HCI
Укажите, при взаимодействии с какими веществами аммиак проявляет свойства основания: 1)H2O 2) HCI 3) O2 4) H2SO4 а) 1,2,3 б) 2,3,4 в) 1,2,3 г) 1,2, 4 Укажите схемы, в которых аммиак является восстановителем 1)NH3 + CuO →N2 + …..
2) NH3 + HCI → 3) NH3 + H2O→ 4) NH3 + O2→ а) 1,2,4 б) 3,4 в) 1,4 г) 1,2
б) NH4HSO4 – 0,2 г) NH4SO4 – 0,2 и(NH4)2SO4 – 0,2
Аммиак: получение и свойства
Аммиак
Строение молекулы и физические свойства
В молекуле аммиака NH3 атом азота соединен тремя одинарными ковалентными полярными связями с атомами водорода:
Геометрическая форма молекулы аммиака — правильная треугольная пирамида. Валентный угол H-N-H составляет 107,3 о :
Аммиак – бесцветный газ с резким характерным запахом. Ядовит. Весит меньше воздуха. Связь N-H — сильно полярная, поэтому между молекулами аммиака в жидкой фазе возникают водородные связи. При этом аммиак очень хорошо растворим в воде, т.к. молекулы аммиака образуют водородные связи с молекулами воды.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поск ольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
Процесс проводят при температуре 500-550 о С и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непровзаимодействовавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Химические свойства аммиака
1. В водном растворе аммиак проявляет основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H + ), он превращается в ион аммония. Реакция может протекать и в водном растворе, и в газовой фазе:
Видеоопыт растворения аммиака в воде можно посмотреть здесь.
2. Как основание, аммиак взаимодействует с кислотами в растворе и в газовой фазе с образованием солей аммония.
Еще один пример : аммиак взаимодействует с водным раствором углекислого газа с образованием карбонатов или гидрокарбонатов аммония:
Видеоопыт взаимодействия аммиака с концентрированными кислотами – азотной, серной и и соляной можно посмотреть здесь.
В газовой фазе аммиак реагирует с летучим хлороводородом. При этом образуется густой белый дым – это выделяется хлорид аммония.
NH3 + HCl → NH4Cl
Видеоопыт взаимодействия аммиака с хлороводородом в газовой фазе (дым без огня) можно посмотреть здесь.
4. Соли и гидроксиды меди, никеля, серебра растворяются в избытке аммиака, образуя комплексные соединения – аминокомплексы.
Гидроксид меди (II) растворяется в избытке аммиака:
Если реакцию проводить в присутствии катализатора (Pt), то азот окисляется до NO:
Также возможно образование Na2NH, Na3N.
При взаимодействии аммиака с алюминием образуется нитрид алюминия:
2NH3 + 2Al → 2AlN + 3H2
Пероксид водорода также окисляет аммиак до азота:
2NH3 + 3CuO → 3Cu + N2 + 3H2O
Урок №30. Аммиак. Физические и химические свойства. Получение и применение
Аммиак – NH 3
Строение молекулы
Физические свойства аммиака
При нормальных условиях — бесцветный газ с резким характерным запахом (запах нашатырного спирта), почти вдвое легче воздуха, ядовит. По физиологическому действию на организм относится к группе веществ удушающего и нейротропного действия, способных при ингаляционном поражении вызвать токсический отёк лёгких и тяжёлое поражение нервной системы. Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Это мы и воспринимаем как резкий запах. Пары аммиака вызывают обильное слезотечение, боль в глазах, химический ожог конъюктивы и роговицы, потерю зрения, приступы кашля, покраснение и зуд кожи. Растворимость NH 3 в воде чрезвычайно велика — около 1200 объёмов (при 0°C) или 700 объёмов (при 20°C) в объёме воды.
Получение аммиака
В лаборатории
Для получения аммиака в лаборатории используют действие сильных щелочей на соли аммония:
NH 4 Cl + NaOH = NH 3 ↑ + NaCl + H 2 O
(NH 4 ) 2 SO 4 + Ca(OH) 2 = 2NH 3 ↑ + CaSO 4 + 2H 2 O
Внимание! Гидроксид аммония неустойчивое основание, разлагается:
NH 4 OH ↔ NH 3 ↑ + H 2 O
В промышленности
Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота:
N 2(г) + 3H 2(г) ↔ 2NH 3(г) + 45,9 кДж
катализатор – пористое железо
температура – 450 – 500 ˚С
давление – 25 – 30 МПа
Это так называемый процесс Габера (немецкий физик, разработал физико-химические основы метода).
Химические свойства аммиака
Реакции с изменением степени окисления атома азота (реакции окисления)
N -3 → N 0 → N +2
NH 3 – сильный восстановитель
4NH 3 + 3O 2 = t = 2N 2 + 6H 2 О
2. Каталитическое окисление аммиака
4NH 3 + 5O 2 = t, кат. Pt – Rh = 4NO + 6H 2 O
3. С оксидами металлов
2NH 3 + 3CuO = 3Cu + N 2 + 3H 2 O
4. С сильными окислителями
2NH 3 + 3Cl 2 = t = N 2 + 6HCl
5. Аммиак – непрочное соединение, при нагревании разлагается
2NH 3 = t = N 2 + 3H 2
Реакции без изменения степени окисления атома азота
(NH 4 ) n А – соли аммония
NH 4 ОН – гидроксид аммония (правильная запись NH 3 •H 2 O )
1. С водой образуется аммиачная вода (нашатырный спирт), обладающий основными свойствами – фенолфталеин в таком растворе окрашивается в малиновый цвет, а красная лакмусовая бумага – в синий:
NH 3 +H 2 SO 4 = NH 4 HSO 4 – гидросульфат аммония
2NH 3 +H 2 SO 4 = (NH 4 ) 2 SO 4 – сульфат аммония
Применение аммиака
Медики используют водные растворы аммиака (нашатырный спирт) в повседневной практике: ватка, смоченная в нашатырном спирте, выводит человека из обморочного состояния. Для человека аммиак в такой дозе не опасен.
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№1. Осуществить превращения по схеме:
а) Азот→ Аммиак → Оксид азота (II)
б) Нитрат аммония → Аммиак → Азот
в) Аммиак → Хлорид аммония → Аммиак → Сульфат аммония
Для ОВР составить е-баланс, для РИО полные, ионные уравнения.
№2. Напишите четыре уравнения химических реакций, в результате которых образуется аммиак.
§ 37. Аммиак
| Сайт: | Профильное обучение |
| Курс: | Химия. 11 класс |
| Книга: | § 37. Аммиак |
| Напечатано:: | Гость |
| Дата: | Понедельник, 8 Ноябрь 2021, 00:46 |
Оглавление
Взаимное отталкивание атомов водорода приводит к увеличению валентного угла между направлениями ковалентных связей N—H от 90° до 107°.
Строение молекулы аммиака. Форма пирамиды в молекуле аммиака и валентный угол 107° при её вершине объясняются образованием связей между гибридными орбиталями атома азота и s-орбиталями атома водорода.
Неподелённая электронная пара четвёртой гибридной орбитали обладает незначительной отталкивающей силой, что объясняет уменьшение валентного угла H—N—H со 109,5° до 107. Расположение трёх ковалентных полярных связей под углом приводит к асимметричному распределению электронной плотности, то есть к полярности молекулы:
Получение аммиака. Аммиак является одним из ключевых продуктов химической промышленности. Его мировое производство растёт вместе с глобальным спросом на удобрения и в настоящее время превышает 220 млн тонн в год. В Республике Беларусь его производит ОАО «Гродно Азот» — более 1 млн тонн в год.
Для получения аммиака в лаборатории нагревают смесь двух твёрдых веществ — хлорида аммония NH4Cl и гидроксида кальция Са(ОН)2 ( рис. 91 ):
Химические свойства. Для аммиака характерны реакции, протекающие как без изменения степени окисления азота, так и окислительно-восстановительные. В первом случае основную роль играет неподелённая электронная пара атома азота. За счёт её образуются новые ковалентные связи по донорно-акцепторному механизму. С другой стороны, наличие атома азота в низшей степени окисления ‒3 обусловливает реакции только с повышением степени окисления. Это означает, что аммиак проявляет свойства восстановителя.
I. Реакции без изменения степени окисления протекают, если аммиак взаимодействует с водой и кислотами. При этом аммиак проявляет основные свойства.
Растворение аммиака в воде приводит к образованию гидрата аммиака NH3 · H2O — слабого основания ( рис. 92 ).
Водные растворы аммиака имеют щелочную среду ( рН > 7 ) и окрашиваются фенолфталеином в малиновый цвет.
Взаимодействие аммиака с кислотами:
II. Реакции с изменением степени окисления атома азота. Это реакции аммиака как восстановителя. Восстановительные свойства аммиак проявляет в реакциях с кислородом. Состав продуктов зависит от условий проведения реакции. В чистом кислороде и на воздухе он сгорает при нагревании (в смесях — взрывается) с образованием азота и воды, а в присутствии катализаторов (платины, оксидов железа(III) и хрома(III)) образуются оксид азота(II) и вода:
Реакция каталитического окисления аммиака важна как этап его переработки в азотную кислоту.
Реакции аммиака с кислотами позволяют получить разнообразные соли аммония.
Соли аммония представляют собой твёрдые кристаллические вещества, хорошо растворимые в воде. Их растворы являются сильными электролитами, диссоциирующими с образованием катиона аммония и аниона кислотного остатка:
Важнейшей особенностью солей аммония является взаимодействие со щелочами с выделением аммиака:
Второй особенностью солей аммония является их термическая неустойчивость. Разложение каждой из солей аммония специфично. Так, широко используемые в качестве разрыхлителей для теста карбонат и гидрокарбонат аммония (пищевая добавка Е503) разлагаются уже при небольшом нагревании с образованием аммиака, углекислого газа и воды:
Хлорид аммония разлагается на аммиак и хлороводород:
Не следует путать нашатырный спирт ( NH3 ∙ H2O ) с нашатырём — солью и минералом состава NH4Cl.
Нашатырь применяют в качестве удобрения на нейтральных и щелочных почвах, используют как флюс для удаления оксидной плёнки при пайке металлов, в гальванических элементах как компонент электролита ( рис. 94 ), карбонат и гидрокарбонат аммония используют в качестве разрыхлителей для теста при выпечке.
Аммиак NH3 проявляет свойства восстановителя в реакциях с кислородом и другими окислителями. Водный раствор аммиака является слабым основанием.
Аммиак получают в промышленности синтезом из водорода и азота, в лаборатории — из хлорида аммония и гашёной извести.
Важнейшие области применения аммиака — производство удобрений и азотной кислоты.
Соли аммония обнаруживают по выделению аммиака при нагревании их со щёлочью.
Вопросы, задания, задачи
1. Из приведённого ряда выпишите формулы:
2. Укажите агрегатное состояние аммиака при давлении 101,325 кПа в следующих температурных интервалах:
3. Определите относительную плотность аммиака по водороду и воздуху. По отношению к какому из указанных газов аммиак легче?
4. Нарисуйте схемы образования водородных связей:
Почему аммиак нельзя собирать методом вытеснения воды?
5. Перечислите условия синтеза аммиака в промышленности. Запишите уравнение этой реакции. Почему синтез ведут при высоком давлении?
6. Рассчитайте объём ( н. у. ) аммиака, выделившегося в реакции хлорида аммония массой 5,35 г с достаточным количеством гидроксида кальция.
8. Составьте уравнения реакций согласно схеме:
9. В четыре пробирки с растворами солей добавили раствор гидроксида натрия.
В первой пробирке выпал белый осадок, в третьей — голубой. Во второй и четвёртой видимых изменений не наблюдали, поэтому их подогрели и к отверстиям поднесли влажную фенолфталеиновую бумагу. При этом бумага стала малиновой над четвёртой пробиркой. Назовите содержимое каждой пробирки, если для определения были предложены соли:
Напишите уравнения соответствующих реакций.
10. Молярная масса газовой смеси, состоящей из аммиака и водорода, равна 14 г/моль. Определите объёмную долю аммиака в смеси.
1. Для аммиака справедливы утверждения:
2. Азот проявляет степень окисления −3 в соединениях:
3. Аммиак образуется в реакциях, схемы которых:
4. Уравнение качественной реакции на ион аммония:
Какие утверждения справедливы для молекулы аммиака
При полном сгорании 100 л аммиака выделилось 33,6 л азота. Вычислите объёмную долю (%) примесей в исходном аммиаке. Объёмы газов измерены при одинаковых нормальных условиях. (Запишите число с точностью до целых.)
Горение аммиака описывается следующим уравнением реакции:
Найдем значение объёма аммиака, при сгорании которого образуется 33,6 л азота. Для этого найдем количество вещества азота:
Согласно уравнению реакции, для образования 2 моль азота требуется 4 моль аммиака. Тогда для образования 1,5 моль азота требуется 3 моль аммиака (с молярной массой 17 г/моль). Найдем его объём:
Таким образом, объём аммиака, необходимый для получения 33,6 л азота, равен 67,2 л. А объем исходного аммиака — 100 л. То есть изначально в аммиаке содержалось примесей. Теперь найдем объёмную долю этих примесей и округлим до десятых:
При полном сгорании 120 л аммиака выделилось 56 л азота. Вычислите объёмную долю (%) примесей в исходном аммиаке. Объемы газов измерены при одинаковых и нормальных условиях. (Запишите число с точностью до целых.)
Горение аммиака описывается следующим уравнением реакции:
Найдем значение объёма аммиака, при сгорании которого образуется 56 л азота. Для этого найдем количество вещества азота (молярная масса 28 г/моль):
Согласно уравнению реакции, для образования 2 моль азота требуется 4 моль аммиака. Тогда для образования 2,5 моль азота требуется 5 моль аммиака (с молярной массой 17 г/моль). Найдем его объём:
Таким образом, объём аммиака, необходимый для получения 33,6 л азота, равен 112 л. А объем исходного аммиака — 120 л. То есть изначально в аммиаке содержалось примесей. Теперь найдем объёмную долю этих примесей и округлим до целых:
При окислении 175 л аммиака в присутствии катализатора выделилось 134,4 л оксида азота(II). Вычислите объемную долю (%) примесей в исходном аммиаке. Объемы газов измерены при одинаковых нормальных условиях. (Запишите число с точностью до десятых.)
Окисление аммиака в присутствии катализатора описывается следующим уравнением:
Найдем количество вещества аммиака, при окислении которого образуется 134,4 л оксида азота(II). Для этого найдем количество оксида азота(II):
Согласно уравнению реакции, 4 моль оксида азота(II) образуется из 4 моль аммиака. Тогда 6 моль оксида азота(II) образуется из 6 моль аммиака. Найдем его объём:
Тогда в исходном аммиаке содержалось примесей. Найдем объемную долю:
При окислении 215 л аммиака в присутствии катализатора выделилось 212,8 л оксида азота(II). Вычислите объемную долю (%) примесей в исходном аммиаке. Объемы газов измерены при нормальных, одинаковых условиях. (Запишите число с точностью до сотых.)
Окисление аммиака в присутствии катализатора описывается следующим уравнением:
Найдем количество вещества аммиака, которое при окисление дает 212,8 л оксида азота(II). Для этого найдем количество оксида азота(II):
Согласно уравнению реакции, 4 моль оксида азота(II) образуется из 4 моль аммиака. Тогда 9,5 моль оксида азота(II) образуется из 9,5 моль аммиака. Найдем его объём:
Тогда в исходном аммиаке содержалось примесей. Найдем объемную долю (с учетом округления):
При взаимодействии 5,6 г гидроксида калия с 5,0 г хлорида аммония получили аммиак. Его растворили в 50 г воды. Определите массовую долю аммиака в полученном растворе. Определите объём 10%-ного раствора
азотной кислоты с плотностью 1,06 г/мл, который потребуется для нейтрализации аммиака.
Cоставим уравнения реакций:
Рассчитаем количество аммиака:
моль
моль
Рассчитаем массовую долю аммиака:
Рассчитаем объем азотной кислоты, который потребуется для нейтрализации аммиака
моль
мл
Верны ли следующие утверждения о производстве аммиака?
А. Реакция синтеза аммиака происходит при обычных температуре и давлении.
Б. В производстве аммиака используются катализаторы.
3) верны оба утверждения
4) оба утверждения неверны
Реакция синтеза аммиака происходит при нагревании и повышенном давлении.
Верны ли следующие суждения о производстве аммиака?
А. В промышленности аммиак получают взаимодействием хлорида аммония и оксида кальция.
Б. Синтез аммиака осуществляется под высоким давлением.
3) верны оба суждения
4) оба суждения неверны
А. В промышленности аммиак получают взаимодействием хлорида аммония и оксида кальция. Нет. Его получают реакцией азота с водородом.
Б. Синтез аммиака осуществляется под высоким давлением. Да, давлением в несколько сотен атмосфер.
Верны ли следующие утверждения о промышленном производстве аммиака?
А. Сырьём для производства аммиака служит хлорид аммония.
Б. Синтез аммиака проводят при высоком давлении.
3) верны оба утверждения
4) оба утверждения неверны
Сырьём для производства аммиака служат азот и водород.
Синтез аммиака действительно проводят при высоком давлении.
Через раствор вещества X пропускали аммиак и в результате реакции наблюдали образование осадка. В другую пробирку с раствором вещества Y также пропускали аммиак, при этом прошла реакция без видимых признаков. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
2) иодоводородная кислота
3) гидроксид натрия
5) нитрат железа(III)
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Из предложенных веществ с аммиаком реагируют нитрат железа(III) и иодоводородная кислота. Составим уравнения реакций.
При взаимодействии нитрата железа(III) и аммиака образуется гидроксид железа(III):
Веществом X является нитрат железа (III). (5)
При взаимодействии иодоводородной кислоты и аммиака образуется растворимый иодид аммония:
Веществом Y является иодоводородная кислота. (2)
Верны ли следующие суждения о производстве аммиака?
А. В промышленности аммиак получают синтезом из простых веществ.
Б. Реакция синтеза аммиака экзотермическая.
3) верны оба суждения
4) оба суждения неверны
Верны оба суждения.
В промышленности аммиак получают синтезом из простых веществ.
Это реакция обратимая, экзотермическая, каталитическая.
Реакция синтеза аммиака эндотермическая, так как на ее проведение требуется огромное кол-во теплоты, давления и катализаторы
Реакция синтеза аммиака ЭКЗОтермическая. При образовании 1 моль аммиака выделяется 45,94 кДж тепла.
Процесс синтеза проводят при высокой температуре для увеличения скорости реакции, хотя это и смещает равновесие в сторону исходных веществ.
Верны ли следующие суждения о научных принципах промышленного синтеза аммиака?
А. Синтез аммиака осуществляют на основе принципа циркуляции.
Б. В промышленности синтез аммиака осуществляют в «кипящем» слое.
3) верны оба суждения
4) оба суждения неверны
Особенности промышленного синтеза аммиака необходимо помнить.
Но какое-то пояснение то надо написать.
вот «какое-то» и написали
Через раствор, содержащий серную кислоту, пропустили 6,72 л (н. у.) аммиака до образования средней соли. Масса образовавшейся при этом соли равна_г. (Запишите число с точностью до десятых.)
n(аммиака) = V/V_m = 6,72/22,4 = 0,3 моль
количество моль сульфата аммония = половине количества моль аммиака, значит
m(сульфата аммония)= 0,5*n(аммиака)*M= 19,8 г
Правильный ответ №1,тк 0,3:2=0,15 моль, а масса сульфата аммония равна 134 г/ моль * 0,15 моль=20,1 г.
Правильный ответ №2
молярная масса сульфата аммония равна 132 г/моль
Вычислите максимально возможный объём (н. у.) аммиака, который может быть получен исходя из 40 л водорода и 30 л азота. Ответ укажите в литрах с точностью до десятых.
Объёмы газов, вступающих в реакцию и образующихся в результате реакции, соотносятся как небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях реакций.
| было | 30 л | 40 л | 0 |
| изменение | − x л | − 3x л | + 2x л |
| стало | (30−x) л | (40−3x) л | 2x л |
Согласно уравнению реакции, каждый объём азота реагируют с тремя объёмами водорода, и при этом образуется два объёма аммиака. Максимально возможный объём аммиака образуется, когда один из реагентов потратится полностью.
Тогда, И максимально возможный объём аммиака равен
=