Распад белков как называется
Обмен белков все, что нужно знать об этом процессе
На основе чего стояться практически все планы питания? На белке! Хочешь похудеть – ешь больше белка. Хочешь набрать мышечную массу – ешь больше белка. Как работает этот универсальный нутриент? Давайте попробуем разобраться в таком вопросе, как обмен белков в организме человека.
Общие сведения
Как и в случае с другими нутриентами, процесс белкового обмена осложнен тем, что это – не конечный продукт метаболизма, а, значит, он должен пройти первичную трансформацию, благодаря которой приобретет нормальный вид для организма. Все дело в структуре молекулы белка. В первую очередь – это сложная структура с большим количеством внутренних связей. Как ни странно, но практически все органические соединения состоят из белковых тканей, или связаны теми или иными видами аминокислот.
Аминокислота – это базовая единица. Для простейшего сравнения мы можем проводить аналогии с глюкозой или ненасыщенными жирными кислотами, до которых распадается наша пища. Если все углеводы распадаются на одинаковые элементы, как и жиры, то, на какие аминокислоты распадется белок, зависит от его изначального состава и способа приготовления.
Так, изначально белок находиться в своей завершенной сложной структуре. И в этом виде, наш организм не способен его усваивать вовсе. Пробовали ли вы есть сырое мясо или яйца? Сколько всего вы можете съесть такого продукта в граммах, чтобы вам не стало плохо? Обычно, для нормального человека – это ограничивается 100-150 граммами, а то и меньше. Поэтому традиционно белок готовят на огне. В этот момент, под воздействием температуры, происходит его денатурация. Разрушение связей, которые удерживают молекулу в стабильном состоянии, называют денатурацией. Только в сильно денатурированном виде, наш организм способен справиться с дальнейшим разложением белка на аминокислоты. И даже в этом случае он прилагает значительные усилия для разрыва связей, чтобы не повредить сами аминокислоты, так как в случае повреждения, аминокислоты пережигаются до уровня простых углеводов.
Этапы распада белков в организме
Естественно, что первичный процесс переваривания, как и синтез новых тканей, происходит не одномоментно. Есть определенные ограничения, как в скоростном, так и в объемном метаболизме белков в клетках организма. Постараемся рассмотреть подробнее.
В первую очередь, идет процесс первичного переваривания. В отличие от метаболизма жиров или карбогидратов. Даже этот этап можно разделить на 2: первичное денатурирование белков до более простых кислот и дальнейшее всасывание в кишечнике.
Запомните: именно кишечник, а не желудок, отвечают за преобразование белков в аминокислоты и их дальнейшее всасывание.
Дальше у белка есть 2 пути. Первый путь – это когда в организме имеется недостаток в калориях. В этом случае, все аминокислоты, попавшие в кровь, закрывают дыры в разрушенных тканях, а оставшиеся пережигаются на энергию. В случае, если баланс калорийности и трат положительный, или организм имеет достаточно разогнанный метаболизм, то здесь ситуация другая. В этом случае аминокислоты проделают сложный путь и трансформируются во все необходимые для поддержание нормального функционирования сегменты, а из остатка будет синтезирован избыток мышечной ткани.
Факторы, влияющие на скорость и объем синтеза белка из внешних аминокислот
Рассматривая белковый обмен, как комплексный процесс, нужно учесть все факторы, которые влияют на синтез новых белковых структур из стандартных аминокислот. Так как при нарушении любого из них, все полученные путем сложной ферментации и денатурации аминокислоты просто уйдут в качестве энергии.
Виды белков
Несмотря на кажущуюся простоту, структура белковой ткани настолько сложна, что характеризуют их исключительно по аминокислотному составу. В то же время, существуют упрощенные классификации:
Рассмотрим полную классификацию белковых продуктов для того, чтобы понять, как те или
иные изделия метаболизируются в нашем организме.
| Тип белка | Источник белковой ткани | Скорость усвоения | Аминокислотный состав | Входящие аминокислоты |
| Сывороточный | Сыворотка, и классический сывороточный протеин. | Относительно высокая | Полный | Изолейцин, лейцин, валин, гистидин, аргинин, фенилаланин, триптофан, лизин. |
| Молочный | Любые молочные продукты. Начиная от молока и заканчивая сыром. | Относительно высокая | Полный | Изолейцин, лейцин, валин, гистидин, аргинин, фенилаланин, триптофан, лизин. |
| Мясной | Мышечные ткани животного происхождения. | Относительно высокая | Полный | Изолейцин, лейцин, валин,триптофан, лизин. |
| Яичный | Яйца различных животный. | Относительно невысокая | Полный | Изолейцин, лейцин, валин. |
| Соевый | Синтезируется или добывается из растительной сои. | Относительно невысокая | Неполный | Изолейцин, лейцин, валин, триптофан, лизин. |
| Растительный | В основном, это тот белок, который мы получаем с крупами, макаронами и выпечкой. | Предельно низкая | Неполный | Изолейцин, гистидин, аргинин, лейцин, валин. |
| Другие источники белка | В основном, это орехи или продукты синтезированного белка. | Вариативно | Зависит от самого источника белка | Изолейцин, лейцин, валин. Остальное зависит от самого источника белка. |
Белок и спорт
Для поддержания нормального уровня белкового метаболизма обычному человеку нужно употреблять порядка 1-го грамма чистого белка полного аминокислотным составом на килограмм тела. В то же время, спортсменам белок более важен. Поэтому они не только употребляют значительно большее количество белка, но и делят его на разные типы и употребляют в разное время. Так, в частности из-за возможности белковых тканей полностью останавливать катаболизм в мышечных тканях, очень часто быстрым источником белка является сыворотка или синтетический белок с предельной скоростью усваивания. В то же время, для замедления ночного катаболизма, спортсмены используют белок с низкой скоростью усваивания, которая помогает в ночное время поддерживать нормальный аминокислотный баланс в организме. Традиционно для этого используют творог или его субстраты.
Однако для чего спортсменам белок? Все очень просто. Для спортсмена обмен белков – это:
Нарушение обмена белковых тканей
Очень часто, рассматривая хронические и клинические нарушения обмена метаболизма у человека, люди не затрагивают процессы нарушения обмена белков. А ведь его намного легче получить, чем нарушение метаболизма в целом. Нарушение обмена белков получается в виду следующих причин:
В зависимости от причины, нарушение обмена белков может привести к разным последствиям. Однако в отличие от нарушения жирового обмена, он приведет не только к тому, что вы наберете лишние килограммы, но и может полностью вывести ваш организм из строя. Некоторые болезни, связанные с нарушением белкового обмена – панкреатит и панкреонекроз, могут и вовсе привести к смертельному исходу. Поэтому не стоит пренебрегать качественной белковой пищей в вашем рационе.
Распад белков как называется
В норме у новорожденных при голодании количество высвобождающихся в результате протеолиза аминокислот примерно в 2-3 раза превышает подобные показатели натощак у взрослых.
Не ясны причины более высоких темпов обновления тела и разрушения мышечного белка у недоношенных новорожденных, но более высокий темп протеолиза у незрелых новорожденных может значительно влиять на нормальный рост, чтобы обеспечить достаточное количество аминокислот для ремоделирования ткани, аккреции белка и гомеостаза глюкозы.
Мало информации относительно молекулярной регуляции распада белка у новорожденных. Были проведены несколько исследований недоношенных детей с целью выяснить, какие из систем распада белка являются активными и как они функционируют. Статьи на нашем сайте дадут общие представления о катаболизме белков.
Как только белок образовался, он сразу же становится объектом распада. Некоторые белки, такие как коллаген и гемоглобин, сравнительно устойчивы к деградации, и, следовательно, их оборот происходит медленно. Другие белки распадаются легко, особенно те, которые выполняют важную регулирующую функцию либо в той или иной степени повреждены, или те, которые имеют погрешность в аминокислотной последовательности, вызванную погрешностями в транскрипции.
Детали молекулярных основ распада белка, или протеолиза, описаны не столь подробно, как система синтеза белка. Однако подобно синтезу регулирование распада белка включает компонент, направленный на специфические белки, и компонент, который регулирует общий уровень распада белка в тканях и способствует изменениям в содержании белка. Примером того, как распад отдельного белка может вызвать заболевание, является муковисцидоз (кистозный фиброз).
Удаление фенилаланина в позиции 508 из CFTR приводит к дефектам сворачивания, чувствительным к температуре и преждевременному распаду в клетке, предотвращая перемещение фенилаланина к поверхности клетки. Отсутствие CFTR в эпителиальных клетках дыхательных путей нарушает гидратацию в их просвете и увеличивает восприимчивость к инфекции. Примером согласованного увеличения скорости деградации всех белков ткани, которое позволяет всей ткани адаптироваться к изменениям окружающей среды, является усиленный протеолиз белков мышечной ткани в ответ на ряд стрессовых состояний, в том числе на голодание, ацидоз и термическую травму.
В эукариотических клетках расщепление белка осуществляется большим количеством специфических и неспецифических протеаз. Большинство этих ферментов деградации может быть связано с одной из трех основных составляющих клеточного ращепления белка: убиквитин-протеасомным путем, аутофагально-лизосомальной системой, а также кальций- или кальпаин-зависимой системой.
Убиквитин-протеасомная система в основном разрушает внутриклеточные белки, в то время как аутофагально-лизосомальная система — белки мембраны и эндоцитозные белки. Кальций-зависимые тиоловые протеазы, известные как кальпаины, широко экспрессированы и вовлечены в ряд основных клеточных процессов, хотя их физиологическая функция в развитии организма человека недостаточно понятна.
Другой класс протеолитических веществ — это семейство каспаз, или ферментов, вызывающих распад белка. Каспазы являются основными участниками апоптоза, который удаляет старые, поврежденные или потенциально опасные клетки. Исследования сигнальных путей, регулирующих распад белка, доказали, что эти процессы сложны и являются столь же тщательно контролируемыми, как и процессы синтеза белка.
Распад белков
Распад белка и выведение азота из организма происходят постоянно, при поступлении белка с пищей, так и при голодании. Количество единого азота, а следовательно, распадающегося тканевого белка, находится в зависимости от.характера питания. Минимальные затраты белка наблюдаются при питании углеводами и белковом голодании. При обильном введении в организм крахмала и сахара и при отсутствии в белков выделение азота может быть и 3—3% раза меньше, чем при полном голодании. Углеводы в этом случае выполняют так называемую сберегающую белки роль.
Распад белков в организме, происходящий при отсутствии белков в пище и достаточном введении всех других питательных веществ (углеводов, жиров, минеральных солей, воды, витаминов), показывает те минимальные затраты, которые связаны с основными процессами жизнедеятельности. Эти наименьшие для организма, находящегося в покое, потери белка, пересчитанные на 1 кг веса тела, были названы М. Рубнером коэффициентом изнашивания.
Коэффициент изнашивания в среднем для взрослого человека в состоянии покоя равен 0,028—0.065 г азота на 1 кг веса тела в сутки. Это означает, что при весе в 70 кг потери азота составляют в сутки 2—4,5 г, соответствует распаду 12.5—28 г белка.
Важнейшие азотистые продукты распада белка, выделяемые с мочой и потом, это — мочевина, аммиак и мочевая кислота.
NH 3 и (NH 4 ) 2 СО 3 токсичны для организма; мочевина же представляет собой относительно безвредный продукт обмена; поэтому синтез мочевины в печени имеет большое значение для организма. Обезвреживание NH3 происходит еще за счет образования из него амидной группы глютамина.
С мочой выделяются и другие азотистые вещества, например мочевая кислота — 2, 6, 8-триоксипурин. Мочевая кислота поступает в кровь непосредственно из тканей, являясь продуктом распада нуклеиновых кислот. Кроме мочевой кислоты, выделяются с мочой в незначительных количествах и другие менее окисленные пуриновые вещества: аденин (6-аминопурин), гуанин (2-амино-6-оксипурин) и их производные — гипоксантин (6-оксипурин), ксантин (2,6-диоксипурин). К азотистым продуктам распада, выделяемым с мочой, относятся также креатин и его ангидрид — креатинин.
Распад белков
Белки – это основной строительный материал различных биологических структур клеток организма, поэтому обмен белков имеет первостепенную роль в их разрушении и новообразовании.
У здорового человека за сутки обновляется 1-2% общего количества белков тела. Период полураспада белков в мышцах и коже – 80 дней, в мозгу – 180 дней, в сыворотке крови и печени – 10 дней, у некоторых белков – гормонов – часы и минуты.
Главным путем распада белков в организме является ферментативный гидролиз – протеолиз. Протеолитические ферменты локализованы в лизосомах и в цитозоле клеток. Распад клеточных белков приводит к образованию аминокислот, которые используются в этой же клетке или выделяются из нее в кровь.
В желудочно-кишечном тракте локализованы протеолитические ферменты различной специфичности. В желудочном соке находится пепсин, который быстро гидролизует в белках пептидные связи, образованные карбоксильными группами, прежде всего ароматических аминокислот (фенилаланина, тирозина, триптофана).
Протеолиз в кишечнике обеспечивают трипсин, химотрипсин, дипептидазы и другие, которые участвуют в более глубоком гидролизе белков по сравнению с гидролизом в желудке.
Кроме того, слизистая кишечника содержит группу аминопептидаз, которые при действии на полипептидные цепи поочередно высвобождают N-концевые аминокислоты.
На скорость гидролиза белков пищи указывает то, что через 15 минут после приема человеком белка, содержащего меченые по азоту ( 15 N) аминокислоты, изотоп 15 N обнаруживается в крови. Максимальная концентрация аминокислот достигается через 30-50 минут после приема белка с пищей.
Всасывание аминокислот происходит в основном в тонком кишечнике, где функционируют специфические системы транспорта аминокислот. Кровотоком аминокислоты транспортируются во все ткани и органы.
Основные понятия и термины раздела
Амфотерность – проявление двойственных свойств.
Белки – высокомолекулярные азотсодержащие вещества, состоящие из аминокислот, связанных между собой пептидными связями.
Вторичная структура белка – способ укладки полипептидной цепи в упорядоченную структуру.
Дезаминирование – процесс отщепления аммиака.
Декарбоксилирование – процесс отщепления оксида углерода (IV).
Заменимые аминокислоты – аминокислоты, синтезируемые в организме в достаточном количестве.
Изоэлектрическая точка аминокислоты (белка) – значение рН среды, при котором заряд аминокислоты (белка) равен нулю.
Незаменимые аминокислоты – аминокислоты, не синтезируемые в ораганизме, а поступающие в него с пищей.
Первичная структура белка – порядок чередования аминокислотных остатков в полипептидной цепи.
Субъединица – единая полипептидная цепь в эпимолекуле.
Третичная структура белка – способ укладки полипептидной цепи в пространстве.
Четвертичная структура белка – структура, состоящая из определенного числа полипептидных цепей, занимающих строго фиксированное положение относительно друг друга, вследствие чего белок обладает определенной активностью.
Эпимолекула (мультимер) – белок, обладающий четвертичной структурой.
Вопросы и задания
1. Какие органические вещества называются аминокислотами? Какие химические свойства характерны для аминокислот?
2. На примере аспарагиновой кислоты покажите амфотерность аминокислот.
3. Какие продукты образуются при дезаминировании аланина и аспарагиновой кислоты?
4. Какие диамины образуются в результате декарбоксилирования тирозина и гистидина? Напишите схемы реакций.
5. Пользуясь таблицей 1, выпишите формулы протеиногенных аминокислот: а) с углеводородными (гидрофобными) боковыми радикалами; б) с гидрофильными ионизирующимися боковыми радикалами.
6. В чем состоит отличие понятий «аминокислотный остаток» и «первчиная структура белка»?
7. Дипептид карнозин-β-аланилгистидин принимает участие в биохимических процессах, протекающих в мышечной ткани, а дипептид аспартам, обладающий в 200 раз более сладким вкусом, чем сахароза, состоит из остатков аспарагиновой кислоты и метилового эфира фенилаланина. Составьте структурные формулы этих дипептидов.
8. Напишите структурные формулы всех возможных трипептидов, в состав которых входят аланин, глутамин и тирозин. Назовите их.
9. Что понимают под вторичной структурой белка?
10. Что понимают под третичной структурой белка? Какие типы взаимодействий поддерживают эту структуру?
11. Укажите тип взаимодействия между боковыми радикалами аминокислотных остатков: а) тир, глу; б) цис, цис; в) гис, асп.
12. Укажите типы взаимодействий, возникающих между фрагментами полипептидной цепи при формировании третичной структуры: а) –цис-ала-тир-цис-иле-глн; б) –глу-асн-сер-лиз-тре-асп.
13. Какова специфичность действия протеоличитеских ферментов: химотрипсина, пепсина, трипсина? Как называются ферменты, ускоряющие гидролиз дипептидов
Проверьте себя (экспресс – тест)
1. Белки – биополимеры, мономерами которых являются:
а) карбоновые кислоты ; б) амины; в) β-аминокислоты ;
г) α-аминокислоты; д) амиды карбоновых кислот.
2. В белках аминокислотные остатки связаны между собой:
а) сложноэфирными связями ; б) водородными связями;
в) пептидными связями ; г) ангидридными связями;
д) гликозидными связями.
3. К основным аминокислотам относят:
а) аланин б) лизин в) тирозин
г) глутамин д) триптофан
4. В изоэлектрической точке пептиды имеют:
а) отрицательный заряд
б) положительный заряд
5. Заряд дипептида лизилпролина в кислой среде равен:
а) 0; б) 2+; в) 1+; г) 2-; д) 1-.
6. Какое определение неправильно характеризует белки?
а) это высокомолекулярные пептиды;
б) это бифункциональные полимеры;
г) это полипептиды, образованные остатками α-аминокислот.
7. Первичная структура – это…
а) последовательность аминокислот в белке;
б) аминокислотный состав белка;
в) молекулярная формула белка;
г) строение α-спирали белка.
8. Какое взаимодействие не влияет на формирование третичной структуры?
а) водородные связи между функциональными группами;
б) гидрофобное взаимодействие между углеводородными радикалами;
в) дисульфидная связь между цистеиновыми остатками;
9. Денатурация белков приводит к разрушению …..
а) пептидных связей; б) первичной структуры;
в) водородных связей; г) вторичной и третичной структуры.
10. Укажите общую качественную реакцию на белки и пептиды:
а) ксантопротеиновая реакция; б) биуретовая реакция;
в) реакция Льюиса; г) реакция Миллона.
11. Какое из перечисленных веществ не относится к белкам?
а) гемоглобин; б) инсулин;
в) пенициллин; г) рибонуклеаза.
12. Укажите, важнейшую на ваш взгляд, биологическую функцию белков?
а) катализ биохимических процессов;
б) транспорт белков;
в) регуляция иммунной системы живых организмов;
г) обеспечение строительного материала для тканей.
Дата добавления: 2015-02-28 ; просмотров: 5100 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Белки (протеины, полипептиды)
Дано определение, состав, структура и функции белков организма человека. Приведена их классификация. Описаны синтез и катаболизм белков.
Белки (протеины, полипептиды)
Определение
Белки – высокомолекулярные азотсодержащие соединения, состоящие из аминокислот.
Молекулярная масса белков
Состав белков
Несмотря на то, что в составе белковой молекулы могут входить десятки, сотни и тысячи аминокислот, все белки синтезируются из 20 видов аминокислот. Эти аминокислоты имеют следующие названия: глицин, аланин, серин, цистеин, треонин, метионин, валин, лейцин, изолейцин, аспарагиновая кислота, аспарагин, глутаминовая кислота, глутамин, лизин, аргинин, фенилаланин, тирозин, триптофан, гистидин, пролин.
Структура белков
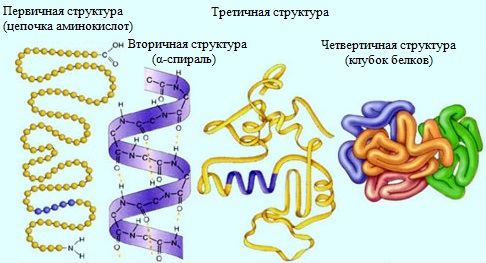
Различают четыре уровня структурной организации молекулы белка (рис.1).
Рис.1. Структуры белков
Первичная структура. Аминокислоты соединяясь друг с другом пептидной связью образуют длинные неразветвленные цепи – полипептиды.
Вторичная структура. Эта структура белков характеризует их определенную пространственную организацию. Например, многие белки имеют форму спирали. Фиксируется вторичная структура дисульфидными и водородными связями.
Третичная структура. Третичная структура отражает пространственную организацию вторичной структуры. Например, вторичная структура в виде спирали может укладываться в пространстве в виде глобулы, то есть иметь шаровидную или эллипсовидную форму. Примером белка, обладающего третичной структурой является миоглобин.
Четвертичная структура. Этой структурой обладают некоторые белки. Четвертичная структура – сложное образование, состоящее из нескольких белков, имеющих свою первичную, вторичную и третичную структуры. Примером белка, обладающего четвертичной структурой является гемоглобин.
Классификация белков
Существуют разные классификации белков. Приведу две классификации.
Согласно первой классификации белки делятся на простые (протеины) и сложные (протеиды). Простые белки состоят только из аминокислот. Пример: альбумины и глобулины крови. В молекуле сложного белка, кроме аминокислот, имеется еще неаминокислотная часть. В зависимости от неаминокислотной части выделяют такие сложные белки как нуклеопротеиды (содержат нуклеиновую кислоту), липопротеиды (содержат липоид) и. т.д.
Согласно второй классификации белки делятся на группы на основе своей пространственной формы. Различают глобулярные и фибриллярные белки. Молекулы глобулярных белков имеют шаровидную или эллипсовидную форму. Примерами таких белков являются альбумины и глобулины крови. Молекулы фибриллярных белков вытянутые. Их длина значительно превышает их диаметр. Примером фибриллярного белка является белок коллаген.
Функции белков
Функции, которые выполняют белки в организме настолько важны, что белки еще называют протеинами (от греч. слова proteus – первый, главный). Различают следующие функции белков в организме человека.
Перевариваривание белков в организме человека
В организм человека с пищей попадает в сутки около 100 г белков.
Расщепление белков начинается в полости желудка под воздействием желудочного сока, содержащего протеолитический фермент пепсин. Под воздействием пепсина в белках разрываются пептидные связи, образующие первичную структуру. В результате белковые молекулы превращаются в смесь полипептидов различной длины.
Дальнейшее переваривание белков протекает в тонкой кишке под воздействием ферментов: трипсина, химотрипсина и эсталазы, которые синтезируются в поджелудочной железе. В результате полипептиды расщепляются до олигопептидов, состоящих из нескольких аминокислот.
Завершается переваривание белков в тонкой кишке под воздействием ферментов кишечного сока. Образовавшиеся в результате этого процесса аминокислоты всасываются в кровь и по воротной вене поступают в печень и далее попадают в большой круг кровообращения.
Синтез белков
Синтез белков протекает в четыре этапа.
Первый этап синтеза белков протекает в ядрах клеток и называется транскрипцией.
Второй этап синтеза белков протекает в цитоплазме клетки и называется рекогницией.
Третий этап синтеза белков протекает на рибосомах и называется трансляцией.
Четвертый этап синтеза белков протекает в эндоплазматической сети и комплексе Гольджи и называется процессингом.
Более подробно синтез белков в мышечных волокнах описан в отдельной статье.
Катаболизм белков
В организме человека происходят одновременно два процесса: синтез белков и их распад (катаболизм). В тканях организма катаболизм белков происходит под воздействием внутриклеточных протеиназ, которые называются катепсинами. Эти ферменты локализованы в лизосомах.
Также катаболизм белков осуществляется особыми мультиферментными комплексами, которые называются протеосомы.
По данным С.С. Михайлова (2009) в сутки внутриклеточному протеолизу подвергается 200-300 г собственных белков организма. При этом при распаде как пищевых, так и собственных белков организма образуются одни и те же 20 видов аминокислот.