Резонансные структуры как составлять
Как рисовать резонансные структуры
Мы можем нарисовать две или более структур Льюиса для некоторых молекул и многоатомных ионов, не меняя положения атомов в структуре. В этом случае только электронное распределение отличается от одной
Содержание:
Что такое резонансная структура
Мы можем нарисовать две или более структур Льюиса для некоторых молекул и многоатомных ионов, не меняя положения атомов в структуре. В этом случае только электронное распределение отличается от одной структуры к другой. Эти структуры называются резонансные структуры или же содействующие структуры. Но фактическая молекула имеет промежуточную структуру из этих возможных структур Льюиса.
Первый шаг рисования резонансных структур начинается с рисования всех возможных структур Льюиса. Если у него только одна структура Льюиса, у него нет резонансного гибрида.
Как определить молекулы, имеющие резонанс
Резонанс существует только тогда, когда структура Льюиса имеет несколько связей и соседний атом, по крайней мере, с одной неподеленной парой. Общая форма резонанса иллюстрируется ниже. Стрелки используются для обозначения смещения электронов из одной резонансной структуры в другую.
Как рисовать резонансные структуры
Структуры Льюиса
Пример 1: СО3 2- ион
Шаг 1
Рассчитайте общее количество валентных электронов от каждого атома.
Атомы кислорода (3 * 6) = 18
Шаг 2
Когда имеется более одного типа атомов, оставьте наименьший электроотрицательный или металлический атом в качестве центрального атома.
Углерод является центральным атомом в СО3 2- ион
Шаг 3
Объедините каждый атом с единственной связью с центральным атомом, внося один электрон от каждого атома для связи.
Шаг 4
Подсчитайте электроны в валентной оболочке, чтобы проверить, завершен ли октет.
Атому углерода нужен еще один электрон, а каждому атому кислорода нужен еще один электрон, чтобы завершить октет.
Шаг 5
Если нет, добавьте еще несколько связей, пока все октеты не будут заполнены.
** Оставьте несвязанные электроны в виде точек и нарисуйте одну линию (-) для одинарной связи и две линии (=) для двойной связи.
Если мы добавим одну связь между атомом углерода и атомом кислорода, то и атом углерода, и атом кислорода завершат октет.
Шаг 6
Окончательная структура может быть записана следующим образом.
Шаг 7
Теперь мы можем нарисовать возможные резонансные структуры, как обсуждалось в разделе 1.
Мы можем нарисовать три резонансные структуры для СО3 2- ион, как указано выше.
Давайте возьмем еще два примера, чтобы научиться рисовать резонансные структуры.
Пример 2: O3 молекула
Мы можем использовать ту же процедуру, что описана выше, чтобы получить структуру Льюиса. Это дает следующую структуру, и имеет несколько связей и соседний атом с одной неподеленной парой электронов.
Таким образом, мы можем нарисовать резонансные структуры для O3 Молекула следующим образом.
Пример 3: Карбоновая кислота
Мы можем получить следующие резонансные структуры, выполнив те же шаги, что и упомянутые выше.
Структура Льюиса: простой метод представления конфигурации атомов в молекуле, показывающий неподеленные пары электронов и связи между атомами.
Написание резонансных структур. (Н.о.). Получено 15 ноября 2016 г.
Резонансные структуры как составлять
Если с индуктивным эффектом обычно проблем не бывает, то второй тип электронных эффектов гораздо труднее поддается освоению. Это очень плохо. Теория резонанса (мезомерия) была и остается одним из важнейших инструментов обсуждения структуры и реакционной способности органических соединений и заменить ее нечем. А как же квантовая наука?! Да, правда, в нашем веке стали легкодоступными квантово-химические расчеты, и теперь каждый исследователь или даже студент, потратив весьма немного времени и сил, может бесплатно раскочегарить на своем компьютере расчеты, уровню которых еще 20 лет назад позавидовали бы все нобелевские лауреаты. Увы, результаты расчетов не так просто использовать – они плохо поддаются качественному анализу и зрительно не очень понятны. Сидеть и смотреть на бесконечные столбики цифр и рассматривать запутанные и перегруженные картинки орбиталей и электронной плотности можно долго, но пользу из этого извлекают немногие. Старая добрая теория резонанса в этом смысле гораздо эффективнее – она быстро и довольно надежно дает именно качественный результат, позволяет видеть, как распределена электронная плотность в молекуле, найти реакционные центры, оценить устойчивость важных частиц, участвующих в реакциях. Поэтому без умения нарисовать резонансные структуры, оценить их вклад, и понять, на что влияет делокализация, никакой разговор об органической химии невозможен.
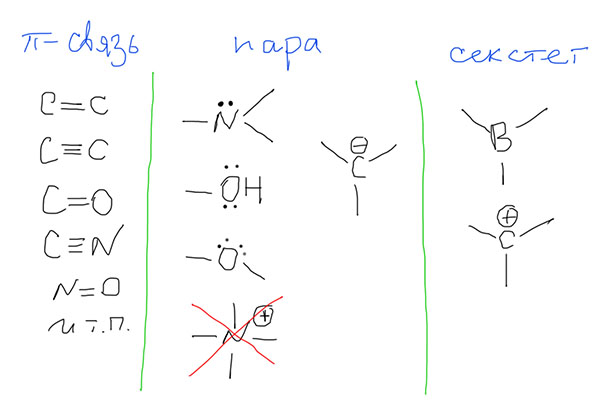
Есть ли разница между понятиями мезомерии и резонанса? Была когда-то, но уже давно не имеет значения – сейчас это интересно только историкам химии. Будем считать, что эти понятия взаимозаменимы, можно использовать какое-то одно или оба в любых пропорциях. Один нюанс есть – когда говорят не о делокализации в общем, а об электронном эффекте заместителя, предпочитают термин мезомерный эффект (и обозначают соответственно буквой M). Кроме того, еще используют и слово “сопряжение” (точнее, π-сопряжение).
И когда возникает эта мезомерия? Это понятие применимо только к π-электронам и только в том случае, если в молекуле есть хотя бы два атома с такими электронами, расположенные рядом. Атомов таких может быть сколько угодно, хоть миллион, и расположены они могут быть не только линейно, но и с любыми разветвлениями. Необходимо только одно – чтобы они были рядом, образовывали неразрывную последовательность. Если последовательность линейна, она называется “цепью сопряжения”. Если разветвлена, это усложняет дело, так как возникает не одна цепь сопряжения, а несколько (это называется кросс-сопряжение), но на этом этапе про это можно не думать, мы не будем внимательно рассматривать такие системы. Важно, что любой атом без π-электронов прерывает такую последовательность (цепь сопряжения), или разрывает ее на несколько независимых.
На каких атомах есть π-электроны?
Кроме этого в сопряжении участвуют пустые π-орбитали в атомах с 6-ю валентными электронами (секстетных атомах): бора, углерода с положительным зарядом (в карбениевых ионах), а также аналогичных частицах с атомами азота, кислорода (это пока отложим в сторону). Договоримся пока не трогать элементы третьего и т.д. периодов, даже серу и фосфор, потому что для них нужно учитывать участие d-оболочек и не работает правило октета Льюиса. Корректно рисовать граничные структуры для молекул с участием этих элементов не так просто, но нам это, скорее всего, и не понадобится. Если понадобится, рассмотрим отдельно.
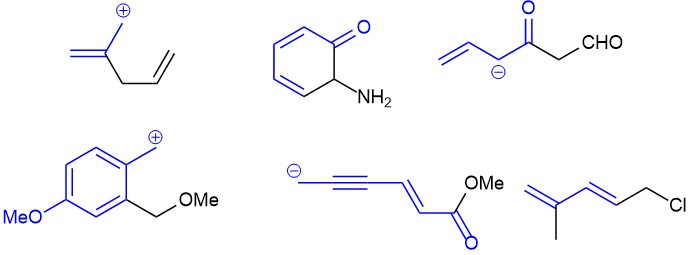
Поищем сопряженные фрагменты в реальных молекулах. Все просто – находим кратные связи, атомы с парами и секстетные атомы, находящиеся рядом друг с другом в любых (пока) комбинациях. Важно, что наблюдатель, идущий по цепи сопряжения, не должен наступать на атомы, не принадлежащие к этим трем типам. Как только встречаем такой атом, цепь заканчивается.
Теперь посмотрим на то, как это изображать. Изображать будем двумя способами – стрелками смещения электронной плотности и резонансными (граничными) структурами.
Тип 1. Находим в сопряженной системе донорные и акцепторные центры.
Тип 2. Кроме донора и акцептора еще и кратные связи.
Если двойных связей не одна, а несколько, выстроенных в цепочку, то ситация усложняется не сильно. Стрелками показываем смещение плотности от пары, и последовательное смещение каждой двойной связи вплоть до заполнения секстета потребует дополнительных стрелок. Граничных структур по-прежнему две, и вновь вторая намного выгоднее и близко отражает реальную структуру катиона.
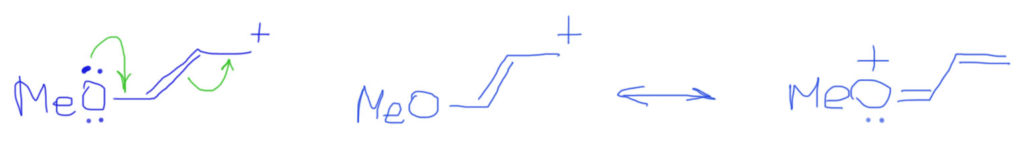
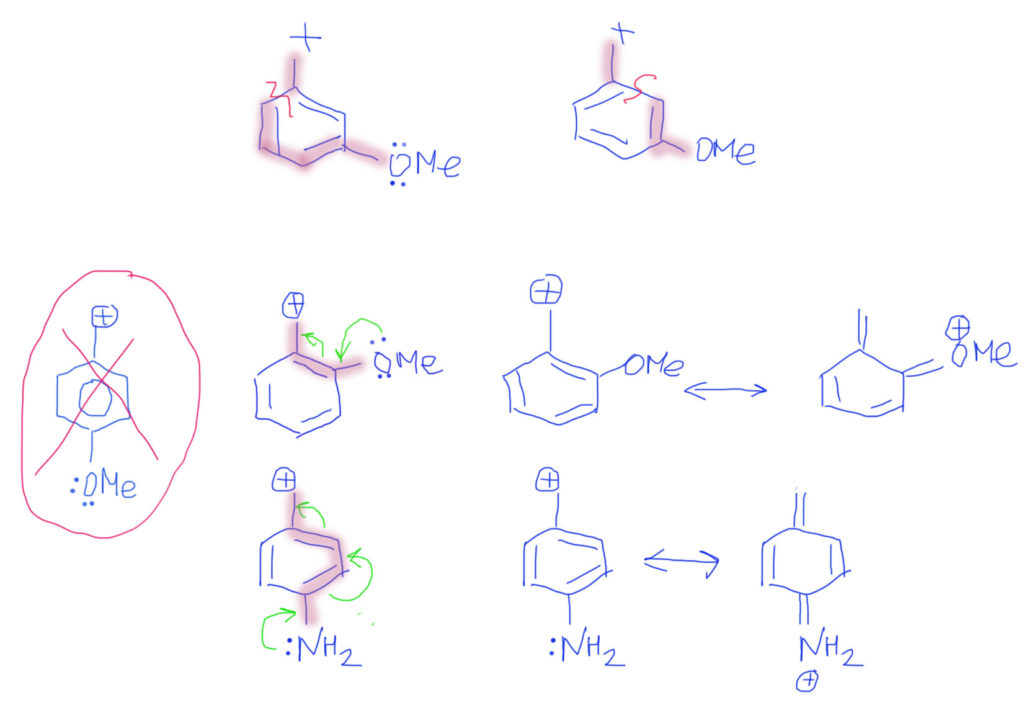
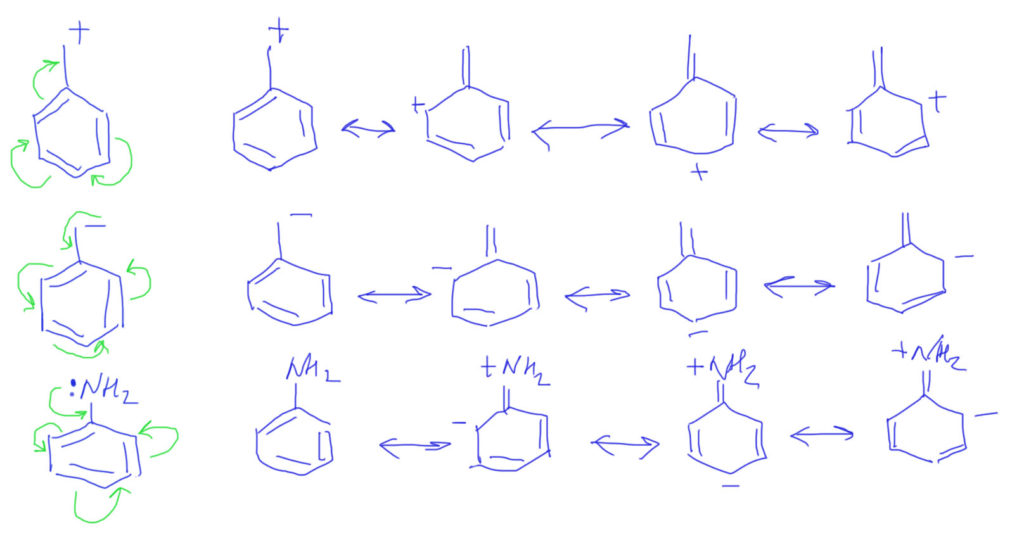
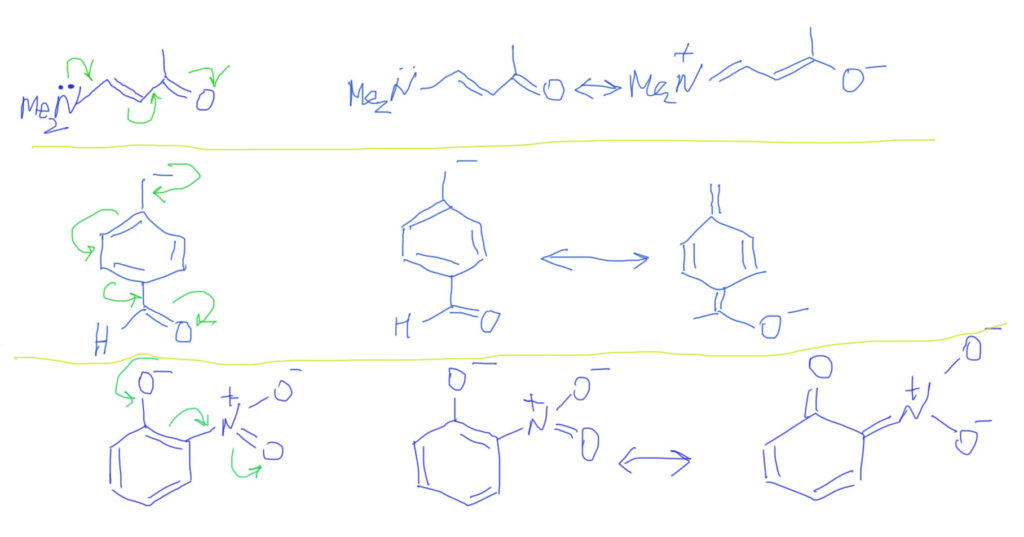
Случай, когда вместо обычных двойных связей бензольное кольцо, вполне вписывается в эту схему. Важно только рисовать бензольное кольцо не гайкой, а нормальной структурой Кекуле. С гайкой сопряжение изобразить не получится. Тогда мы сразу поймем две важные вещи: во-первых, что бензольное кольцо в делокализации работает как сопряженная система двойных связей и ни о какой ароматичности думать не нужно; во-вторых, что пара- и орто-расположение донора/акцептора сильно отличается от мета-расположения, в котором сопряжение отсутствует. На рисунках розовеньким напылением показаны пути сопряжения, и видно, что в орто-случае работает одна двойная связь, в пара-случае – две, а в мета-случае, как его ни нарисуй, путь сопряжения разрывается, и сопряжения нет.
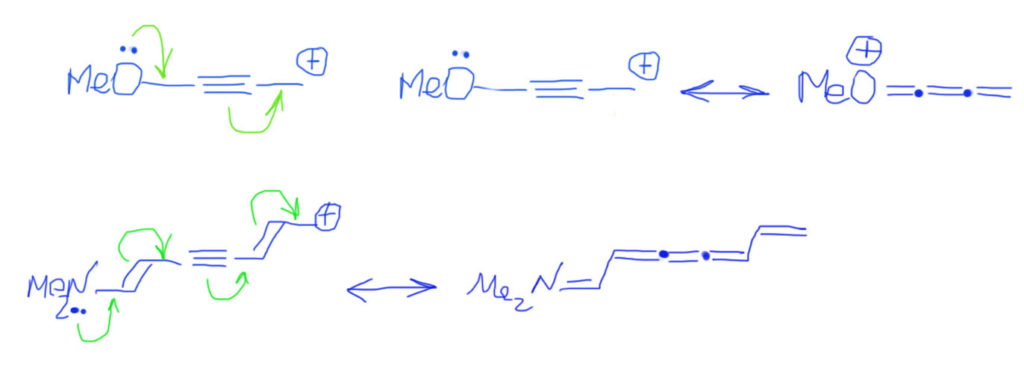
Если попадаются не двойные, а тройные связи, то ничего не меняется. Нужно просто представить тройную связь как две взаимно перпендикулярные π-связи, и одну из них использовать, а вторую оставить в покое. Не пугайтесь – получается немного страшновато от обилия двойных связей в граничной структуре. Обратите внимание, что двойные связи на одном атоме углерода обозначают на прямой (так как этот атом углерода имеет sp-гибридизацию), и, чтобы не запутаться, обозначают эти атомы жирными точками.
Тип 3. В цепи сопряжения либо донор, либо акцептор (но не оба сразу), и кратные связи С=С или С≡С
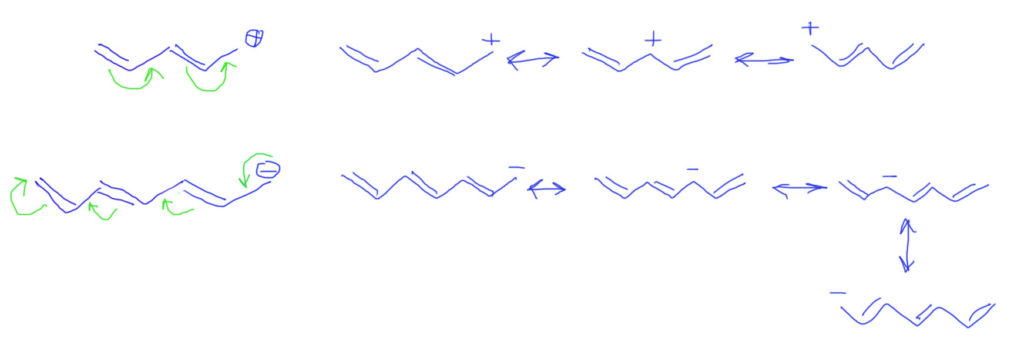
Если кратных связей больше, действуем по аналогии, добавляем стрелки, вовлекая каждую кратную связь в делокализацию. А вот граничных структур нужно рисовать не две, а столько, сколько есть кратных связей в цепи плюс исходную. Видим, что заряд делокализуется по нечетным атомам. Реальная структура будет где-то посредине.
Обобщим на донор – атом без заряда, но с парой. Стрелки будут такие же, как в случае аллильного карбаниона. Граничные структуры формально тоже, но они в этом случае неравноценны. Структуры с зарядами гораздо менее выгодны чем нейтральные. Реальная структура молекулы ближе с исходной, но картина делокализации позволяет понять, почему на дальнем атоме углерода возникает избыточная электронная плотность.
Делокализация в бензольном кольце опять требует представления с двойными связями, и рисуется вполне аналогично. так как связи три и все они участвуют, то граничных структур будет, помимо исходной, еще три, а заряд (плотность) размажется по орто и пара положениям.
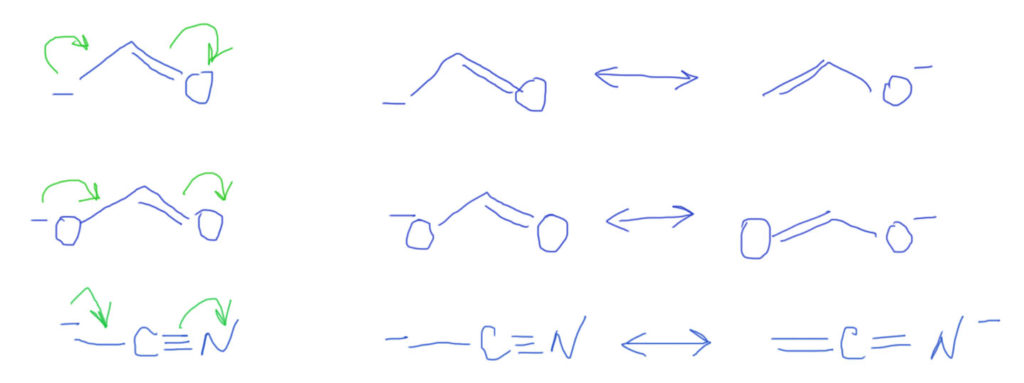
Тип 4. В цепи сопряжения донор и кратные связи, некоторые из которых содержат гетероатом (С=O, C=N, N=O и т.п.)
Итак, если есть донор и такая связь, то смещение плотности показать очень легко. Из двух граничных структур будет преобладать та, у которой заряд находится на более электроотрицательном атоме, впрочем, и роль второй структуры также всегда весьма существенна. Естественно, если случай симметричный, как тот, что показан на второй строчке, то обе структуры одинаковы и представлены поровну – реальная структура будет посредине точно так же, как в ранее рассмотренном случае аллильного аниона.
Если в молекуле или ионе есть еще и сопряженные углерод-углеродные связи, они будут скромно участвовать в общем смещении плотности. Такова же и роль бензольного кольца с орто- или пара-расположением донора и акцептора. Обратите внимание, что граничных структур всегда только две – они показывают два крайних положения для смещения плотности. Промежуточных структур (там, где плотность уже сместилась от донора на кратную связь, но дальше не прошла) рисовать не нужно. Вообще-то они есть и вполне законны, но их роль в делокализации пренебрежимо мала. Третий пример на представленной схеме показывает, как рисовать нитро-группу. Она поначалу пугает обилием зарядов, но если посмотреть на нее просто нак на двойную связь азот-кислород, то смещение рисуется точно так же, как и для любых других кратных связей с гетероатомами, а те заряды, которые там уже есть, нужно просто оставить в покое и не трогать.
И еще один распространенный вариант – донор один, а акцепторных кратных связей несколько (две, три). Строго говоря, в этом случае не одна цепь сопряжения, а две, три. Это увеличивает число граничных структур, и также может быть показано стрелками, хотя этот способ не вполне корректен, так как от одной донорной пары будет несколько стрелок. На этом примере хорошо видно, что граничные структуры – более универсальный способ, хотя и более громоздкий.
Резонансные структуры как составлять
Иногда можно записать несколько правильных формул Льюиса, которые различаются характером связей между одними и теми же атомами. Например:
В каждом случае существует два пути выполнения правила октета для всех атомов. Если молекулу можно представить двумя или более такими формулами, в которых атомы соединены в одной и той же последовательности, эти формулы называются резонансными формами или классическими резонансными структурами.
Резонансные структуры принято соединять обоюдоострыми стрелками, как это сделано выше.
Реальная структура частицы не совпадает ни с одной из резонансных структур. Не происходит и непрерьюного превращения одной структуры в другую и обратно. На самом деле истинная структура есть нечто среднее между двумя предельными формами. Эта реальная структура носит название резонансного гибрида.
В первом случае резонансный гибрид к первой структуре значительно ближе, чем ко второй. Однако реальная молекула имеет и некоторые черты второй структуры с зарядами на атомах азота и кислорода. В двух Других случаях обе предельные структуры вносят одинаковый вклад в резонансный гибрид. Кратность связей в обоих случаях равна 
Соединения, для которых возможны резонансные структуры, обычно более стабильны. Скажем, во втором примере отрицательный заряд распределен по двум атомам кислорода, а не сконцентрирован только на одном из них. Такая делокализация заряда является стабилизирующим фактором. В первом примере связь 
Вообще надо помнить, что польза любой теории определяется способностью этой теории объяснять уже известные факты и предсказывать новые.
Резонанс — это делокализация электронов внутри ковалентно связанной частицы, приводящая к дополнительной стабилизации этой частицы. Резонанс изображается с помощью резонансных структур, соединяемых обоюдоострыми стрелками или с помощью резонансных гибридов.
Химическое равновесие и резонанс
Задача
На рис. 1 изображена реакция отрыва протона (H + ) от ацетальдегида с последующим добавлением электрофилов: либо кремниевого Ме3Si + (буквами Ме обозначена метильная группа СН3), либо этильного Еt + = СН3CН2 + (то есть углеродного). В роли самих электрофилов могут выступать, например, хлорид Ме3SiCl и иодид ЕtI, но для задачи это не важно.
В левой части уравнения нарисованы две молекулы, присутствующие в растворе одновременно в пропорции, связанной с их относительной стабильностью: одна молекула превращается в другую и обратно. Это пример химического равновесия, в данном частном случае — кето-енольная таутомерия. Tаутомерия — явление обратимой изомерии, при которой два или более изомера легко переходят друг в друга.
После отрыва протона и добавления электрофила происходит на первый взгляд нечто странное: несмотря на то, что изначально в растворе присутствовали две молекулы, кремниевый катион «садится» исключительно на кислород, а углеродный — исключительно на углерод. Продуктов с этилом на кислороде или с кремнием на углероде в этой реакции не получается совсем. Надо заметить, что и в том, и в другом случае получившийся продукт — наиболее термодинамичeски стабильный из двух возможных (то есть при его получении выделяется наибольшее количество энергии). При этом, однако, можно синтезировать чуть менее термодинамически стабильные изомеры, но они в условиях реакции перестраиваться в более стабильные не будут (рис. 2), — таутомерия возможна только с протоном.
В химических реакциях достичь селективности (получить чистый продукт без примесей), как правило, довольно сложно. А особенно — если исходных веществ не одно, а целых два: в реакциях получаются все возможные продукты. Как же объяснить селективность реакции в данном случае?
Подсказка 1
Рассмотрите реакцию отрыва протона повнимательнее. Обратите внимание на то, что вертикальные стрелки слева и справа разные.
Подсказка 2
После отрыва протона остается электрон (обозначенный на схеме реакции минусом в кружочке). Чем поведение электронов сильно отличается от поведения протонов?
Решение
Рассмотрим повнимательнее этап отрыва протона (рис. 3).
Важно понять отличие левой части уравнения от его правой части. Слева изображены две реальные молекулы, они одновременно присутствуют в растворе, а их содержание в нем определяется их относительной стабильностью. Одна молекула превращается в другую и обратно — именно это схематически показано двумя противоположно направленными параллельными стрелками.
Теперь посмотрим на правую сторону уравнения: что происходит после отрыва протона. Вы вроде бы опять видите две молекулы, которые очень похожи на молекулы слева. Но на самом деле это одна молекула — енолат (enolate). В ней реакционно-способные электроны сидят одновременно и на кислороде, и на углероде, то есть «размазаны» между ними. Поэтому молекулу можно описать как суперпозицию двух состояний: в одном состоянии электрон у атома кислорода, в другом — у атома углерода. Eнолат изображают еще и в виде самой правой формулы на рис. 3, которая как раз и подчеркивает его двоякую природу. Этот анион — классический кот Шредингера в коробке: пока он не вступит в реакцию, он одновременно является и кетоном, и енолом. И так как мы имеем дело не с двумя разными молекулами, а с одной, то нет ничего необычного в том, что с разными реагентами она реагирует по-разному.
Тот, кто догадался до этого места, задачу решил.
Но можно пойти и дальше: подумать, откуда электрофил «знает», к какому атому ему присоединиться, чтобы получился наиболее стабильный продукт?
В растворе реагенты (енолат и электрофил) сталкиваются, в происходит взаимодействие электронной плотности на енолате с ее «отсутствием» на электрофиле. Получается переходное состояние с энергетическим максимумом, которое выглядит по-разному для разных электрофилов, потому что результат коллапсa суперпозиции (то есть открытия коробки с котом Шредингера) зависит от того, с чем енолат взаимодействует. Связь кремния с кислородом сильнее чем с углеродом, поэтому кремний будет ближе к кислороду уже в переходном состоянии, а углеродный электрофил будет ближе к углероду (и дальше от кислорода). Поэтому и продукты получатся соответствующие.
Послесловие
С явлением таутомерии связаны многие химико-технологические процессы, особенно в области синтеза лекарственных веществ и красителей. Очень важна роль таутомерии в биохимических процессах, протекающих в живых организмах. Например, при получении аденозинтрифосфата (АТФ) фосфориляцией аденозиндифосфата (АДФ).
АТФ — универсальный источник энергии для всех биохимических процессов. Показанная слева на рис. 4 молекула фосфоенолпирувата находится в енольной форме (то есть фосфат находится на кислороде). При переносе фосфата на АДФ, эта молекула спонтанно возвращается в более стабильную кето-форму. Получение фосфоенолпирувата катализируется ферментом енолазой в процессе гликолиза.
Реакции енолатов с электрофилами — важнейший метод селективного получения связей «углерод—углерод» и «кремний—кислород». Связь «углерод—углерод» — это основа органической химии, так что важность этой реакции тяжело недооценить. Что же касается кремниевых групп на атомах кислорода, то почти ни один мультистадийный органический синтез без них тоже не обходится (см., например, новость Связи кремний-водород можно каталитически хлорировать соляной кислотой без участия металлов, «Элементы», 18.01.2018). Если на молекуле есть несколько активных групп (которые легко вступают в реакции), можно одну из них селективно (не затрагивая другие) заблокировать кремниевым «щитом» с помощью соответствующего хлоросилана, затем провести желаемые реакции с другими реактивными группами, после чего снять кремниевую защиту, освободив защищенную группу для дальнейших реакций. Снимается кремниевая защитная группа довольно легко. При этом не затрагиваются другие части молекулы, поэтому такая защита очень популярна.
На рис. 5 показан пример такой реакции. Группу ОН защищают триметилкремниевым «щитом» (TMS). Затем проводят реакцию на другом конце молекулы, замещая бром на органическую группу с ацетиленом (тройной связью «углерод—углерод») литиевым реагентом, а потом снимают кремниевый «щит» фторированием. Связь «фтор—кремний» сильнее чем связь «кислород—кремний», поэтому снятие защиты проходит легко. Без защиты на группе ОН литиевый реагент прореагировал бы в первую очередь именно с ней. Молекула с ацетиленом может в дальнейшем использоваться, например, для получения более крупных молекул (лекарств, пестицидов, полимеров, и т. д.) с помощью методов так называемой «клик» химии (см., например, aзид-алкиновое циклоприсоединение).
После отрыва протона у кетона/енола получается реагент (енолят), поведение которого объясняется теорией резонанса. Теория резонанса — теория электронного строения химических соединений, в соответствии с которой распределение электронов в молекулах является комбинацией (резонансом) структур с различной конфигурацией ковалентных связей. Иными словами, молекулярная структура описывается не одной возможной структурной формулой, а сочетанием (резонансом) всех альтернативных структур. Теория резонанса — это способ посредством химической терминологии и классических структурных формул визуализировать математическую процедуру построения приближенной волновой функции сложной молекулы.
Теория резонанса была предложена Вернером Гейзенбергом в 1926 году. Почти сразу на нее обратил внимание Лайнус Полинг, который применил ее к описанию электронной структуры молекул в 1928 году. Свои результаты он описал в серии публикаций, вышедших в начале 1930-х годов (см., например, статью L. Pauling, 1931. The Nature of the Chemical Bond. Application of Results Obtained from the Quantum Mechanics and from a Theory of Paramagnetic Susceptibility to the Structure of Molecules). Эти работы принесли Полингу в 1954-м году Нобелевскую премию по химии за исследования природы химической связи.
В послевоенном СССР теория резонанса стала объектом гонения в рамках идеологических кампаний. Ее объявили чуждой диалектическому материализму и обвинили в разных грехах против советского строя. Гонения на теорию резонанса иногда называют «лысенковщиной в химии». Химики, однако, пострадали меньше генетиков. Им удавaлось оставаться ниже света прожекторов репрессивной машины с помощью использования других терминов вместо «резонансa» (например, «гибридизации»). Подробнее эти события изложены, например, здесь.
За прошедшее время теория резонансa доказала свою полную научную состоятельность, и с ее помощью сейчас изучаются и объясняются многие химические и биологические процессы.