Результат пгт как расшифровать
Что такое ПГТ-А при ЭКО
Диагностика хромосомных аномалий – важнейшая составляющая инновационных репродуктивных технологий. Без преимплантационного генетического тестирования (ПГТ-А) не обходится ни одно планирование беременности в рамках протокола экстракорпорального оплодотворения, что позволяет существенно повысить эффективность самой процедуры.
Суть хромосомного тестирования
ПГТ-А – биопсия клеток наружного слоя бластоцисты – предшественницы эктодермы, которая участвует в получении питательных веществ из матки. Исследование совершенно безопасно для развития эмбриона, позволяет «увидеть» и выбрать эмбрион без отклонений в хромосомах. Почему это так важно? Статистика утверждает, что беременность с использованием ЭКО наступает не более чем в 40 % случаев. Причин тому множество, но основной являются хромосомные аномалии.
Чем старше будущая мама, тем выше доля хромосомных отклонений, которые растут в геометрической прогрессии, при этом уверенность в успешной попытке искусственного оплодотворения существенно снижается. Анеуплоидные зиготы с аномальным числом хромосом встречаются в 70 % случаев. Именно поэтому проведение генетического тестирования эмбриона еще до его переноса в полость матки – разумно, научно обосновано и несомненно результативно.
Отбор эмбрионов без проведения ПГТ-А только на основании морфологических признаков не может быть надежен на сто процентов. Гарантировать успех в этом случае проблематично. С учетом сложности медицинской процедуры ЭКО, длительности предподготовки к ней, стоимости манипуляций наша клиника и врачи не рекомендуют проводить экстракорпоральное оплодотворение без тестирования ПГТ-А.
Показания к исследованию
Проведение лабораторного исследования на полноценность хромосомного набора рекомендовано в случае:
Дополнительно ПГТ-А помогает ответить еще на три важных вопроса:
Такое исследование проводится по специальным показаниям. Известно, что ряд болезней наследуются исключительно детьми определенного пола. Так, нарушением свертываемости крови (гемофилией) болеют исключительно представители мужского пола, хотя бессимптомно носить дефектный ген могут мужчины и женщины. Сделав ПГТ-А, можно отобрать только женские эмбрионы. Это даст 50 % гарантии, что патологический локус просто не передастся девочке по наследству, но все 100% – ее полного здоровья.
Знать резус-фактор будущего малыша необходимо, если папа имеет положительную группу крови, а мама – отрицательную, или наоборот. Это ситуация с риском резус-конфликта, когда у ребенка и вынашивающей его мамы получается не одинаковый резус-фактор. Вовремя выявленная хромосомным тестированием аномалия позволит предупредить резус-конфликт, чреватый серьезными осложнениями в период вынашивания плода.
Иногда встает вопрос о необходимости беременности вторым малышом, который будет обладать тканевой совместимостью с уже родившимся братом или сестрой. Тканевую совместимость тоже можно определить с помощью уникального анализа – преимплантационного генетического тестирования.
Ход теста
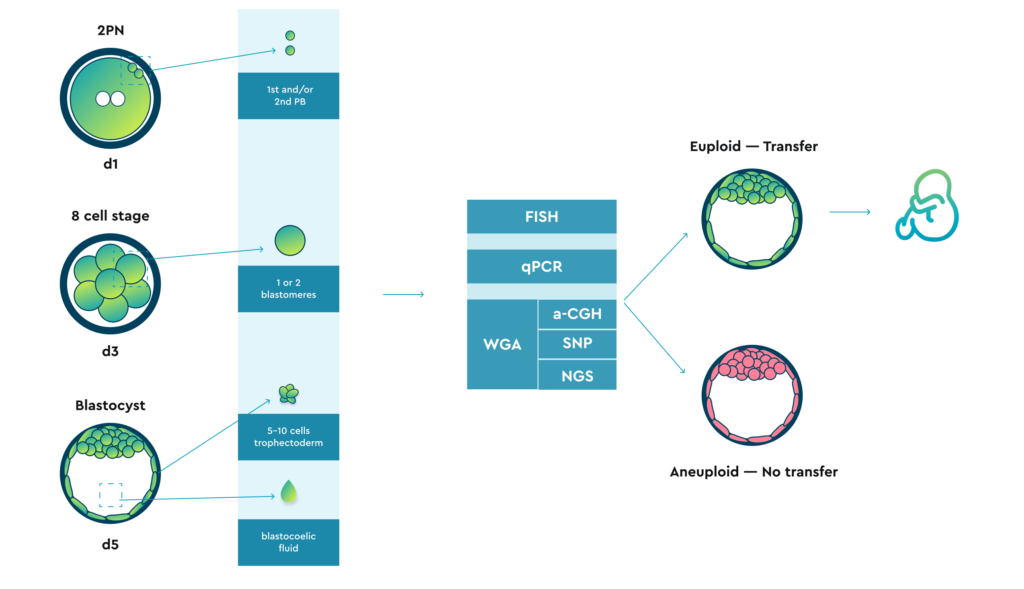
В процессе планирования беременности в клинике на первом этапе проводят ЭКО или процедуру ИКСИ. Затем сохраняют зиготу в пробирке несколько суток. В лаборатории нашей клиники ПГТ-А тестирование проводится методом Next Generation Sequencing (NGS). Такое исследование считается максимально достоверным, дает возможность отобрать самый жизнеспособный и здоровый эмбрион для внедрения в матку после тщательного изучения каждой из его нуклеопротеидных структур, хранящих генетическую информацию. Помимо этого, тест позволяет «увидеть» мозаичный кариотип, несбалансированность хромосомных комбинаций, когда есть лишние хромосомы или их количества недостаточно.
Основное исследование проводится на третьи-пятые сутки развития эмбриона. Для преимплантационного тестирования берут несколько клеток трофэктодермы зародыша, которая трансформируется со временем в плаценту. Сам эмбрион остается в банке клиники, а биоптат под строжайшим контролем температуры окружающей среды передают в геномную лабораторию. После анализа результатов с помощью биоинформатики эмбриолог выдает заключение о том, какие эмбрионы могут быть имплантированы.
ПГТ-А исключает риск трансфера генетически неполноценного зародыша, что существенно повышает шансы женщины не только забеременеть, но и выносить, родить здорового ребенка с первой попытки ЭКО.
В чем разница между ПГТ-А и ПГТ-М
Преимплантационное генетическое тестирование позволяет выявить различные хромосомные аномалии эмбриона. Такая диагностика является одним из наиболее важных этапов в рамках современных репродуктивных технологий. ПГТ позволяет в значительной степени повысить шансы на успех при проведении ЭКО. Эта процедура доступна в нашем центре планирования семьи и репродукции в Краснодаре.
Что такое ПГТ-А и для чего оно нужно
ПГТ-А является биопсией клеток бластоцисты. Она дает возможность выбрать наиболее жизнеспособный эмбрион, без отклонений на генетическом уровне. Наиболее частой причиной неудач при проведении экстракорпорального оплодотворения становятся хромосомные аномалии. Чем старше будущие родители, тем актуальнее для них становится ПГТ-А в рамках планирования беременности. Проведение данной генетической диагностики не оказывает негативного влияния на эмбрион и его дальнейшее развитие. Среди основных показаний к проведению ПГТ-А стоит отметить неудачные попытки экстракорпорального оплодотворения в прошлом, самопроизвольные выкидыши и патологии сперматогенеза.
Процедура осуществляется на 3-5 день развития эмбриона. В рамках ПГТ-А достаточно получить несколько клеток трофэктодермы исследуемого эмбриона. Во время проведения данной процедуры эмбрион продолжает храниться в медицинском центре в криобанке. Образец тканей передается в лабораторию. Транспортировка производится в условиях строжайшего соблюдения температурного режима. После проведения исследования эмбриолог составляет заключение относительно того, может ли эмбрион использоваться для экстракорпорального оплодотворения.
Неоспоримым преимуществом ПГТ-А является возможность заранее узнать пол будущего малыша. Этот фактор имеет значение, потому что некоторые генетические заболевания передаются только детям определенного пола. Однако, выбор пола запрещен законодательством РФ без наличия медицинских показаний.
Кроме того, в некоторых ситуациях первостепенную важность имеет информация о резус-факторе будущего ребенка. Это дает возможность избежать резус-конфликта. Ситуация, когда у матери и ребенка разные резус-факторы, может стать причиной осложнений в период беременности.
Если же в семье есть ребенок, которому в силу состояния здоровья необходима трансплантация костного мозга, ПГТ-А позволяет обеспечить совместимость тканей между детьми.
Использование результатов данной процедуры позволяет в значительной степени уменьшить вероятность прерывания беременности на раннем сроке. Ведь причиной выкидыша в 1-ом триместре в большинстве случаев становятся серьезные генетические патологии у эмбриона. В конечном же итоге это исследование позволяет сократить количество попыток ЭКО.
Основные нюансы ПГТ-М
Помимо ПГТ-А, в рамках преимплантационного генетического тестирования проводится диагностика моногенных болезней и выявление отдельных генных аллелей. ПГТ-М позволяет выявить муковисцидоз, гемофилию, амиотрофию, фенилкетонурию и другие опасные врожденные заболевания.
Бесплодие не является главной причиной для проведения подобной процедуры. Данная разновидность преимплантационного генетического тестирования актуальна для супружеских пар, у которых были выявлены те или иные врожденные заболевания. По сравнению с ПГТ-А, ПГТ-М пока проводится гораздо реже. Однако исследования врожденных патологий крайне важны при планировании беременности. Ведь этот вид диагностики позволяет производить перенос здоровых эмбрионов.
Во время исследования эмбриолог делает специальные тесты и выявляет яйцеклетки пригодные для использования в протоколе экстракорпорального оплодотворения. Диагностика моногенных генетических заболеваний (ПГТ-М) нейтрализует вероятность контаминации ДНК матери и малыша. Вероятность постановки неверного диагноза после проведения преимплантационного генетического тестирования минимальна.
ПГТ-А является обязательным этапом подготовки к процедуре экстракорпорального оплодотворения. Однако существует техническая возможность одновременного проведения ПГТ-А и ПГТ-М. Приняв подобное решение на этапе планирования беременности, можно исключить вероятность появления у потомства хромосомных аномалий.
Преимплантационная генетическая диагностика эмбрионов (ПГД)
ПГС, ПГТ, ПГТ-а
ПГС – преимплантационный генетический скрининг.
Влияние возраста на возможность забеременеть
Парам, планирующим ЭКО в старшем репродуктивном возрасте, рекомендуется процедура ПГТ-а эмбриона. Риск того, что при оплодотворении яйцеклетки сперматозоидом произойдет неправильное слияние хромосом и эмбрион получит генетический дефект есть всегда, но с возрастом он увеличивается. У эмбриона может возникнуть трисомия (три хромосомы вместо двух) или моносомия (одна хромосома вместо двух). Такие дефекты влияют на имплантацию, могут привести к прерыванию беременности и рождению ребенка с генетической болезнью.
ПГТ-а эмбриона при ЭКО
ПГТ-а проводится в тех случаях, когда есть риск замирания беременности или рождения ребенка с умственными отклонениями и физическими особенностями. ПГТ-а не гарантирует рождение здорового ребенка, но повышает шанс на то, что эмбрион, перенесенный в матку имеет правильный набор хромосом.
ПГТ-а повышает шансы на наступление беременности. Количество циклов ЭКО/ИКСИ, требующихся для рождения ребенка, уменьшается, если при подготовке к переносу применяется ПГТ-а. Эмбрионы с генетическими аномалиями, наличием лишних хромосом или их отсутствием не пройдут сортировку, так как не смогут дать беременность.
Методы ПГД
Существует несколько методов ПГД. Каждый из них имеет преимущества и недостатки. Основное различие связано с числом хромосом, на которые идет проверка, точностью результата и стоимостью процедуры.
Самый старый и распространенный метод, появился еще в 80-х годах, а для диагностики эмбрионов его используют с 90-х. В процессе исследуется только часть хромосом (от 3 до 9), что не гарантирует высокой точности результата, так как часть хромосом остается непроверенной, но позволяет выявлять распространенные генетические отклонения.
Метод используется с 2009 года и позволяет исследовать все 23 пары хромосом, обеспечивая практически 100% результативность в отбраковке эмбрионов с анеуплоидией. Стоимость ПГД aCGH выше, чем у FISH.
Секвенирование – это метод определения первичной структуры последовательности нуклеотидов ДНК, метод расшифровки генома человека. Самый новый и современный метод, применяется с 2013 года и основывается на многократном анализе каждого сегмента генетического кода всех хромосом, что дает максимальную валидность результата. Позволяет определять мутации генов, связанные с полом, наследственные и эмбриональные мозаичные мутации. Но даже эта манипуляция не дает 100%, так как не дифференцирует сбалансированный хромосомный набор от нормального в случае транслокаций.
Выбор метода ПГД зависит от разных факторов, поэтому если у вас имеются показания к ПГД, проконсультируйтесь у своего репродуктолога или генетика.
Результаты ПГД
Если у эмбриона обнаружены отклонения, это означает обязательный отказ от переноса. Однако, в редких случаях, у эмбриона может быть выявлен мозаицизм. При этом, если генетическая лаборатория признает эмбрион потенциально возможным дать беременность – перенос такого мозаичного эмбриона возможен после консультации генетика и добровольного информированного согласия, подписанного пациентами.
Расшифровка ПГД
По итогам исследования ПГД выдается документ с таблицей.
Если у эмбриона нет отклонений, в ячейке будет указано «норма» и «рекомендован перенос». Если есть отклонения, то указывается, что это:
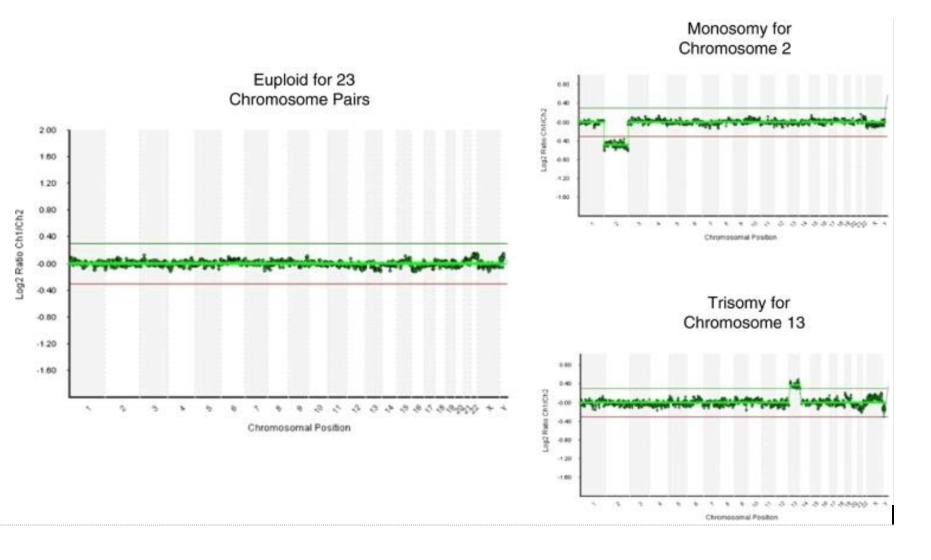
Анеуплоидии / анеуплоидный эмбрион (количественные нарушения хромосом) – самый распространенный тип хромосомной патологии, при которой набор хромосом изменен, вследствие утраты хромосомы (моносомия) или наличия дополнительной хромосомы (трисомия). В таких случаях хромосомный набор в клетке не равен 46, что при переносе такого эмбриона приводит к нарушению имплантации (беременность не наступает) или нарушению развития беременности (замершая беременность или самопроизвольный выкидыш в 1 триместре). Некоторые из анеуплоидий жизнеспособны и при переносе такого эмбриона может родиться ребенок с синдромом Дауна, Эдвардса, Патау, Тернера и некоторыми другими. Перенос эмбрионов с анеуплоидиями не рекомендуется. Анеуплоидии по всем хромосомам могут выявляться методами NGS и CGH. Использование метода FISH обычно ограничено исследованием конкретных хромосомом.
Сегментарные хромосомные нарушения – вариант хромосомной патологии, при которой набор хромосом не изменен, но нарушена структура одной или нескольких хромосом в виде утраты участка (делеция) или наличия дополнительного удвоенного участка хромосомы (дупликация). В зависимости от типа и размера вовлеченного в перестройку участка хромосомы при переносе такого эмбриона возможно самопроизвольное прерывание беременности или рождение ребенка с умственной отсталостью и различными пороками развития.
Несбалансированные транслокации – частный случай сегментарных хромосомных нарушений, при котором есть сочетание делеции (утраты участка хромосомы) и дупликации (удвоения участка хромосомы). Такой тип хромосомной патологии формируется у эмбриона, если один из родителей является носителем сбалансированной транслокации. Носительство сбалансированной транслокации протекает бессимптомно и уточнить ее наличие возможно только при исследовании кариотипа. Возможность детекции сегментарных нарушений определяется разрешающей способностью используемого метода.
Стоимость ПГД
Результат пгт как расшифровать
Скрининг эмбрионов при проведении ВРТ для повышения шансов на успешную имплантацию, беременность и рождение ребенка.
Основные характеристики
ПГТ-А или преимплантационное генетическое тестирование на анеуплоидии — скрининг эмбрионов в цикле вспомогательных репродуктивных технологий на наличие хромосомных аномалий перед переносом в полость матки с целью повышения вероятности достижения успешной беременности.
ПГТ-А ранее был известен как ПГС, преимплантационный генетический скрининг.
Хромосомные аномалии эмбриона — потенциальная причина негативного исхода вспомогательных репродуктивных технологий (отсутствие имплантации, неразвивающаяся беременность) и врожденных пороков развития.
20% человеческих яйцеклеток
9% человеческих сперматозоидов
В естественном гаметогенезе, считается, что примерно 20% человеческих яйцеклеток и 9% человеческих сперматозоидов являются анеуплоидными*. Анеуплоидные гаметы, вовлеченные в процесс оплодотворения приводят к развитию анеуплоидных эмбрионов, что зачастую проявляется в виде неудач имплантации или потери беременности.
*Martin RH. Meiotic errors in human oogenesis and spermatogenesis. Reprod BioMed Online 2008;16(4):523-31
38%–76% спонтанных абортов сопровождается выявлением хромосомных аномалий
Согласно данным мировой статистики и российской статистики, распространенность хромосомных аномалий, выявляемых при спонтанном аборте колеблется от 38% до 76%*. Частота анеуплоидий у эмбрионов в циклах ВРТ возрастает с увеличением возраста матери, достигая 80% у пациенток старше 40 лет**.
*Чиряева О. Г. и соавт., 2012, Волков А. Н. и соавт. 2017, Carp H, et al.,2001, Rosa Russo et al., 2016)
**Macklon NS et al. Conception to ongoing pregnancy: the “black box” of early pregnancy loss. Hum Reprod Update 2002;8:333-343
38%–73% эмбрионов в циклах ВРТ содержат анеуплоидные клетки
Недавние крупные исследования эмбрионов человека показали, что 38-73% эмбрионов в циклах ВРТ содержат анеуплоидные клетки. Различия в статистических данных объясняются в основном различным средним значением возраста яйцеклеток
Le Thi Bich Phuong et all. Selecting euploid embryo for transfer by preimplantation genetic testing for aneuploidy improved clinical outcomes in patients with advanced maternal age DOI : 10.15419/bmrat.v6i12.581
X Viñals Gonzalez et all, Euploid Blastocysts Implant Irrespective of Their Morphology After NGS-(PGT-A) Testing in Advanced Maternal Age Patients, 2019.
ПГТ-А становится одним из наиболее ценных инструментов для повышения успеха наступления беременности с помощью вспомогательных репродуктивных технологий. Поскольку показатели мозаицизма можно количественно определять методом NGS, мозаичные эмбрионы по нежизнеспособным хромосомам можно рассматривать для переноса, когда нет доступных эуплоидных эмбрионов.
Было показано, что ПГТ-А связан с:
Увеличением частоты имплантации
В среднем до 50-69%, данные различаются в зависимости от возрастной группы и сопутствующих клинических данных
Simon AL, et al, Pregnancy outcomes from more than 1,800 in vitro fertilization cycles with the use of 24-chromosome single-nucleotide polymorphism-based preimplantation genetic testing for aneuploidy. Fertil Steril. 2018
Снижением частоты неразвивающихся беременностей
В общей популяции 25% всех клинических беременностей заканчиваются выкидышем. Около 50% спорадических ранних выкидышей обусловлено хромосомными дефектами. Риск выкидыша снижается при переносе эуплоидного эмбриона.
Выкидыш в ранние сроки беременности: диагностика и тактика ведения, клинические рекомендации.
Сокращением времени до наступления беременности
Время до наступления беременности с ПГТ-А сокращается с 15 недель до 8 недель.
Rubio et al., In vitro fertilization with preimplantation genetic diagnosis for aneuploidies in advanced maternal age: a randomized, controlled study. Fertil Steril. 2017
Снижением риска осложнений при многоплодной беременности
Высокая частота многоплодных беременностей является следствием переноса нескольких эмбрионов в программах ВРТ. Также многоплодие может быть следствием естественно наступившей беременности. По данным Регистра ВРТ РАРЧ за 2015 год, частота многоплодных родов в программах ЭКО и ИКСИ составила 19,7% от всех родов, после переноса размороженных эмбрионов — 15,2%, в программе «Донорство ооцитов» — 20,4%, в программе суррогатного материнства — 25,2% (91).
С целью профилактики многоплодной беременности рекомендуется селективный перенос 1 эмбриона в полость матки.
ВРТ и искусственная инсеминация, клинические рекомендации
После периода витрификации переносятся эуплоидные эмбрионы, что позволяет выиграть время для проведения скрининга на хромосомные аномалии, а также подготовить эндометрий к имплантации.
Показания
Во всех этих группах пациентов предполагается повышенная частота хромосомных аномалий у эмбрионов.
Что выявляет ПГТ-А
Мозаицизм может существовать в клетках, входящих в состав трофэктодермы. Способность идентифицировать мозаицизм в пределах трофэктодермы представляла значительную сложность, и для преодоления этой проблемы были реализованы следующие подходы:
Современные диагностические технологии тестируют клетки, предназначенные стать плацентой, а не клетки внутренней клеточной массы, которая дифференцируется в плод. Биопсия внутриклеточной массы не рекомендуется из-за опасений относительно дальнейшей дифференцировки плода.
Как оценить эффективность ПГТ-А?
Распределение образцов в зависимости от возрастных категорий
First Genetics. ПГТ-А статистика в возрастных группах
Рекомендованные к переносу (N+mos)
Изолированные сегментарные нарушения (%)
Эффективность ПГТ-А во многом зависит от эмбриологического этапа исследования!
В таблице представлены результаты клиник по России «overachievers», с которыми отлажено взаимодействие и не возникает сомнений в «правильности» работы «эмбриологического» протокола. «Underachievers» — единичные клиники, у которых были замечены отклонения от привычных данных статистики и предложены решения по аудиту и поиску потенциальных причин нарушений.
Что может оказывать влияние на успешность исхода?
На основании данных переноса более 700 эуплоидных эмбрионов, было показано, что негативными предикторами исхода могут быть:
число неудачных исходов беременности
биопсия эмбриона на 6 день (по сравнению с 5 днем)
повышенный индекс массы тела
Fazilet Kubra Boynukalin et al.,Parameters impacting the live birth rate per transfer after frozen single euploid blastocyst transfer, 2020
для чувствительной детекции мозаицизма и сегментарных нарушений всех хромосом
1,5 календарных дня
(по согласованию)
7 календарных дней
12 рабочих дней
на каждом этапе исследования
из любого города России
Особенности метода
Эмбриологические аспекты преимплантационного генетического тестирования
Потенциально биопсия может быть выполнена на трех различных стадиях:
Кроме того, в литературе встречаются данные о попытках аспирировать небольшой объем бластокоэтической жидкости.
Все виды упомянутого ранее биоматериала потенциально могут быть проанализированы с использованием различных технологий. Однако:
Возможные методы для скрининга хромосомного статуса эмбриона
Хромосомный анализ используется в клинической практике с середины 90-х годов.
FISH флуоресцентная гибридизация
Первоначально эта диагностическая стратегия была выполнена с помощью флуоресцентной гибридизации in situ (FISH), что заключалось в нанесении одной клетки эмбриона на стадии расщепления (бластомера) на предметное стекло и гибридизацию ее ДНК с хромосомно-специфическими флуоресцентными зондами. Ограниченное количество исследованных хромосомных зондов также означало, что некоторые анеуплоидии остались непроверенными, что привело к переносу необнаруженных анеуплоидных эмбрионов.
В середине 2000-х годов стало ясно, что эти недостатки и диагностическая ненадежность в сочетании с негативными последствиями биопсии на стадии расщепления ставят под угрозу клинические исходы пациентов, для которых проводили ПГТ-А, что вызвало необходимость появления более безопасной, надежной и точной стратегии.
CCS комплексный хромосомный скрининг
>98% точность, которую показали все платформы CCS
Впоследствии разработка технологий комплексного хромосомного скрининга (CCS), включая сравнительную геномную гибридизацию (aCGH), массивы однонуклеотидных полиморфизмов (массивы SNP) и количественную полимеразную цепную реакцию (qPCR), обеспечила значительное улучшение клинического применения ПГТ-А.
При тестировании, проведенном на одной клетке из клеточных линий фибробластов с известным кариотипом, все платформы CCS показали точность выше 98% для детекции полных анеуплоидий.
Все платформы, которые способны анализировать все 23 пары хромосом, имеют сравнимую эффективность в выявлении анеуплоидии целой хромосомы, но отличаются друг от друга
aCGH, SNP и массивное параллельное секвенирование (MPS, NGS) требуют первого шага амплификации всего генома (WGA, полногеномной амплификации).
FISH и qPCR не требуют предварительного этапа амплификации.
NGS обеспечивает более высокую точность при оценке субхромосомных аномалий (например, сегментарных анеуплоидий) по сравнению с предыдущими методами CCS.
Кроме того, NGS используется для обнаружения хромосомного мозаицизма (когда две кариотипически разные популяции клеток сосуществуют в одном и том же эмбрионе).
Однако важно, что обнаружение мозаицизма низкого и высокого уровня (например, 20 и 80%, соответственно) должно интерпретироваться с особой осторожностью, так как при таких значениях уровня мозаицизма довольно трудно отличить биологические находки от технических особенностей секвенирования данного конкретного образца. Этот момент чрезвычайно важен, особенно для пациентов, с ограниченным количеством эмбрионов.
Кроме того, некоторые диагностические платформы могут также одновременно тестировать хромосомные аберрации и мутации одного гена.
Количественная ПЦР или ПЦР в реальном времени
Количественная ПЦР (qPCR) или ПЦР в реальном времени (ПЦР-РВ) — это полимеразная цепная реакция, которая может идентифицировать анеуплоидию целой хромосомы путем определения количества копий каждой анализируемой хромосомы.
Это достигается путем сравнения трех или четырех локус-специфических ампликонов вдоль каждой хромосомы с референсным геном, локализованным на той же хромосоме.
Этот анализ позволяет идентифицировать анеуплоидию для всех 23 пар хромосом за короткое время (4–12 ч; в зависимости от количества анализируемых образцов), и ввиду трудоемкости процесса при отсутствии его автоматизации, высока вероятность ошибки за счет человеческого фактора.
qPCR не может идентифицировать структурные хромосомные аберрации, но может идентифицировать триплоидию.
Поскольку qPCR не выявляет генотип, он не может идентифицировать однородительские дисомии. Для определения количества копий митохондрий может быть разработан отдельный план эксперимента.
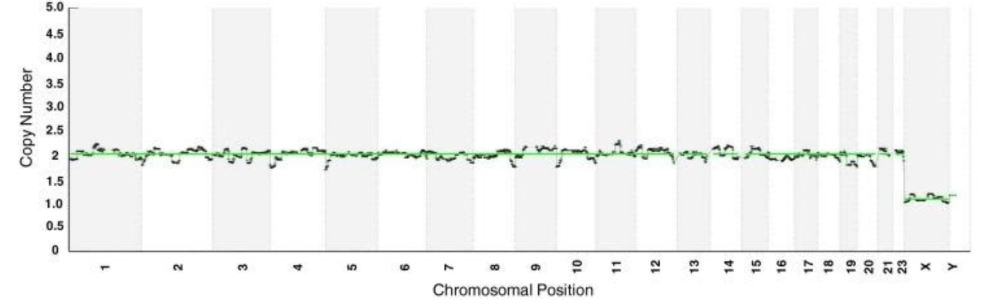
Существует два основных типа микрочипов, доступных для генетического тестирования. Это массивы однонуклеотидных полиморфизмов и сравнительная геномная гибридизация.
Для обеих платформ микрочипов клетки трофэктодермы должны быть лизированы и амплифицированы с помощью некоторого типа протокола амплификации ДНК, который обеспечивает охват всего генома. Как и в случае любого генетического теста, качество диагностического результата начинается с качества образца амплифицированной ДНК.
SNP микрочипы
SNP (однонуклеотидные полиморфизмы) — это пары одиночных нуклеотидов (A, T, C или G) в геномной ДНК, которые сильно варьируют в пределах данного вида. В контексте ПГТ-А оцениваемые SNP обычно находятся в некодирующих частях генома.
После WGA эмбриональная ДНК фрагментируется и гибридизуется с SNP микрочипом, который содержит зонды для более чем 300 000 различных SNP сайтов по всему геному.
После гибридизации выполняется этап удлинения цепи и окрашивания. A/T нуклеотиды на сайте SNP помечены с красным флуорохромом, а нуклеотиды G/C на сайте SNP помечены зеленым флуорохромом.
Измеряя интенсивность флуоресценции от красного к зеленому на каждом участке SNP в массиве, можно одновременно определить генотип более 300 000 SNP в каждом образце и сравнить полученные результаты с эталонным геномом карты человека.
Массивы полученных данных позволяют идентифицировать анеуплоидию всей хромосомы, а также могут идентифицировать приблизительно 250 общих структурных хромосомных аберраций по всему геному.
Однако существуют сотни других структурных аномалий хромосом, которые ниже разрешения 300 000 массивов SNP, используемых для ПГТ-А, которые могут играть важную роль при имплантации, выкидышах или рождении ребенка с серьезным генетическим синдромом. Поскольку предоставляется информация о генотипе, эти массивы SNP имеют ограниченную способность идентифицировать триплоидию, но могут идентифицировать однородительские дисомии.
SNP-микрочипы могут также идентифицировать мозаицизм, если проанализировано достаточное количество клеток трофэктодермы. Одним из ограничений SNP микрочипов, используемых для ПГТ-А, является неспособность их алгоритма идентифицировать число копий, когда муж и жена — кровные родственники.
CGH микрочипы
Микрочипы CGH (aCGH) менее плотные, чем микрочипы SNP. Чипы aCGH, используемые для ПГТ-А, имеют приблизительно 4000 маркеров (которые прогоняются в дубле), расположенных по всему геному.
aCGH — это протокол выявления соотношений копийности клинического образца и референсного генома женского или мужского пола. Анализ может быть проведен в более короткие сроки по сравнению с SNP (за 12–15 часов).
Это является значительным преимуществом перед SNP микрочиповым исследованием, проведение которого требует около 30-40 часов. Генотипы, которые идентифицируются в SNP, в данном типе анализе не выявляются, а значит, aCGH не может различать кариотип 46, XX от 69,XXX или 46, XY от 69,XXY. Кроме того, aCGH не может выявлять однородительские дисомии. аCGH, используемый для ПГТ-А во всех коммерческих лабораториях, может идентифицировать только анеуплоидию всей хромосомы и не предназначен и не валидирован для идентификации структурных хромосомных аберраций. Даже если чипы aCGH валидированы для мозаичных образцов, то надо понимать, что способность выявлять мозаицизм в образцах трофэктодермы все-таки ограничена.
По некоторым данным процент ошибок при aCGH составляет приблизительно 15–30%*.
*Capalbo A, Treff NR, Cimadomo D, et al. Comparison of array comparative genomic hybridization and quantitative real-time PCR-based aneuploidy screening of blastocyst biopsies. Eur J Hum Genet: EJHG. 2015;23:901–6. doi: 10.1038/ejhg.2014.222
В других валидационных исследованиях, при сравнении NGS и CGH, уровень конкордантности достигает 99%**.
**данные Paul R. Brezina, на 400 образцах
Секвенирование следующего поколения (NGS) при ПГТ-А
Секвенирование следующего поколения (NGS) — это технология, которая требует очень «аккуратной» амплификации ДНК, чтобы снизить вероятность возникновения артефактов во время процесса амплификации.
Впрочем, после амплификации ДНК в большинстве случаев артефакты могут быть идентифицированы и удалены с помощью биоинформатического анализа.
Для ПГТ-А используются две основные платформы
В настоящее время для ПГТ-А используются две основные платформы. Это MiSeq от Illumina и S5 от Thermo-Fisher Scientific. S5 является усовершенственной версией его предшественника PGM.
После амплификации ДНК приблизительно 50 нг каждого образца ДНК ферментативно расщепляется на миллионы фрагментов и объединяется для подготовки библиотеки. Подготовка библиотеки — это тот процесс, в котором все фрагменты ДНК «сшиваются» с адаптером и уникальным идентификатором — баркодом.
Хорошо приготовленная библиотека создает репрезентативное объективное представление нуклеиновых кислот и имеет решающее значение для точного молекулярного анализа.
После подготовки библиотеки либо выполняется этап мостиковой ПЦР. Для MiSeq происходит секвенирование путем синтеза на основе детекции флуоресценции, которая регистрируется с помощью оптической камеры.
Платформа позволяет одновременно анализировать до 24 образцов.
После подготовки библиотеки либо выполняется этап эмульсионной ПЦР. S5 использует эффект чувствительного к ионам поля, при котором детектируется сигнал по мере высвобождения иона водорода, что происходит каждый раз, когда ДНК-полимеразой во время секвенирования встраивается нуклеотидтрифосфат.
Высвобождение протона вызывает небольшое смещение pH, которое регистрируется с помощью чувствительного датчика.
Платформа масштабируема и позволяет одновременно анализировать 16, 24 или 96 образцов.
И MiSeq, и S5 секвенируют весь геном и данные секвенирования сравнивают с референсным геномом человека.
Обе платформы позволяют провести анализ (от амплификации ДНК до формирования окончательного отчета) через 12-16 часов.
После анализа последовательности, возникают существенные различия между анализом данных MiSeq и анализом данных S5.
ДНК MiSeq проходит первый раунд показателей обеспечения качества, за которым следует анализ с использованием программного обеспечения BlueFuse.
Анализ на S5 проходит первый раунд показателей обеспечения качества с использованием Torrent Browser, после чего проводится детальный анализ с помощью программного обеспечения Ion Reporter.
S5 и PGM от Thermo-Fisher Scientific
Существуют различия при анализе данных двух платформ. Главным образом, хочется отметить то, что биоинформатический алгоритм анализа данных в Ion Reporter является гибким, настраиваемым в зависимости от различных задач и доступным для подробного изучения. Подробную информацию можно найти в брошюре: