Рнк вирусы как лечить
Как избавиться от РНК за несколько минут
Как избавиться от РНК за несколько минут
Модель «протекающего ведра». Уровень РНК в клетке (количество воды в ведре) зависит и от скорости ее распада (скорости вытекания воды из ведра), и от интенсивности транскрипции (потока воды в кране).
Автор
Редакторы
Статья на конкурс «био/мол/текст»: РНК — рибонуклеиновая кислота — это один из основных типов молекул в клетке. Различных видов РНК существует огромное количество, и их синтез идет постоянно. Но если бы РНК только накапливалась, то очень скоро она бы заполнила собой всю клетку. Поэтому параллельно с синтезом в клетке постоянно происходит противоположный процесс — распад РНК. Причем процесс этот сложный и тщательно регулируемый. Именно о нем и пойдет речь в статье.
Конкурс «био/мол/текст»-2013
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2013 в номинации «Лучший обзор».
Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
РНК — неотъемлемый участник большинства клеточных процессов. Прежде всего, РНК обеспечивают трансляцию: с матричных РНК (мРНК) считываются последовательности аминокислот в белке, транспортные РНК (тРНК) «поставляют» аминокислоты к месту синтеза, а саму реакцию осуществляют рибосомы, основной компонент которых, — рибосомные РНК (рРНК). Но роль РНК не ограничивается этими наиболее известными функциями. В последующие годы после открытия первых некодирующих РНК (тех, которые не кодируют белок, то есть всех не-мРНК) — рРНК и тРНК, — стало появляться множество новых данных об участии некодирующих РНК в самых разнообразных клеточных процессах. Оказалось, что РНК участвуют в таких важнейших клеточных процессах, как репликация (Y РНК), транскрипция (U1 РНК, 7SK РНК), сплайсинг (малые ядерные РНК U1, U2, U4, U5 и U6), процессинг (ряд малых ядрышковых РНК), клеточный транспорт (7SL РНК). Не так давно открытые микро-РНК и малые интерферирующие РНК участвуют в регуляции экспрессии генов и помогают в защите клетки от чужеродного генетического материала [2–5]. А некоторые молекулы РНК — рибозимы — даже могут осуществлять биохимические реакции, т.е. выступать в роли ферментов, что всегда считалось прерогативой белков. Так что, нет такой сферы клеточной деятельности, в которую не проникли молекулы РНК.
Как РНК образуются в клетке, изучено довольно хорошо. Но как эти молекулы разрушаются? И когда? Ведь некоторые РНК живут в клетке очень долго, другие же разрушаются за несколько минут. От чего это зависит?
Общие правила распада РНК
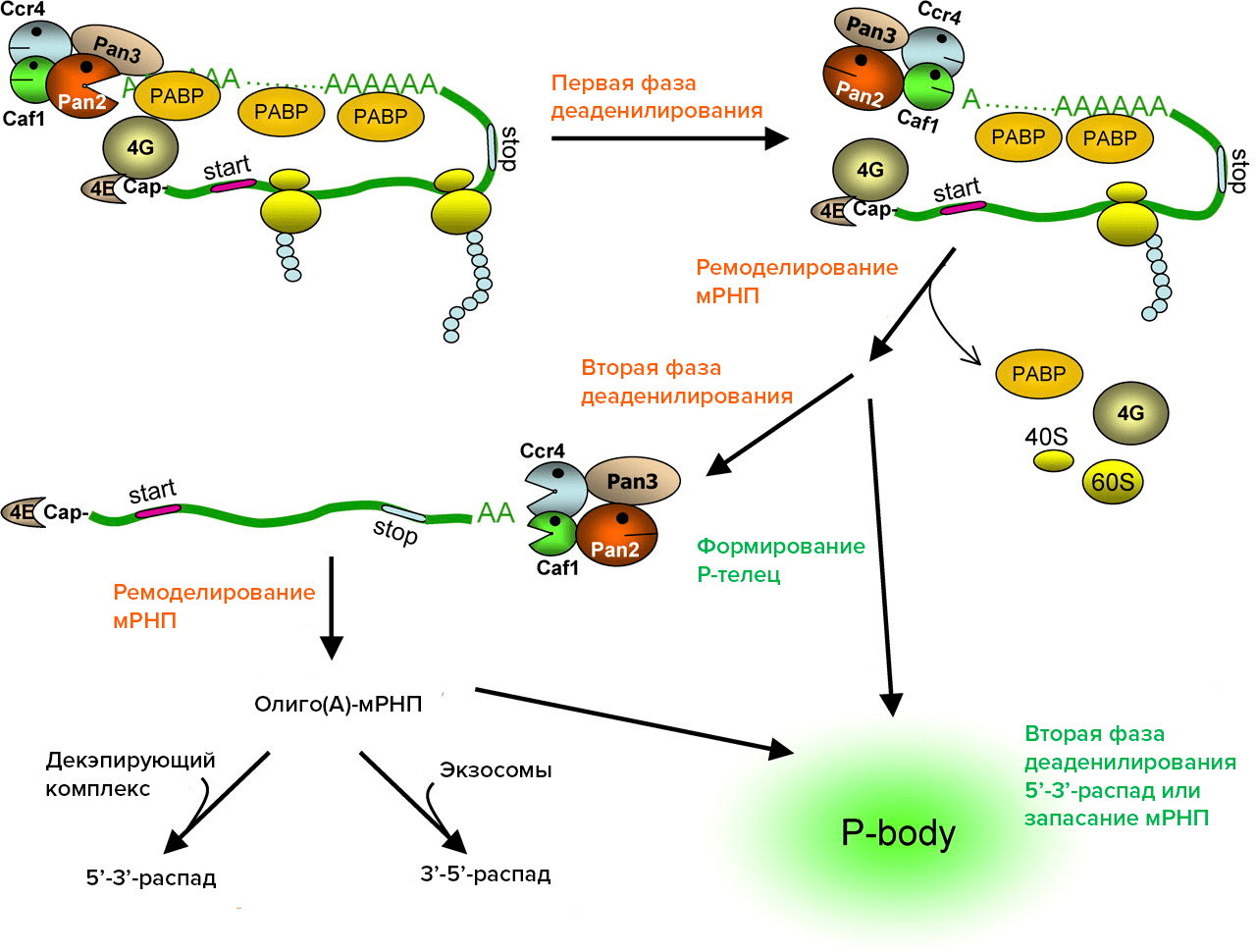
Рассмотрим сначала самый известный класс РНК — мРНК. У эукариот большинство мРНК имеет на 3’-конце «хвост» из многочисленных остатков аденина (обозначается как поли(А)). Присоединение поли(А)-хвоста к мРНК происходит в ядре с помощью определенного фермента. Для того, чтобы произошло полиаденилирование, необходимо, чтобы в составе мРНК был специальный сигнал — AAUAAA. В клетках млекопитающих поли(А)-хвост, достигающий длины 250 нуклеотидов, взаимодействует с поли(А)-связывающими белками (poly-A-binding protein, PABP). Поли(А)-хвост в комплексе с PABP очень важен: он участвует в транспорте мРНК из ядра в цитоплазму, в трансляции и защищает мРНК от распада, т.е. придает ей стабильность. Один белок PABP связывается с 12 аденозинами, но закрывает при этом 25–27 оснований. В цитоплазме плавают специальные ферменты — деаденилазы, — которые откусывают кусочки от поли(А)-хвостов. Если у мРНК поли(А)-хвост сократился до длины, недостаточной для связывания хотя бы одной молекулы PABP, то она подвергается быстрой деградации. Соответственно, первый шаг на пути деградации большинства мРНК — разрушение поли(А)-хвоста [6], [7].
Рисунок 1. Этапы распада мРНК в клетках млекопитающих. Деаденилирование осуществляется с помощью ферментов CCR4, Caf1, Pan2-3. После первой фазы деаденилирования поли(А)-хвост мРНК укорачивается до размеров небольшого олиго(А)-участка, мРНК перестает транслироваться (теряет PABP, факторы инициации трансляции, рибосомы). На второй фазе деаденилирования мРНК полностью теряет поли(А), после чего подвергается декэпированию и деградации с 5’-конца или с 3’-конца с помощью экзосомы или же отправляется в Р-тельце для временного хранения в нетранслируемом состоянии.
В цитоплазме почти все факторы, участвующие в распаде РНК (ферменты, разрушающие поли(А)-хвост, отрезающие кэп, различные экзонуклеазы), сконцентрированы в специальных гранулах — Р-тельцах. По сути, они представляют собой скопления белков и недораспавшихся РНК. Согласно последним данным, в Р-тельцах происходит не только разрушение мРНК, но также и их накопление, и временное хранение. Такая изоляция в Р-тельцах защищает клетку от случайной трансляции не успевших деградировать молекул. Таким образом, мРНК в цитоплазме может пребывать в двух состояниях: в транслируемом, и тогда она связана в комплексы с рибосомами, и нетранслируемом — в составе Р-телец [9], [10].
Существует большое количество механизмов распада РНК, характерных для определенных обстоятельств или специфических молекул РНК. Некоторые из них будут описаны ниже. Однако стоит подчеркнуть, что несмотря на отличия на начальных этапах процесса, в любом случае дело заканчивается разрушением РНК с помощью все тех же белков — экзонуклеаз или экзосом, а в случае мРНК еще и ферментов, удаляющих кэп, и избавляющих РНК от поли(А)-хвоста. Далее все эти белки я буду называть «факторами деградации».
Хвост нужен для деградации
В клетках прокариот разрушение и мРНК, и стабильных рРНК и тРНК происходит сходным образом. Принципиальное отличие от эукариот заключается в том, что у прокариот деградация РНК всегда начинается с внутреннего разреза молекулы эндонуклеазой, и только потом получившиеся фрагменты РНК деградируют до отдельных нуклеотидов с помощью экзонуклеаз. Что самое интересное, РНК прокариот перед деградацией приобретают поли(А)-хвосты, хотя раньше считалось, что полиаденилированные РНК есть только у эукариот. Прокариотам поли(А)-хвост нужен исключительно как платформа, с которой связываются экзонуклеазы перед началом деградации РНК. Учитывая этот факт, можно предположить, что и у эукариот поли(А)-хвост — это затравка для распада мРНК, которая в процессе эволюции приобрела дополнительные, теперь уже неотъемлемые, защитные и транспортные функции [6], [11].
У мРНК гистонов другие хвосты
Следует отдельно сказать об мРНК гистонов. Гистоны — белки, обеспечивающие компактную упаковку ДНК в хромосомы. Важно, что в клетке они транслируются только во время S-фазы клеточного цикла, когда происходит репликация ДНК: гистоны нужны для упаковки вновь синтезированной ДНК. После этого их мРНК необходимо разрушить. Регуляция синтеза гистонов и распада их мРНК очень важна, т.к. любые нарушения упаковки ДНК в хромосомы могут иметь катастрофические последствия для клетки. Поэтому для деградации мРНК гистонов существует независимый от всех других РНК механизм, который включается исключительно во время S-фазы.
В клетках эукариот мРНК гистонов уникальны, потому что они не имеют интронов (участков РНК, которые вырезаются из нее в процессе сплайсинга — одного из важнейших этапов созревания мРНК у эукариот) и поли(А)-хвоста. Отсутствие поли(А)-хвоста, видимо, тоже связано со спецификой созревания этих мРНК: у них нет сигнала полиаденилирования, и их 3’-конец образуется просто благодаря эндонуклеотическому разрезу. Но как же происходит распад, если у мРНК гистонов отсутствует платформа в виде поли(А)-хвоста для привлечения необходимых ферментов? Эта задача решается очень просто: вместо поли(А)-хвоста на конце мРНК синтезируется поли(U)-хвост, причем происходит это уже не в ядре, как у остальных мРНК, а в цитоплазме. Зрелый 3’-конец мРНК гистонов состоит из так называемой стебельно-петлевой структуры и АСС-хвостика. Эта структура выполняет роль стабилизатора — как поли(А)-хвост для других мРНК. С ней взаимодействует белок, который привлекает ферменты, синтезирующие поли(U)-хвост на конце мРНК. А дальше распад мРНК гистонов проходит уже без особенностей. То есть, у мРНК гистонов поли(U)-хвосты выполняют ту же функцию при распаде РНК, что и поли(А)-хвосты у прокариот [6].
Контроль качества
Зачем же все-таки нужно уничтожать РНК? Прежде всего, с помощью механизмов распада клетка избавляется от «испорченных» РНК. Ошибка в одной мРНК в конечном счете приводит к синтезу многих неправильных белковых молекул, а те, в свою очередь, тоже не могут выполнять свою работу. Нарушения в некодирующих РНК (рРНК, тРНК и др.) не менее опасны: часто такие молекулы просто перестают нормально функционировать. Поэтому в клетке происходит постоянный контроль качества РНК от этапа синтеза молекул до их созревания и дальнейшей работы.
Куда деть непригодные матричные РНК?
Далеко не все из вновь синтезированных в ядре мРНК функционально пригодны. Многие из них с самого начала содержат ошибки. От таких «неправильных» мРНК необходимо избавляться. Первоочередная задача — определить, где произошла ошибка. Удобнее всего это делать во время синтеза белка: первый раунд трансляции, когда с данной мРНК впервые синтезируется белок, как бы служит проверкой мРНК на качество.
Один из вариантов мутаций, которые могут возникать при синтезе мРНК — появление терминирующего кодона в неположенном месте. Это происходит, если при синтезе мРНК полимераза вместо нужного нуклеотида вставила другой, в результате чего вместо значащего триплета появляется стоп-кодон. С таким кодоном связываются факторы терминации, и синтез белка заканчивается раньше времени. Чтобы избежать накопления таких «обрубленных» белков, существует NMD (nonsense-mediated decay) — деградация, обусловленная появлением преждевременного стоп-кодона.
Основная роль в этом механизме принадлежит маркерным белкам, которые расположены на мРНК выше, чем нормальный терминирующий кодон. Именно взаимодействие этих маркеров с аппаратом терминации трансляции и приводит к запуску процесса распада мРНК. В этом механизме ключевую роль играет первый раунд трансляции: если после него мРНК не разрушилась, то она приобретает «иммунитет» к NMD, потому что маркерные белки при первом прохождении рибосомы удаляются (рис. 2) [12], [13].
Рисунок 2. Система nonsense-mediated decay (NMD). В норме рибосома при синтезе белка сдвигает маркерные белки, и распада мРНК не происходит (слева). Если же мРНК содержит нонсенс-мутацию, то к тому моменту, когда рибосома дойдет до ложного стоп-кодона, и с ним свяжутся факторы терминации трансляции, маркерные белки будут все еще связаны с мРНК (справа).
Иногда из-за ошибок синтеза мРНК она, наоборот, теряет стоп-кодон, а не получает лишний. В этом случае вместо того, чтобы остановиться в нужном месте, рибосома продолжает синтез за пределы транслируемой области, и белок получается удлиненным. На этот случай у некоторых мРНК существует специальный механизм деградации — REMD (ribosome extension-mediated decay). Принцип этого механизма похож на предыдущий. С нетранслируемой областью мРНК связан комплекс белков. Если к концу синтеза он остается на своем месте, мРНК продолжает функционировать как матрица в последующих раундах трансляции. Сдвигание же этого комплекса (из-за прохождения рибосомы) сигнализирует о том, что от мРНК надо избавиться [14].
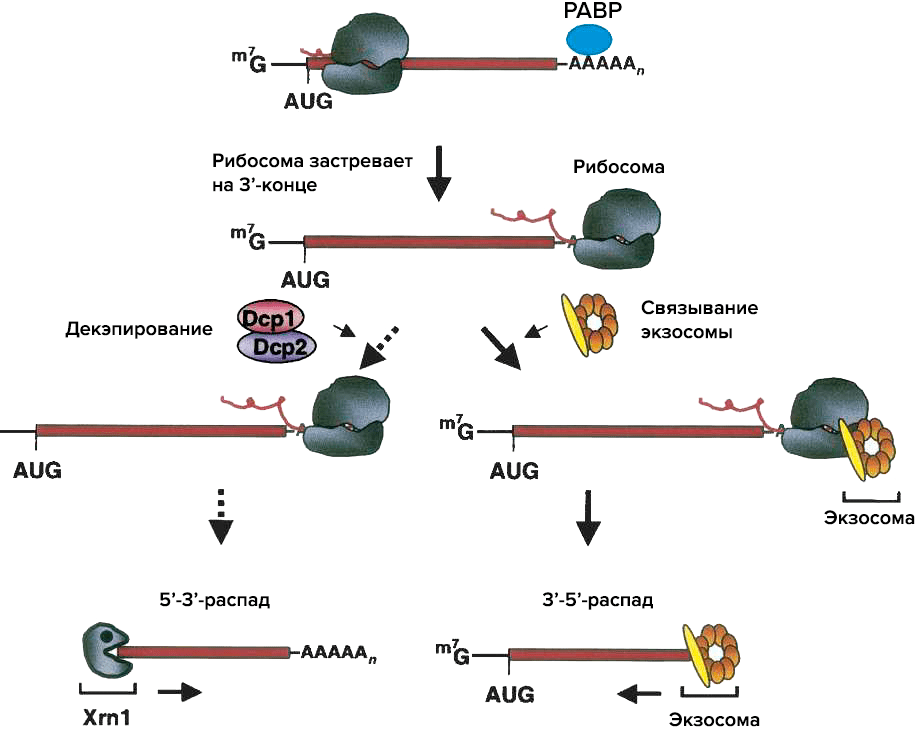
мРНК может потерять стоп-кодон и по другой причине — если ее синтез был прерван. Такая обрубленная мРНК все равно может участвовать в трансляции, но долго прожить ей не удается благодаря механизму NSD (nonstop decay). Поскольку нормальной терминации на недосинтезированной мРНК произойти не может, то, дойдя до ее конца, рибосома просто останавливается. К такой «повисшей» на краю мРНК рибосоме тут же подскакивают определенные белки, связываются с ней и привлекают факторы деградации (рис. 3) [15].
Рисунок 3. Схема non-stop decay (NSD)
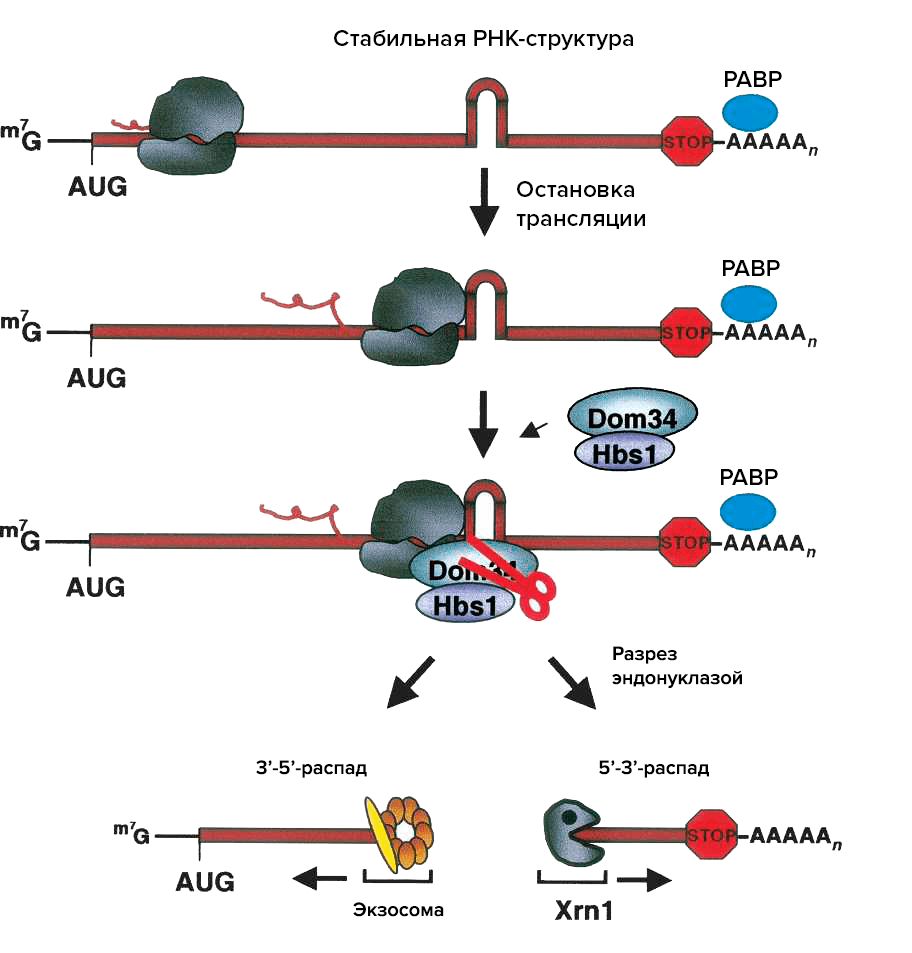
В некоторых случаях на пути рибосомы при ее проходе по мРНК встают непреодолимые препятствия, опять же из-за нарушений в мРНК или рРНК (см. ниже). Такую рибосому узнают определенные белки, они в свою очередь привлекают эндонуклеазу, которая разрезает мРНК в месте остановки. Далее оставшиеся два куска мРНК подвергаются распаду с помощью экзонуклеаз. Этот механизм деградации называется NGD (no-go decay) (рис. 4) [15].
Рисунок 4. Схема no-go decay (NGD)
Долгоживущие РНК все-таки не вечны
Рано или поздно каждая РНК в клетке распадается. Даже некодирующие рРНК и тРНК, которые обычно живут долго, со временем все-таки отбраковываются по мере появления в них ошибок, то есть по мере «изнашивания».
От общего количества РНК в клетке наибольшую долю составляют рибосомные — 18S и 25S. Учитывая, что обе эти РНК входят в состав рибосом, логично было бы предположить, что нарушения в этих РНК выявляются в процессе синтеза белка. Это верно только для 18S рРНК — именно она занимается узнаванием кодонов мРНК при трансляции. Если во время синтеза белка рибосома останавливается, то 18S рРНК быстро разрушается, т.е. фактически используется такой же механизм выявления ошибки, что и при NGD. В обоих случаях сигналом к запуску распада выступает «застрявшая» во время синтеза рибосома. Очень может быть, что при этом ферменты разрушают и мРНК, и 18S рРНК без выяснения того, из-за которой из них произошла остановка синтеза. В данном случае надежнее сразу избавиться от обоих участников процесса. Однако это никак не касается 25S рРНК, в которой непосредственно находится ферментативный центр рибосомы. Распад 25S рРНК не зависит не только от трансляции, но и практически от всех белков, участвующих в различных типах распада РНК, кроме одной из экзосомных экзонуклеаз. Предполагается, что сигналом для распада 25S рРНК является невозможность связывания рибосомных белков с дефектной молекулой. Видимо, прежде всего, в деградации 25S рРНК участвуют ферменты распада белков. После диссоциации рибосомных белков от 25S рРНК и их распада сама теперь уже «оголенная» рРНК становится доступной для экзонуклеаз [16–19].
Время жизни тРНК измеряется часами и днями. В течение этого времени они постоянно участвуют в синтезе белка, проходя примерно через 40 циклов трансляции в минуту. Нуклеотиды в составе тРНК специфическим образом модифицированы. Мишенью для быстрого распада прежде всего становятся тРНК, по какой-либо причине потерявшие свои модификации. Такие тРНК менее компактны из-за нарушения структуры и являются легкой добычей для факторов деградации [20]. На 3’-хвосте гипомодифицированных тРНК синтезируется дополнительный тринуклеотид ССА, что является сигналом быстрого распада [21].
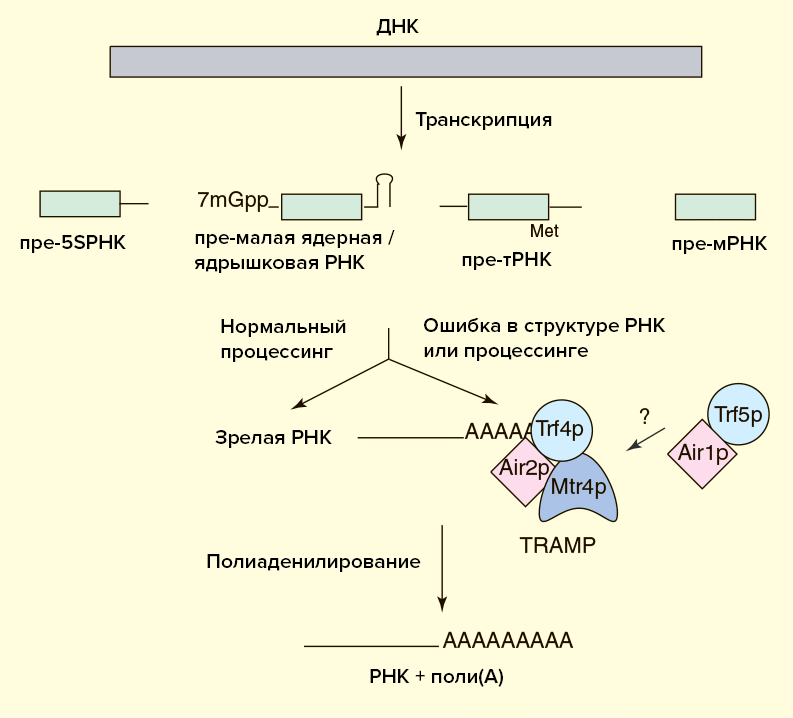
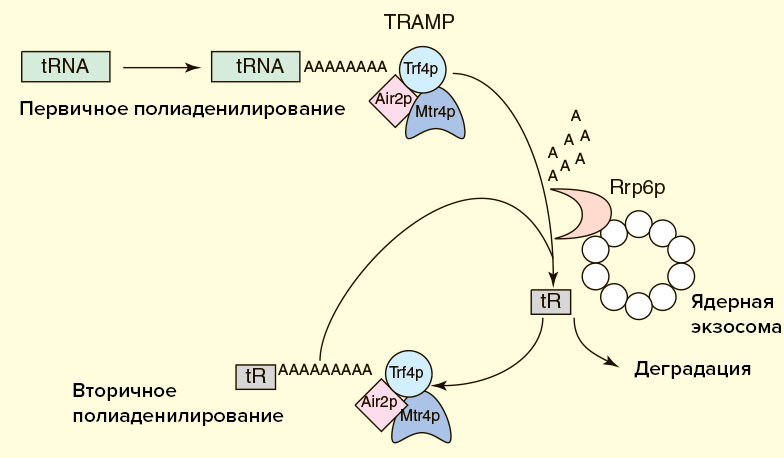
Известно, что TRAMP может стимулировать экзосомную деградацию и неполиаденилированной РНК, но в этом случае процесс идет медленнее. Зачем же нужен поли(А)-хвост? Дело в том, что некодирующие РНК вовсе не представляют собой одноцепочечную нить, а свернуты в сложные вторичные и третичные структуры. Иногда экзосома в процессе укорочения РНК «застревает» на высокоструктурированных участках. В этом случае TRAMP осуществляет дополнительные раунды полиаденилирования и деградации до тех пор, пока РНК не будет полностью разрушена. Видимо, для быстрой эффективной работы экзосоме необходима затравка в виде одноцепочечного участка РНК, роль которого как раз и играет поли(А)-хвост (рис. 5) [22].
Рисунок 5а. Схема деградации некодирующих РНК в ядре
Рисунок 5б. Схема деградации полиаденилированной тРНК экзосомой
Некоторым РНК нельзя позволять долго жить
Распад РНК — это не только способ контролировать качество работающих в клетке молекул, это также и мощный механизм регуляции. Известно, что в клетке есть РНК, которые распадаются очень быстро, за считанные минуты. Время жизни РНК напрямую связано с ее функцией. Быстрее всего распадаются мРНК, кодирующие регуляторные факторы. Количество этих молекул повышается в определенный момент клеточного цикла или в ответ на определенные стимулы, после чего они быстро распадаются. Такая система позволяет клетке оперативно реагировать на различные внутренние и внешние сигналы. Если этот процесс по каким-либо причинам нарушается, и РНК накапливаются в избыточном количестве, это может привести к сбою в работе всей клетки. Поэтому многие из генов таких мРНК являются протоонкогенами. Такие гены, как c-myc, c-fos, TNFα относятся к их числу.
Как оказалось, такие короткоживущие мРНК содержат специальные сигналы быстрого распада. Самый распространенный тип подобного сигнала — AU-богатый элемент (т.е., последовательность, богатая аденином и урацилом). AU-богатые элементы представляют собой последовательности в Если вставить такой элемент в состав долгоживущей РНК, то она начнет быстро распадаться. Например, AU-богатый элемент c-fos укорачивает время жизни мРНК β-глобина с более, чем 24 часов до 37 минут! С AU-богатыми элементами связываются клеточные факторы, которые и контролируют их функции, и привлекают ферменты деградации. Иногда они вовсе не стимулируют быстрый распад мРНК, а, наоборот, стабилизируют ее. Одни и те же белки могут связываться с разными AU-богатыми элементами и вызывать при этом различный эффект [23], [24].
Интересно, что многим короткоживущим мРНК одних AU-богатых элементов не хватает. Они содержат и другие последовательности, которые независимо от AU-богатых элементов ускоряют их разрушение. Так что, если по каким-то причинам один из двух механизмов деградации данной мРНК не сработал, то второй уж точно обеспечит ее распад. По-видимому, эта система двойной регуляции времени жизни возникла в эволюции особо важных, но при этом потенциально опасных в случае излишнего накопления мРНК. Кроме того, наличие двух элементов быстрой деградации дает большую гибкость при клеточном ответе на внешние и внутренние сигналы [25].
Чтобы не распасться, нужно стабилизироваться
А что, если мы зададимся не вопросом, почему какие-то РНК быстро распадаются, а почему другие живут долго? Может быть, РНК-долгожители не деградируют, потому что содержат сигналы, защищающие их от быстрого разрушения? Действительно, совсем недавно выяснилось, что многие долгоживущие мРНК имеют в своем составе определенные мотивы, с которыми взаимодействуют белки-стабилизаторы. Пока известно восемь таких элементов и изучена их связь с белком со сложным названием HNRPA2B1. Этот белок обеспечивает удлинение времени жизни соответствующей мРНК. Вероятно, существуют и другие подобные белки, которые еще только предстоит обнаружить. Кроме того, пока остается открытым вопрос, как именно работает механизм защиты РНК от деградации [26].
Разрушение? Нет, защита
РНК-интерференция — это механизм подавления экспрессии генов, который может вести к распаду соответствующей мРНК. В системе РНК-интерференции принимают участие два типа молекул РНК — микроРНК и малые интерферирующие РНК. Эти молекулы имеют очень малые размеры — около 22 нуклеотидов.
Эти маленькие РНК соединяются с комплементарными им последовательностями мРНК-мишеней, после чего происходит или разрезание мРНК-мишени и дальнейшее разрушение ее фрагментов, или просто блокировка трансляции с этой мРНК. Какие же РНК становятся жертвами РНК-интерференции? Микро-РНК чаще всего связываются с клеточными мРНК, распад которых необходим для регуляции экспрессии соответствующих генов. Малые интерферирующие РНК призваны защищать клетку от чужеродных РНК, попадающих в клетку из вирусов, а также от внутренних врагов — ретротранспозонов [27].
Что же такое распад РНК для клетки?
Подытожим, зачем нужен распад РНК.
Во-первых, это контроль качества РНК. Своевременный распад нефункциональной РНК препятствует накоплению ненужных и потенциально опасных для клетки молекул (как непосредственно РНК, так и белков). Неоценимую помощь в этом процессе оказывают разнообразные механизмы регистрации ошибок, заточенные под распознавание определенных типов нарушений РНК.
Во-вторых, это регуляция экспрессии генов. Экспрессия гена — это преобразование информации, хранящейся в генах, в функциональный продукт — РНК или белок. Но ведь количество той или иной РНК или белка в клетке в каждый момент времени определяется и уровнем синтеза этой молекулы, и уровнем распада. Поэтому быстрая деградация РНК — это очень важный механизм регуляции экспрессии, который позволяет клетке быстро отвечать на внутренние и внешние сигналы.
В-третьих, это защита от чужеродных и вредных молекул. Часто генетический материал вирусов оказывается в клетке именно в форме РНК, кроме того, некоторые транспозоны могут транскрибироваться, что также приводит к накоплению нежелательных молекул. Распознавание этих РНК и избавление от них клетки — необходимый защитный процесс, который также обеспечивается механизмами, основанными на распаде РНК.
Чем лечить коронавирус? Новые ответы вирусолога
Ника Воюцкая
Почему одни вирусы остаются локальными, а другие — становятся причиной пандемии? Можно ли предсказать пандемию? Когда мы получим вакцину и лекарство — и как они будут работать? Корреспондент «СПИД.ЦЕНТРа» Ника Воюцкая узнала ответы на эти вопросы у петербургского вирусолога и исполняющего обязанности директора Института биомедицинских систем и биотехнологий Политехнического университета имени Петра Великого Андрея Васина.
— Давайте повторим для читателя еще раз, что вообще из себя представляет новый коронавирус?
— Новый коронавирус — SARS-Cov-2 — представитель одного из многочисленных семейств РНК-содержащих вирусов человека и животных. Вирус — это упакованная молекула нуклеиновой кислоты (ДНК или РНК). Для размножения вирус должен попасть в клетки хозяина, а он, в свою очередь, сопротивляется и вырабатывает механизм защиты, который вирус пытается обойти.
— Причем вирусы эволюционируют быстрее, чем клеточные организмы.
— Да. В этом их преимущество. Организм хозяина (например, человека) так быстро эволюционировать не может, потому что устроен сложнее. Каждый раз, когда появляется новый вирус или новая разновидность уже известного вируса, организму нужно время, чтобы выработать защиту.
Вирус заразил клетку — клетка выработала защиту против вируса — вирус накопил определенное количество ошибок в геноме, и какие-то из них позволили вирусу обойти защиту клетки — вирус размножается дальше. Эволюция, с точки зрения вирусологии, — это история войны клеточных организмов с вирусами, в результате которой и те и другие меняются и приспосабливаются друг к другу.
— Если вирусы такие классные, почему мы, люди, до сих пор живы?
— Вирусу выгодно инфицировать клетку, но не убивать ее. Где он будет дальше размножаться? 1918 год. «Испанка», новый вирус, к которому не было популяционного иммунитета. 50 млн человек умерли за один эпидемический сезон. Кто-то выжил — и приобрел иммунитет к «испанке». На следующий год заболевание у переболевших прошло в гораздо более легкой форме — потому что появился иммунитет к вирусу. Резюме: когда новый вирус попадает в популяцию, смертность от него высокая (но для разных вирусов разная: может быть 1–2 %, может — 50 %). Проходит время, вирус и организм адаптируются друг к другу, что приводит к снижению тяжести заболевания и летальности.
— Спрошу сразу: когда нам ожидать лекарство от нового коронавируса?
— Разрабатывать новое лекарство очень сложно и долго. Если не говорить о препаратах, созданных методами генной инженерии, а о традиционных низкомолекулярных лекарствах — на это может уйти около десяти лет и несколько миллиардов долларов.
Поэтому вместо изобретения нового лекарства от COVID-19 исследователи делают repurposing of the drugs — испытывают против нового коронавируса уже известные препараты. На первых этапах проводят скрининг с помощью биоинформатики и компьютерного моделирования. Дальше — экспериментальная проверка.
Так можно пропустить целый этап проверки безопасности и токсичности. Ученым остается лишь доказать, что препарат эффективен при этом заболевании и именно при этом заболевании не вызовет побочных эффектов.
Сейчас испытывается множество таких лекарств — четыре наиболее перспективных выбрала ВОЗ, но, вообще, их гораздо больше. Китай испытывает все подряд, от новейших разработок до традиционной китайской медицины, — вдруг сработает? У них есть такая возможность.
— А как вообще лекарство от одного вируса может победить другой вирус?
— Возьмем «Калетру» (Лопинавир + Ритонавир) — ингибитор протеазы ВИЧ — и один из препаратов, исследуемых сейчас ВОЗ для лечения коронавируса. Идея вот в чем: у коронавируса тоже есть фермент протеаза. Вдруг ингибитор протеазы ВИЧ проингибирует и протеазу нового вируса? То же касается и ингибиторов полимеразы (Ремдезивир, Фавипиравир) — фермента, который позволяет вирусам реплицировать свой геном.
— «Калетра» в китайском рандомизированном контролируемом исследовании показала себя неэффективной. Пациентов было 199. Это окончательный результат?
— Пациенты — неоднородная масса людей, и у всех заболевание протекает по-разному. Опасность исследования с маленькой выборкой в том, что в него теоретически могли попасть именно те люди, для которых препарат оказался малоэффективным. Или наоборот. А большая выборка может показать, что для другой группы пациентов препарат сработает. Поэтому нужно больше исследований.
— Как работает Ремдезивир — еще одно потенциальное лекарство от коронавируса? Читаю, что это ингибитор РНК-зависимой РНК-полимеразы, но не понимаю, что это значит.
— Цепочка РНК вируса состоит из нуклеотидов: A, C, U и G. РНК-полимераза — вирусный фермент, который эту цепочку распознает и копирует. Если мы добавляем модифицированное основание, оно распознается полимеразой и автоматически добавляется к цепочке как обычный нуклеотид. Но новый нуклеотид к этой цепочке присоединиться уже не может. Или свойства этой цепочки нарушаются. Так мы блокируем РНК-полимеразу, и вирус больше не реплицируется.
— Пока самые обнадеживающие новости — о Хлорохине и Гидроксихлорохине. Французские ученые успешно провели клиническое исследование Гидроксихлорохина в лечении COVID-19. Можно говорить о победе?
— Это дает надежду, но выводы делать рано. Нужны исследования с большей выборкой. Разница между эффективностью плацебо и препарата оказалась достоверной, но в исследовании участвовали всего 36 человек. Эти препараты успешно лечат малярию, но как они себя поведут и какие побочные действия дадут при лечении коронавируса — пока неизвестно.
— Есть еще терапия антителами. Как она работает и когда ее ждать?
— Что такое антитело? Это молекула, которая вырабатывается клетками иммунной системы и нейтрализует вирус. Можно сделать его искусственно и ввести человеку, остановив тем самым распространение вируса. Подход старый: на заре вирусологии брали кровь переболевшего человека и вводили больному — иногда помогало, но давало много побочных эффектов. Сейчас антитела находят, выделяют, очищают и делают из них препарат.
Антитело, которые мы получаем в лаборатории, может эффективно нейтрализовать вирус. Но это большая белковая молекула, и она может быть токсичной, дать серьезные побочные эффекты или просто потерять активность. Можно не синтезировать антитело в лаборатории, а сделать так, чтобы сам организм его синтезировал.
Из-за того, что данных мало, утверждать, какой будет длительность иммунитета от SARS-CoV-2, нельзя. Но можно предположить, что пожизненного иммунитета к нему не будет.
Для этого определяем генетическую последовательность, кодирующую антитело, и «записываем» ее в молекулу мРНК. Эту молекулу вводим в организм. Там уже внутри клетки происходит трансляция молекулы мРНК, и антитело синтезируется в «естественных» условиях.
То есть мы делаем молекулу «кода», вводим в организм — и организм расшифровывает «код» и сам производит антитела. Молекулы РНК меньше размером, чем молекулы белка, стабильнее, гомогеннее по структуре и проще в производстве, чем молекулы антитела, — в этом их преимущество.
До конца пандемии разработать эффективную антительную терапию от COVID-19, а тем более на основе мРНК точно не получится. Но есть надежда, что пандемия SARS-CoV-2 ускорит развитие противовирусных иммунобиотехнологий и произойдет технологический рывок. И это позволит человечеству подойти к новой пандемии более подготовленным, чем к пандемии SARS-CoV-2.
—Насколько, вообще, часто появляются новые вирусы?
— Глобальные, как SARS-CoV-2, — не так уж часто. Ближайшая к нам сходная пандемия — та самая «испанка» 1918 года. Новый коронавирус — вторая крупная пандемия современного мира, потенциально сравнимая с «испанкой» по масштабу и скорости распространения (но не по смертности). Есть пандемия ВИЧ — но она растянута во времени. Была пандемия свиного гриппа 2009 года, но не столь опасная: вызвана новым вариантом вируса гриппа, но все же гриппом, против которого уже были препараты и технологии производства вакцин.
— Почему одни вирусы остаются локальными, а другие вызывают пандемию? Коронавирусы SARS или MERS не привели к пандемии. А ведь это относительно недалекое прошлое, когда было и авиасообщение, и высокая плотность населения в городах.
— Дело, скорее, в биологических свойствах конкретного вируса, а не в свойствах популяции. Чтобы вирус широко распространился, у него должно одновременно совпасть несколько характеристик: специфичность к рецептору на клетке, распространенность этого рецептора, эффективность репликации в данном типе клеток и многое другое.
При этом быстро распространиться могут только те вирусы, которые передаются воздушно-капельным и контактным путем. Вирус Эбола передавался с инфицированными биологическими жидкостями — поэтому его получилось локализовать. SARS и MERS также не обладали набором свойств для быстрого глобального распространения. А в новом коронавирусе «удачные» для распространения свойства совпали.
— Можно ли предсказать пандемию?
— Какой из вирусов станет пандемическим и как он будет распространяться — нет, это процесс стохастический. Вирус быстро накапливает мутации, происходит изменение его характеристик и свойств. Это абсолютно случайный процесс, хотя и подверженный действию отбора. При этом было известно, что коронавирусы обладают пандемическим потенциалом, можно было ожидать, что один из них приведет к пандемии. Но невозможно было предсказать, когда это случится.
— Как определить, что вирус обладает пандемическим потенциалом?
— Новые вирусы человека не возникают ниоткуда — это зоонозный тип передачи: от летучих мышей, обезьян и кого угодно из животных, с кем у человека есть контакт. Если изучать вирусы, которые циркулируют среди животных, можно предположить, какие из них потенциально могут преодолеть межвидовой барьер и «перепрыгнуть» на человека. А они могут, если животное эволюционно близкое человеку (обезьяны) или у него есть общие гомологичные рецепторы (летучие мыши — панголины — человек).
Возьмем птичий грипп: высокопатогенный вирус гриппа птиц H5N1 преодолел межвидовой барьер. Но, к счастью, от человека к человеку не передавался. Вот если бы он мутировал так, что смог бы передаваться от человека к человеку, мы получили бы пандемию с очень высокой степенью летальности. Поэтому изучению гриппа птиц уделяют много внимания.
Так что есть постоянная угроза пандемии. Мы не можем предсказать ни время начала, ни источник, ни летальность. Это как с землетрясениями: может быть? Да. Повлиять или предсказать можем? Нет. Пандемия с высокой летальностью может случиться раз в сто лет, а может — раз в шестьсот. Или, может, через год будет новая.
— Будет ли иммунитет у тех, кто переболел новым коронавирусом?
— Коронавирусы человека не очень хорошо изучены: среди людей до настоящего времени встречались всего шесть представителей семейства. Четыре (OC43, HKU1, NL63 и 229E) вызывают обычные легкие респираторные инфекции и не были особо интересны исследователям. Еще два, SARS и MERS — вирусы атипичной пневмонии и ближневосточного респираторного синдрома, — изучались, но инфекции были ограниченными. Из-за того, что данных мало, утверждать, какой будет длительность иммунитета от SARS-CoV-2, нельзя. Можно предположить, что раз этот вирус РНК-содержащий, то он является вариабельным, то есть быстро изменяющимся, — и пожизненного иммунитета к нему не будет. Скорее, длительность иммунитета будет как к гриппу, относительно короткой.
— Что будет, если те, кто переболел и выздоровел, заболеют снова? Статистика смертности от нового коронавируса значительно выше, чем от гриппа.
— Есть вероятность, что новый коронавирус станет сезонным и будет, как грипп, циркулировать и создавать ежегодные эпидемические вспышки. При этом чем дольше вирус будет циркулировать в популяции, чем больше людей переболеют им в первый раз, тем легче он будет переноситься. И тем ниже будет вероятность осложнений и смерти в результате заражения. Тогда уже можно будет сравнивать смертность от сезонного гриппа и сезонного коронавируса SARS-CoV-2.
Разработать вакцину быстро невозможно. Такие испытания по самой сокращенной схеме занимают около полугода. Обычно — два-три года.
«Пра-пра-прадедушкой» всех современных вирусов гриппа можно считать тот самый вирус «испанки» 1918 года. Со временем в результате мутаций и замен некоторых генов из него образовались циркулирующие в настоящее время вирусы гриппа А. Сначала «испанка» унесла жизни 50 млн человек, сейчас же смертность от гриппа относительно невысокая. Вирус «привык» к людям, иммунная система людей «привыкла» к вирусу. (Не стоит забывать и о вакцинации против гриппа!) Наше идеальное сосуществование с новым вирусом будет тогда, когда летальных случаев не будет, а еще лучше — не будет тяжелых случаев.
— Как быстро появится вакцина от SARS-CoV-2?
— Разработать вакцину быстро невозможно. Сейчас часто пишут, что с современными технологиями сделать новую вакцину можно быстро. Это не так. Что такое «разработать»? Сделать в лаборатории некую биологическую конструкцию, которая потенциально может защищать организм, — требует месяца-двух.
Но то, что создано in silico и получено в лаборатории, нужно испытать на животных. Такие испытания по самой сокращенной схеме занимают около полугода. Обычно — два-три года.
На этом этапе вакцину испытывают по двум направлениям. Первое — безопасность. Второе — насколько она защищает от вируса. Для этого нужно использовать релевантную животную модель вирусной инфекции — то есть сначала адаптировать новый вирус к организму подопытного животного. Иногда адаптировать вирус получается быстро и легко, иногда нет. При этом развитие инфекции в животном должно имитировать человеческое. Если вирус респираторный — то и у лабораторного животного болезнь должна поражать органы дыхания.
— Как разрабатывается сама вакцина, ее формула? Тот самый первый этап, который теперь можно сделать за месяц.
— Можно ослабить или инактивировать вирус — это традиционный подход, но сейчас мало кто так делает — все делают генно-инженерные вакцины (векторные, рекомбинантные, ДНК, РНК). Для этого нужна только последовательность генома вируса. Имея ее, мы понимаем, какие белки этот геном кодирует, что вот этот белок, например, — поверхностный, и на него должны образовываться антитела, и т.д. Берем фрагмент гена/ген целиком/несколько генов вируса, синтезируем и вставляем в генетическую конструкцию. Она будет кодировать вакцинный антиген и/или саму вакцину. Дальше — испытываем на животных.
— Хорошо, мы создали вакцину в пробирке. Потом адаптировали вирус под животное, ввели ему вакцину, заразили, вакцина подействовала. Это заняло 7 месяцев. Что дальше? Уже можно вакцинировать людей?
— Пока нет. Следующая стадия — проверка безопасности на людях: находим здоровых добровольцев и вводим им вакцину. Если побочных реакций нет, испытываем вакцину на людях, которые могут заразиться этим вирусом. Стадия клинических исследований может длиться год, два, три… Но и это не все.
Если клинические исследования прошли успешно, нужно зарегистрировать вакцину и привить, скажем, 40 млн человек. Для этого нужно произвести 40 миллионов доз. Что может оказаться даже более сложной задачей, чем разработка самой вакцины. И только когда мы прошли путь от идеи до миллионов привитых, можно сказать: «Мы создали вакцину». В случае пандемии, когда все что можно упрощается и есть готовые производственные мощности, этот путь может занять полтора-два года. И это самый оптимистичный прогноз.