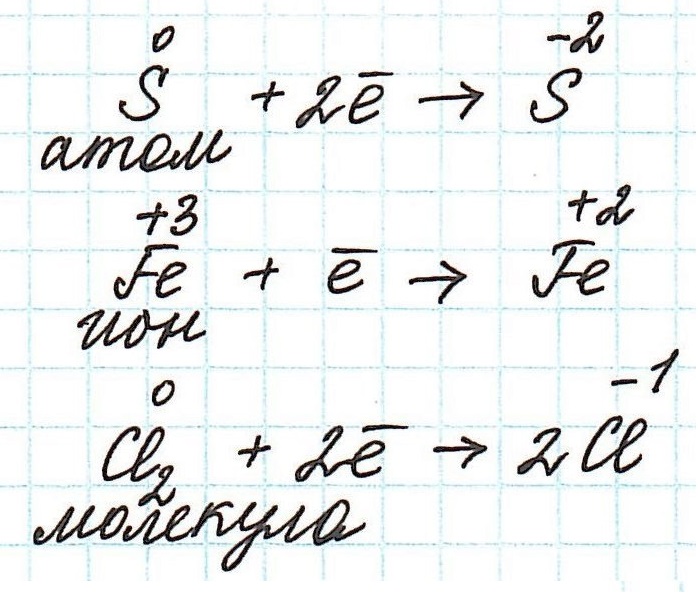Сильный окислитель как определить
Окислитель
Что такое окислитель

Нейтральные атомы. Окислителями могут быть только те из нейтральных атомов, которые, принимая электроны, переходят в отрицательно заряженные ионы, т. е. только нейтральные атомы неметаллов.
Рис. Перекись водорода окислитель.
Самые сильные окислители — атомы галогенов, так как они могут принимать только один электрон. Самые слабые окислители— атомы неметаллов четвертой группы.
В группах (4 — 7) окислительные свойства падают с возрастанием величин радиусов нейтральных атомов. Следовательно, из нейтральных атомов самый сильный окислитель — фтор, а самый слабый — свинец. Неметаллы могут быть не только окислителями, т. е. принимать электроны, но и отдавать электроны, т. е. быть восстановителями.
Положительно заряженные ионы как металлов, так и неметаллов также могут быть окислителями, так как они принимают электроны от других атомов или ионов. В процессе реакции они переходят: а) в положительные ионы низшей зарядности, б) в нейтральные атомы и в) в отрицательно заряженные ионы. Например:
Чем больше энергии было затрачено на отрыв электронов, тем сильнее они будут притягиваться образовавшимися ионами. Поэтому к сильным окислителям относятся, например, ионы „благородных» металлов, их ионизационные потенциалы довольно высокие: Au — 9,18 V, Ag — 7,54 V, Pd —8,3 V, Pt —8,88 V.
Необходимо заметить, что, хотя такие многозарядные положительные ионы в растворе существуют только в виде сложных анионов типов ЭO‘3, ЭO»4, ЭO‘4 и др., это, однако, нисколько не понижает их окислительной способности. Они являются сильными окислителями. К наиболее сильным окислителям принадлежат: фтор, озон, двуокись свинца, ионы «благородных» металлов и многовалентные положительные ионы.
Применяемые окислители в технике и лабораторной практике делятся на нейтральные, кислые и щелочные.
Нейтральные окислители
1. Кислород применяется для интенсификации производственных процессов в металлургической и химической промышленности (например, в доменном процессе, в производстве серной и азотной кислоты и т. д.). В нейтральной среде реакция окисления кислородом протекает по уравнению: O2 + 2Н2O + 4ē ⇄4OН‘, а в кислой среде:
2. Озон отличается от кислорода более сильной окислительной способностью: он многие красящие вещества обесцвечивает, металлы (за исключением Au, Pt и др.) окисляет, аммиак окисляет в азотистую и азотную кислоты, сернистые соединения — в сернокислые и т. д. В нейтральной среде реакция окисления озоном протекает по уравнению: O3 + H2O + ē → O2 + 2H‘, в кислой среде: O3 + 2Н • + 2ē → O2 + Н2O.
3. Электрический ток широко используется в технике не только как восстановитель, но и как окислитель для получения различных химически чистых веществ.
Кислые окислители
1. Хромовая и двухромовая кислоты известны только в растворе, поэтому вместо свободных кислот пользуются их устойчивыми солями (К2Сr2O7 и К2СrO4), которые и применяются в промышленности и лабораторной практике для окисления различных веществ. Обычно пользуются для этой цели смесью бихроматов калия или натрия с серной кислотой (60 ч. К2Сr2O7 +80 ч. конц. H2SO4 + 270 ч. Н2O).
2. Азотная кислота—один из сильнейших окислителей. Она окисляет очень многие металлы. Ею относительно легко окисляются и многие неметаллы, например: сера (при кипячени) до H2SO4, фосфор —до Р3РО4 углерод —до СО2 и т. д.
3.Азотистая кислота хотя и является окислителем, но при взаимодействии с более сильными окислителями сама проявляет восстановительные свойства, окисляясь до азотной кислоты. Азотистая кислота и её соли (KNО2 и NaNО2) применяются в качестве окислителей главным образом в производстве органических красителей.
4. Серная кислота концентрированная—сравнительно сильный окислитель, особенно при высокой температуре. Она окисляет С до СО2, S до SO2, HJ и НВr (частично) до свободных галогенов (J2 и Вr2). Серная кислота окисляет также многие металлы: Cu, Ag, Hg и др. Однако такие металлы, как Au, Pt, Ru, Os и др., устойчивы по отношению к ней. Проявляя окислительные свойства, H2SO4 обычно восстанавливается до SO2, с более сильными восстановителями— до S и даже до H2S. Разбавленной серной кислотой окисляются только активные металлы, стоящие в ряду напряжений выше пары водорода.
5. Хлорноватая кислота — в растворе является энергичным окислителем. Так, например, 40% водный раствор её окисляет горючие вещества (например, бумагу и др.) с воспламенением. Соли её, хлорноватокислые или хлораты, в растворе окислительных свойств не проявляют, но, будучи в кристаллическом состоянии при сплавлении, являются сильными окислителями. Наиболее важной солью из них является хлорноватокислый калий (бертолетова соль).
6. Перекись водорода, являясь сильным окислителем, используется в тех случаях, когда требуется окислить вещество, сравнительно легко разрушающееся от других окислителей. В технике Н2O2 применяется для отбеливания тканей, слоновой кости, соломы, мехов, перьев и т. д. Разрушая красящие вещества, перекись водорода почти не затрагивает отбеливаемого материала. В медицине Н2O2, сильно разбавленная, применяется для полоскания горла и промывки ран. Она применяется также для обновления потускневших картин, написанных масляными красками. В реакциях с более сильными окислителями Н2O2 сама проявляет восстановительные свойства. Она способна также к реакциям самоокисления-самовосстановления.
7. Двуокись марганца в кислой среде применяется при получении хлора из соляной кислоты, в стекольной промышленности, для окисления различных сернистых соединений и производных железа, при изготовлении гальванических элементов типа Лекланше и т. д.
8. Двуокись свинца является исключительно сильным окислителем. Она широко применяется в работе свинцовых аккумуляторов.
Щелочные окислители
1. Марганцовокислый калий (перманганат калия)— сильный окислитель, применяется для окисления многих органических соединений. Перманганат калия в кислой среде окисляет соли двухвалентного олова и железа в соли четырёх- и трёхвалентные. Он также окисляет: сульфиты — в сульфаты, нитриты — в нитраты, йодистый калий — до свободного йода, соляную кислоту — до хлора, перекись водорода— до кислорода и т. д. Характер восстановления КМnO4 зависит от среды, в которой протекает реакция.
2. Хлорная (или белильная) известь относится к числу наиболее сильных окислителей, широко применяется
для отбелки тканей и бумаги, для дезинфекции и т. д. В военное время хлорная известь используется для дегазации местности, заражённой отравляющим веществом.
3. Растворы гипохлорита калия и натрия
2KOH + Cl2 = KOCl + KCl + H2O
2NaOH + Cl2 = NaOCl + NaCl + H2O
применяются для отбелки тканей, главным образом хлопчатобумажных и льняных, а также бумаги.
Особое место занимают ионы так называемой промежуточной зарядности, которые в зависимости от условий реакции могут быть как окислителями, так и восстановителями. Таковы, например:
Следовательно, подразделение веществ на восстановители и окислители имеет до некоторой степени условный характер и преследует цель — указать на преобладание окислительных или восстановительных свойств у данного вещества в определённых условиях.
Статья на тему Окислитель
Похожие страницы:
Понравилась статья поделись ей
ОКИСЛИТЕЛИ И ВОССТАНОВИТЕЛИ В ХИМИЧЕСКИХ РЕАКЦИЯХ
Окислители и восстановители в химии — интересный, но очень часто вызывающий затруднения, вопрос.
К примеру, превращение с помощью нитрифицирующих бактерий атмосферного азота в легко усваиваемую растениями форму, фотосинтез, дыхание живых организмов (от бактерий до высших растений и животных) — это ОВР в природе.
А вот выплавка стали, промышленное получение аммиака из азота и водорода, гальванические процессы, электролиз – эти и огромное количество других процессов являются примерами ОВР в технике.
Так что же такое окислительно-восстановительные реакции (процессы)?
Понятие окислительно-восстановительной реакции
Окислительно-восстановительные реакции (ОВР) – это процессы, в ходе которых изменяются степени окисления атомов химических элементов.
Окисление и восстановление сопровождают друг друга. Один процесс без другого просто не существует. Почему?
Изменение степени окисления всегда означает переход электронов от одних частиц к другим. То есть одни частицы отдают электроны в ходе химического или электрохимического взаимодействия, а другие частицы принимают. Здесь срабатывает закон сохранения материи.
Окислители, восстановители. Окисление, восстановление
Итак, окисление – это процесс, в ходе которого частица передает свои электроны другой частице. В качестве таких частиц могут выступать отдельные атомы или ионы, а также молекулы.
Переход электронов принято показывать с помощью полуреакций:
Как не сложно заметить из представленных полуреакций, окислительный процесс приводит к увеличению степени окисления.
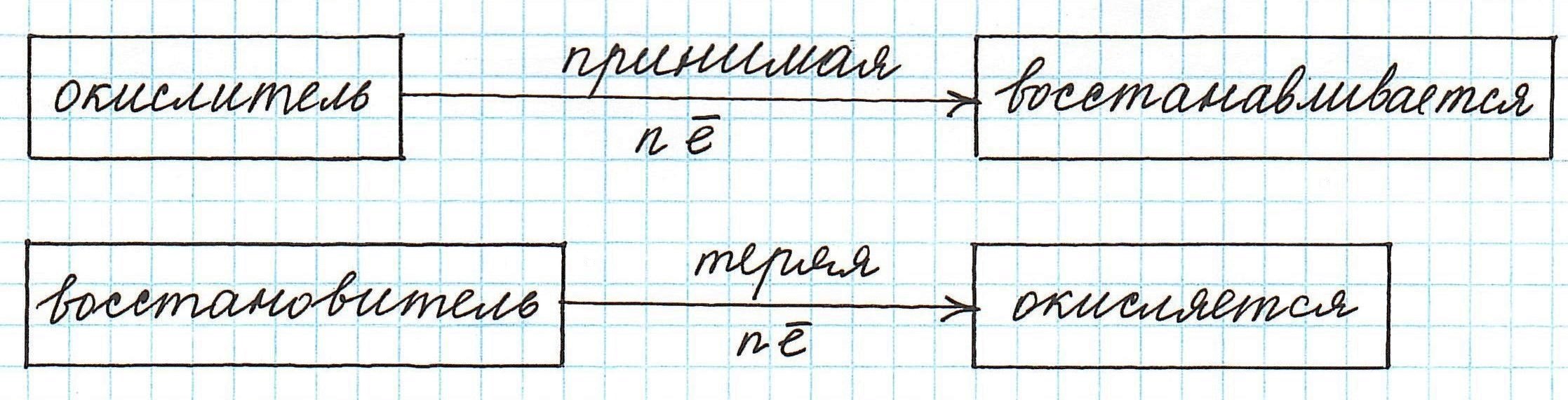
Частица, принимающая электроны, является окислителем.
Восстановление всегда сопровождается уменьшением степени окисления!
Способность к окислению и восстановлению: как определить
Существует несколько закономерностей, которые помогают определить наличие у частицы (атома, иона, молекулы) способности окисляться или восстанавливаться. Обратимся к периодической таблице химических элементов.
1) В периодах слева направо (т.е. с повышением порядкового номера элемента) восстановительные свойства простых веществ уменьшаются, а окислительные увеличиваются:
То есть в начале периода находятся явные восстановители, а в конце – окислители. Например, в III периоде активным восстановителем является натрий, а активным окислителем – хлор.
А причина данной закономерности кроется в строении атомов элементов.
У атомов элементов одного периода:
В связи с этим растет и сила притяжения электронов к ядру. В результате радиус атома уменьшается.
У элементов конца периода эта сила велика. Поэтому атомы очень трудно отдают свои электроны в химических взаимодействиях и легче принимают их от других атомов, стремясь завершить внешний энергетический уровень. Так проявляются их окислительные свойства.
Атомам элементов начала периода для завершения внешнего уровня до устойчивого 8-электронного состояния легче отдать свои немногочисленные электроны, проявив тем самым восстановительные свойства.
2) Элементы побочных подгрупп (это металлы четных рядов больших периодов) на внешнем уровне имеют 2 или 3 (реже 1 в случае «провала») электрона, поэтому легко могут их отдавать, являясь, таким образом, восстановителями:
3) Элементы одной главной подгруппы имеют одинаковое число электронов на внешнем энергетическом уровне (например, элементы VI группы – шесть электронов). Число же энергетических уровней увеличивается и, соответственно, радиусы атомов тоже увеличиваются. Это приводит к тому, что электроны внешних уровней удаляются от ядра и притяжение их к нему ослабевает.
Вот именно поэтому, восстановительная способность (способность отдавать электроны) у элементов главных подгрупп сверху вниз растет, а окислительная способность (способность принимать электроны) снижается:
Так, среди элементов главной подгруппы VI группы окислительная способность сильнее всего проявляется у кислорода, а теллур в некоторых взаимодействиях способен проявлять восстановительные свойства.
4) Определить, чем будет являться частица (или вещество, в состав которого она входит) в окислительно-восстановительном процессе, можно по значению степени окисления (с.о.).
Если атомы имеют самую наименьшую с.о., то проявят они восстановительные свойства. Если самую высокую – то окислительные. А если с.о. является промежуточной по значению, то проявят как те, так и другие свойства (в зависимости от конкретных условий химической реакции). Например:
Сильные или слабые окислители и восстановители: как определить
Часто говорят: сильный окислитель, слабый окислитель, сильный восстановитель, слабый восстановитель. А что это значит? И как определить эту самую силу?
Мерой окислительно-восстановительной способности вещества служит значение стандартного электродного потенциала: чем оно больше, тем и окислительные свойства проявляются сильнее.
Обратимся к таблице стандартных электродных потенциалов. В ней значения потенциалов расположены в порядке уменьшения:
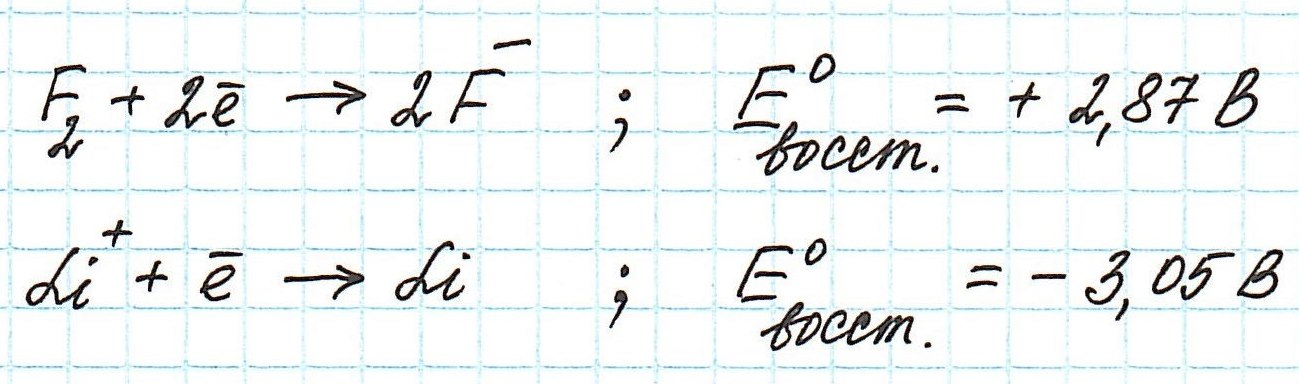
Окислительные потенциалы фтора и лития будут иметь противоположные значения.
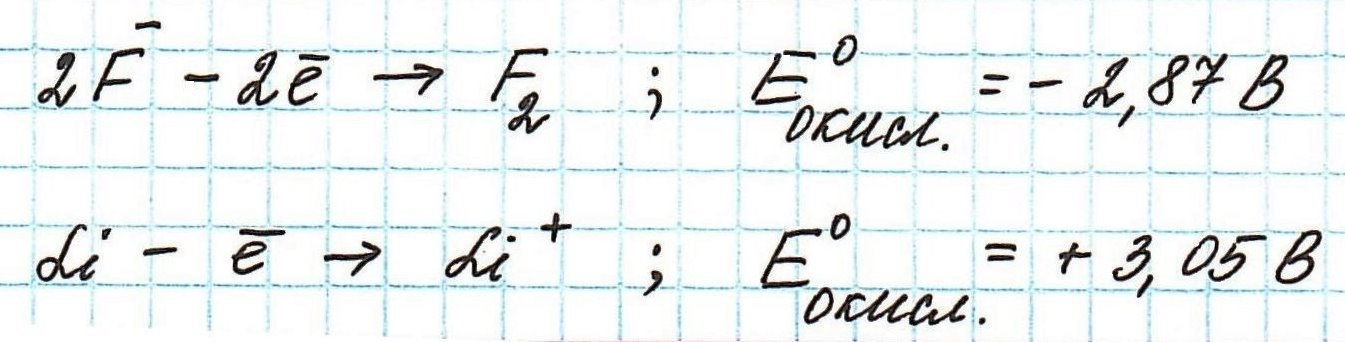
Пример . Используя таблицу стандартных электродных потенциалов, определите, какая из частиц проявляет более сильные окислительные свойства:
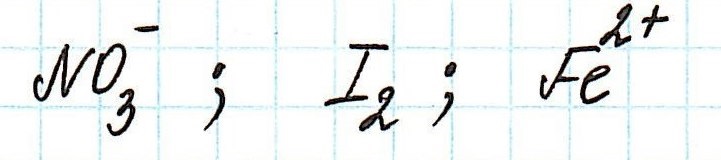
Наиболее сильным окислителем будет та частица, которая лучше всего восстанавливается, а, значит, имеет более высокий восстановительный электродный потенциал.
Сравним значения восстановительных потенциалов:
Таким образом, наиболее сильным окислителем из представленных является нитрат-ион.
Основные окислители и восстановители в химии
В технике применяется огромное количество окислителей и восстановителей с разной окислительной и восстановительной способностью.
Важнейшие из них представлены в таблице:
Итак, окисление и восстановление – два взаимосвязанных процесса. Они широко представлены в природе и играют огромную роль в промышленных производствах. Окислители и восстановители очень разнообразны. Чем будет являться частица (или вещество, в состав которого она входит): окислителем или восстановителем, – можно определить, используя некоторые закономерности.
Окислительно-восстановительные реакции
Окислительно-восстановительные реакции — это химические реакции, сопровождающиеся изменением степени окисления у атомов реагирующих веществ. При этом некоторые частицы отдают электроны, а некоторые получают.
Окислители и восстановители
Окислители — это частицы (атомы, молекулы или ионы), которые принимают электроны в ходе химической реакции. При этом степень окисления окислителя понижается. Окислители при этом восстанавливаются.
Восстановители — это частицы (атомы, молекулы или ионы), которые отдают электроны в ходе химической реакции. При этом степень окисления восстановителя повышается. Восстановители при этом окисляются.
Химические вещества можно разделить на типичные окислители, типичные восстановители, и вещества, которые могут проявлять и окислительные, и восстановительные свойства. Некоторые вещества практически не проявляют окислительно-восстановительную активность.
К типичным окислителям относят:
Типичные восстановители – это, как правило:
Большинство остальных веществ может проявлять как окислительные, так и восстановительные свойства.
Типичные окислители и восстановители приведены в таблице.
В лабораторной практике наиболее часто используются следующие окислители :
Классификация окислительно-восстановительных реакций
Окислительно-восстановительные реакции обычно разделяют на четыре типа: межмолекулярные, внутримолекулярные, реакции диспропорционирования (самоокисления-самовосстановления), и реакции контрдиспропорционирования.
C 0 + 4H N +5 O3(конц) = C +4 O2 ↑ + 4 N +4 O2 ↑+ 2H2O.
Внутримолекулярные реакции – это такие реакции, в которых разные элементы из одного реагента переходят в разные продукты, например:
Реакции диспропорционирования (самоокисления-самовосстановления) – это такие реакции, в которых окислитель и восстановитель – один и тот же элемент одного реагента, который при этом переходит в разные продукты:
3Br2 + 6 KOH → 5KBr + KBrO3 + 3 H2O,
Репропорционирование (конпропорционирование, контрдиспропорционирование ) – это реакции, в которых окислитель и восстановитель – это один и тот же элемент, который из разных реагентов переходит в один продукт. Реакция, обратная диспропорционированию.
Основные правила составления окислительно-восстановительных реакций
Окислительно-восстановительные реакции сопровождаются процессами окисления и восстановления:
Окисление — это процесс отдачи электронов восстановителем.
Восстановление — это процесс присоединения электронов окислителем.
В окислительно-восстановительных реакциях соблюдается электронный баланс: количество электронов, которые отдает восстановитель, равно количеству электронов, которые получает окислитель. Если баланс составлен неверно, составить сложные ОВР у вас не получится.
Используется несколько методов составления окислительно-восстановительных реакций (ОВР): метод электронного баланса, метод электронно-ионного баланса (метод полуреакций) и другие.
«Опознать» ОВР довольно легко — достаточно расставить степени окисления во всех соединениях и определить, что атомы меняют степень окисления:
Выписываем отдельно атомы элементов, меняющих степень окисления, в состоянии ДО реакции и ПОСЛЕ реакции.
Степень окисления меняют атомы марганца и серы:
Mn +7 + 1e = Mn +6
Марганец поглощает 1 электрон, сера отдает 2 электрона. При этом необходимо, чтобы соблюдался электронный баланс. Следовательно, необходимо удвоить число атомов марганца, а число атомов серы оставить без изменения. Балансовые коэффициенты указываем и перед реагентами, и перед продуктами!
Схема составления уравнений ОВР методом электронного баланса:
Внимание! В реакции может быть несколько окислителей или восстановителей. Баланс необходимо составить так, чтобы ОБЩЕЕ число отданных и полученных электронов было одинаковым.
Общие закономерности протекания окислительно-восстановительных реакций
Самый очевидный фактор, определяющий — среда раствора реакции — кислая, нейтральная или щелочная. Как правило (но не обязательно), вещество, определяющее среду, указано среди реагентов. Возможны такие варианты:
Среда протекания реакции позволяет определить состав и форму существования остальных продуктов ОВР. Основной принцип — продукты образуются такие, которые не взаимодействуют с реагентами!
Обратите внимание! Е сли среда раствора кислая, то среди продуктов реакции не могут присутствовать основания и основные оксиды, т.к. они взаимодействуют с кислотой. И, наоборот, в щелочной среде исключено образование кислоты и кислотного оксида. Это одна из наиболее частых, и наиболее грубых ошибок.
При увеличении температуры большинство ОВР, как правило, проходят более интенсивно и более глубоко.
Рассмотрим наиболее типичные лабораторные окислители.
Основные схемы окислительно-восстановительных реакций
Схема восстановления перманганатов
В составе перманганатов есть мощный окислитель — марганец в степени окисления +7. Соли марганца +7 окрашивают раствор в фиолетовый цвет.
Перманганаты, в зависимости от среды реакционного раствора, восстанавливаются по-разному.
3 K2S + 2 KMnO4 + 4 H2O = 2 MnO2↓ + 3 S↓ + 8 KOH,
Распространенной ошибкой в этой реакции является указание на взаимодействие серы и щелочи в продуктах реакции. Однако, сера взаимодействует с щелочью в довольно жестких условиях (повышенная температура), что не соответствует условиям этой реакции. При обычных условиях правильно будет указывать именно молекулярную серу и щелочь отдельно, а не продукты их взаимодействия.
При составлении этой реакции также возникают трудности. Дело в том, что в данном случае написание молекулы среды (КОН или другая щелочь) в реагентах не требуется для уравнивания реакции. Щелочь принимает участие в реакции, и определяет продукт восстановления перманганата калия, но реагенты и продукты уравниваются и без ее участия. Этот, казалось бы, парадокс легко разрешим, если вспомнить, что химическая реакция — это всего лишь условная запись, которая не указывает на каждый происходящий процесс, а всего лишь является отображением суммы всех процессов. Как определить это самостоятельно? Если действовать по классической схеме — баланс-балансовые коэффициенты-уравнивание металла, то вы увидите, что металлы уравниваются балансовыми коэффициентами, и наличие щелочи в левой части уравнения реакции будет лишним.
Перманганаты окисляют:
KMnO4 + неМе (низшая с.о.) = неМе 0 + другие продукты
KMnO4 + неМе (промежуточная с.о.) = неМе(высшая с.о.) + др. продукты
KMnO4 + Ме 0 = Ме (стабильная с.о.) + др. продукты
Схема восстановления хроматов/бихроматов
Соединения хрома VI окисляют:
Хромат/бихромат + неМе (отрицательная с.о.) = неМе 0 + другие продукты
Хромат/бихромат + неМе (промежуточная положительная с.о.) = неМе(высшая с.о.) + др. продукты
Хромат/бихромат + Ме 0 = Ме (стабильная с.о.) + др. продукты
Хромат/бихромат + P, As (отрицательная с.о.) = P, As +5 + другие продукты
Разложение нитратов
Например:
Активные металлы в природе встречаются в виде солей (KCl, NaCl).
Металлы средней активности чаще всего в природе встречаются в виде оксидов (Fe2O3, Al2O3 и др.).
Неактивные металлы в природе встречаются в виде простых веществ.
Некоторые исключения!
Разложение нитрата аммония :
При нагревании нитрат аммония разлагается. При температуре до 270 о С образуется оксид азота (I) («веселящий газ») и вода:
Результирующая степень окиcления азота — среднее арифметическое степени окисления атомов азота в исходной молекуле.
При более высокой температуре оксид азота (I) разлагается на простые вещества — азот и кислород :
При разложении нитрита аммония NH4NO2 также происходит контрдиспропорционирование.
Термическое разложение нитрата марганца (II) сопровождается окислением металла:
Нитрат железа (II) при низких температурах разлагается до оксида железа (II), при нагревании железо окисляется до степени окисления +3:
Нитрат никеля (II) разлагается до нитрита при нагревании до 150 о С под вакуумом и до оксида никеля при более высоких температурах (разложения нитрата никеля в ЕГЭ по химии не должно быть, но это не точно)).
Окислительные свойства азотной кислоты
Это связано с тем, что в составе кислоты есть очень сильный окислитель — азот в степени окисления +5. При взаимодействии с восстановителями — металлами образуются различные продукты восстановления азота.
Азотная кислота + металл = соль металла + продукт восстановления азота + H2O
Некоторые закономерности позволят верно определять основной продукт восстановления металлами азотной кислоты в реакции:
пассивация металлов — это перевод поверхности металла в неактивное состояние за счет образования на поверхности металла тонких слоев инертных соединений, в данном случае преимущественно оксидов металлов, которые не реагируют с концентрированной азотной кислотой
Для приближенного определения продуктов восстановления азотной кислоты при взаимодействии с разными металлами я предлагаю воспользоваться принципом маятника. Основные факторы, смещающие положение маятника: концентрация кислоты и активность металла. Для упрощения используем 3 типа концентраций кислоты: концентрированная (больше 30%), разбавленная (30% или меньше), очень разбавленная (меньше 5%). Металлы по активности разделим на активные (до алюминия), средней активности (от алюминия до водорода) и неактивные (после водорода). Продукты восстановления азотной кислоты располагаем в порядке убывания степени окисления:
Чем активнее металл, тем больше мы смещаемся вправо. Чем больше концентрация или меньше степень разбавления кислоты, тем больше мы смещаемся влево.
Взаимодействие металлов с серной кислотой
Например :
Концентрированная серная кислота взаимодействует с металлами, стоящими в ряду напряжений как до, так и после водорода.
H2SO4 (конц) + металл = соль металла + продукт восстановления серы (SO2, S, H2S) + вода
Основные принципы взаимодействия концентрированной серной кислоты с металлами:
1. Концентрированная серная кислота пассивирует алюминий, хром, железо при комнатной температуре, либо на холоду;
2. Концентрированная серная кислота не взаимодействует с золотом, платиной и палладием ;
3. С неактивными металлами концентрированная серная кислота восстанавливается до оксида серы (IV).
Cu 0 + 2H2 S +6 O4(конц) = Cu +2 SO4 + S +4 O2 + 2H2O
4. При взаимодействии с активными металлами и цинком концентрированная серная кислота образует серу S либо сероводород H2S 2- (в зависимости от температуры, степени измельчения и активности металла).
Пероксид водорода
При взаимодействии с окислителями перекись окисляется до молекулярного кислорода (степень окисления 0): O2. Например :