Соляная кислота как читается
Описание соляной кислоты: формула, свойства и применение
Кислоты – это химические соединения способные отдавать протон или принимать электронную пару с образованием ковалентной связи. Данный класс веществ имеет различные классификации: по числу атомов водорода, по происхождению, по силе. Соляная кислота является сильной, одноосновной неорганической кислотой.
Формула и другие названия соляной кислоты
В состав соляной кислоты входят два химических элемента: хлор и водород. Данная кислота состоит из двух атомов и имеет формулу: HCl. Стоит отметить, что соляная кислота – это тривиальное название (т.е. название, применяемое в обиходной речи химиков, не отражающее состава). По международной номенклатуре ИЮПАК вещество с формулой HCl принято называть хлороводородной кислотой. Иногда HCl называют хлористоводородной кислотой или хлористым водородом, также приемлемо название – хлорид водорода.
Физические свойства
Физические свойства HCl коррелируют с концентрацией данного соединения в растворе. Для того, чтобы не перегружаться цифрами, рассмотрим физические свойства хлористого водорода на примере его концентрированной формы (около 36%):
Химические свойства
Химические свойства хлорида водорода можно подразделить на общие (характерные для всех соединений, основным свойство которых является отдача протона) и специфические (характерные только для HCl). Общие свойства:
Специфические свойства соляной кислоты:
Получение соляной кислоты
Промышленный способ получения хлористого водорода заключается в горении водорода в хлоре и последующим растворением образовавшегося вещества в воде. Существует и другой способ получения хлороводородной кислоты, применяемый в лабораторных условиях. Суть способа заключается в реакции поваренной соли(NaCl) с концентрированно серной кислотой при нагревании. В результате получаются следующие соединения: гидросульфат натрия и хлорид водорода, если провести химическое взаимодействие между образовавшимися продуктами, то образуется сульфат натрия и 2 молекулы хлористого водорода. Приведем общее уравнение реакции: 2NaCl + H2SO4 = Na2SO4 + 2HCl.
Области применения
Хлорид водорода является ключевым реагентом в химической промышленности, однако данное соединение нашло себе применение во многих отраслях человеческого деятельности.
В химической промышленности
В химической промышленности хлористый водород применяют для синтез хлорорганических соединений, а хлорсодержащих солей различных металлов.
В металлургии
В металлургии HCl используется с целью очистки металла после лужения (процесса нанесения олова с целью защиты металла от коррозии).
В пищевой промышленности
33% раствор HCl активно применяют в пищевом производстве в качестве регулятора pH, предназначенного для очистки воды.
В быту
В домохозяйстве HCl используют в составе моющих, хлорсодержащих средств.
В сельском хозяйстве
В сельскохозяйственной деятельности HCl применяется в составе хлорорганических веществ, которые используются в качестве органических ядохимикатов.
В медицине
В медицинской практике применяют слабые растворы хлористого водорода с целью улучшения пищеварения.
В строительстве
В строительстве HCl используют для очистки красного кирпича от грязи. Также использование растворов HCl повышает морозостойкость и влагостойкость бетонных конструкций, что способствует постройке более долгоживущих зданий.
Интересные факты
Приведем ряд фактов о хлороводородной кислоте, которые удивят обывателя:
Соляная Кислота
Химическое название
Химические свойства
Хлороводородная кислота, хлористый водород или хлористоводородная кислота – раствор НСl в воде. Согласно Википедии, вещество относят у группе неорганических сильных одноосновных к-т. Полное название соединения на латинском: Hydrochloricum acid.
Химические свойства Соляной Кислоты. С чем реагирует Соляная Кислота? Вещество вступает во взаимодействие с металлами, которые стоят в ряду электрохимических потенциалов перед водородом (железо, магний, цинк и другие). При этом образуются соли и выделяется газообразный H. С Соляной Кислотой не реагирует свинец, медь, золото, серебро и другие металлы правее водорода. Вещество вступает в реакцию с оксидами металлов, при этом образуя воду и растворимую соль. Гидроксид натрия под действием к-ты образует хлорид натрия и воду. Реакция нейтрализации характерна для данного соединения.
Разбавленная Соляная Кислота реагирует с солями металлов, которые образованы более слабыми к-ами. Например, пропионовая кислота слабее, чем соляная. Вещество не взаимодействует с более сильными кислотами. Карбонат кальция и карбонат натрия будут образовывать после реакции с HCl хлорид, угарный газ и воду.
Для химического соединения характерны реакции с сильными окислителями, с диоксидом марганца, перманганатом калия: 2KMnO4 + 16HCl = 5Cl2 + 2MnCl2 + 2KCl + 8H2O. Вещество реагирует с аммиаком, при этом образуется густой белый дым, который состоит из очень мелких кристаллов хлорида аммония. Минерал пиролюзит с Соляной Кислотой также вступает в реакцию, так как содержит диоксид марганца: MnO2+4HCl=Cl2+MnO2+2H2O (реакция окисления).
Существует качественная реакция на хлороводородную кислоту и ее соли. При взаимодействии вещества с нитратом серебра выпадает белый осадок хлорида серебра и образуется азотная к-та. Уравнение реакции взаимодействия метиламина с хлористым водородом выглядит следующим образом: HCl + CH3NH2 = (CH3NH3)Cl.
Вещество реагирует со слабым основанием анилином. После растворения анилина в воде к смеси прибавляют Соляную Кислоту. В результате основание растворяется и образует солянокислый анилин (хлорид фениламмония): (С6Н5NH3)Cl. Реакция взаимодействия карбида алюминия с хлористоводородной к-ой: Al4C3+12HCL=3CH4+4AlCl3. Уравнение реакции карбоната калия с к-той выглядит следующим образом: K2CO3 + 2HCl = 2KCl + H2O + CO2.
Получение соляной кислоты
Чтобы получить синтетическую Соляную Кислоту сжигают водород в хлоре, а затем полученный газообразный хлороводород растворяется в воде. Также распространено производство реактива из абгазов, которые образуются в виде побочных продуктов при хлорировании углеводородов (абгазная Соляная Кислота). При производстве данного химического соединения применяют ГОСТ 3118 77 – на реактивы и ГОСТ 857 95 – для технической синтетической хлористоводородной кислоты.
В лабораторных условиях можно применять давний способ, при котором поваренная соль подвергается действию концентрированной серной к-ты. Также средство можно получить с помощью реакции гидролиза хлорида алюминия или магния. Во время реакции могут образоваться оксихлориды переменного состава. Для определения концентрации вещества применяют стандарт титры, которые выпускаются в запаянных ампулах, чтобы в последствии можно было получить стандартный раствор известной концентрации и использовать его для определения качества другого титранта.
У вещества имеется достаточно широкая область применения:
Данное химическое соединение имеет высокий класс опасности – 2 (по ГОСТу 12Л.005). При работе с кислотой требуется спец. защита кожи и глаз. Достаточно едкое вещество при попадании на кожу или в дыхательные пути вызывает химические ожоги. Для ее нейтрализации применяют растворы щелочи, чаще всего – питьевую соду. Пары хлороводорода образуют с молекулами воды в воздухе едкий туман, который раздражает дыхательные пути и глаза. Если вещество вступает в реакцию с хлорной известью, перманганатом калия и прочими окислителями, то образуется токсичный газ — хлор. На территории РФ ограничен оборот Соляной Кислоты с концентрацией более 15%.
Фармакологическое действие
Повышает кислотность желудочного сока.
Фармакодинамика и фармакокинетика
Что такое кислотность желудочного сока? Это характеристика концентрации Соляной Кислоты в желудке. Кислотность выражается в рН. В норме в составе желудочного сока должна вырабатываться кислота и принимать активное участие в процессах пищеварения. Формула хлороводородной кислоты: HCl. Ее продуцируют париетальные клетки, расположенные в фундальных железах, с участием Н+/К+-АТФазы. Эти клетки выстилают дно и тело желудка. Кислотность желудочного сока сама по себе изменчива и зависит от числа париетальых клеток и интенсивности процессов нейтрализации вещества щелочными компонентами желудочного сока. Концентрация продуцируемой к-ты стабильна и равняется 160 ммоль/л. У здорового человека в норме должно вырабатываться не более 7 и не менее 5 ммоль вещества в час.
При недостаточной или избыточной выработке Соляной Кислоты возникают заболевания пищеварительного тракта, ухудшается способность усваивать некоторые витамины и микроэлементы, например, железо. Средство стимулирует выделение желудочного сока, снижает рН. Активирует пепсиноген, переводит его в активный фермент пепсин. Вещество благоприятно воздействует на кислотный рефлекс желудка, замедляет переход не до конца переваренной пищи в кишечник. Замедляются процессы брожения содержимого пищеварительного тракта, исчезает боль, изжога и отрыжка, лучше усваивается железо.
После приема внутрь средство частично метаболизируется слюной и желудочной слизью, содержимым 12-перстной кишки. Несвязанное вещество проникает в 12-перстную кишку, где полностью нейтрализуется ее щелочным содержимым.
Показания к применению
Вещество входит в состав синтетических моющих средств, концентрата для полоскания ротовой полости ухода за контактными линзами. Разбавленная Соляная Кислота назначается при заболеваниях желудка, сопровождающихся пониженной кислотностью, при гипохромной анемии в сочетании с препаратами железа.
Противопоказания
Лекарство нельзя применять при аллергии на синтетическое вещество, при болезнях пищеварительного тракта, ассоциированных с повышенной кислотностью, при остром гастрите.
Побочные действия
Концентрированная Соляная Кислота при попадании на кожу, в глаза и дыхательные пути может вызывать сильные ожоги. В составе различных лек. препаратов используют разбавленное вещество, при длительном применении больших дозировок может возникнуть ацидоз, ухудшение состояния эмали зубов.
Инструкция по применению (Способ и дозировка)
Хлороводородную кислоту применяют в соответствии с инструкцией.
Внутрь лекарство назначают, предварительно растворив в воде. Обычно используют 10-15 капель препарата на пол стакана жидкости. Лекарство принимают во время еды, 2-4 раза в день. Максимальная разовая дозировка составляет 2 мл (около 40 капель). Суточная доза – 6 мл (120 капель).
Передозировка
Случаи передозировки не описаны. При бесконтрольном приеме вещества внутрь в больших количествах возникают язвы и эрозии в пищеварительном тракте. Следует обратиться за помощью к врачу.
Взаимодействие
Вещество часто используют в комбинации с пепсином и прочими лек. препаратами. Химическое соединение в пищеварительном тракте вступает во взаимодействие с основаниями и некоторыми веществами (см. химические свойства).
Особые указания
При лечении препаратами Соляной Кислоты необходимо четко придерживаться рекомендаций в инструкции.
О соляной кислоте
Соляная кислота – это прозрачная бесцветная или желтоватая жидкость без взвешенных или эмульгированных частиц
Соляная кислота представляет собой раствор газообразного хлористого водорода HCl в воде. Последний представляет собой гигроскопичный бесцветный газ с резким запахом. Обычно употребляемая концентрированная соляная кислота содержит 36 – 38% хлористого водорода и имеет плотность 1, 19 г/см3. Такая кислота дымит на воздухе, так как из неё выделяется газообразный HCl; при соединении с влагой воздуха образуются мельчайшие капельки соляной кислоты. Она является сильной кислотой и энергично взаимодействует с большинством металлов. Однако такие металлы, как золото,платина, серебро, вольфрам и свинец, соляной кислотой практически не травятся. Многие недрагоценные металлы, растворяясь в кислоте, образуют хлориды, например цинк:
Чистая кислота бесцветна, а техническая имеет желтоватый оттенок, вызванный следами соединений железа, хлора и других элементов (FeCl3). Часто применяют разбавленную кислоту, содержащую 10% и меньше хлористого водорода. Разбавленные растворы не выделяют газообразного HClи не дымят ни в сухом, ни во влажном воздухе.
Применение соляной кислоты
Соляная кислота широко используется в промышленности при извлечении металлов из руд, травлении металлов и т. д. Также она используется при изготовлении паяльной жидкости, при осаждении серебра и как составная частьцарской водки.
Масштабы применения соляной кислоты в промышленности меньше, чем азотной. Связано это с тем, что соляная кислота вызывает коррозию стальной аппаратуры. К тому же летучие пары её довольно вредны и также вызывают коррозию металлических изделий. Это нужно учитывать при хранении соляной кислоты. Хранят и перевозят соляную кислоту в гуммированных цистернах и бочках, т.е. в сосудах, внутренняя поверхность которых покрыта кислотостойкой резиной, а также в стеклянных бутылях и полиэтиленовой посуде.
Соляная кислота применяется для получения хлоридов цинка, марганца, железа и других металлов, а также хлористого аммония. Соляную кислоту применяют для очистки поверхностей металлов, сосудов, скважин от карбонатов, окислов и других осадков и загрязнений. При этом используют специальные добавки — ингибиторы, которые защищают металл от растворения и коррозии, но не задерживают растворение окислов, карбонатов и других подобных соединений.
HCl применяется в промышленном производстве синтетических смол, каучуков. Используется как сырьё в производстве хлористого метила из метилового спирта, хлористого этила из этилена, хлорвинила из ацетилена.
Отравление соляной кислотой
HCl ядовит. Отравления происходят обычно туманом, образующимся при взаимодействии газа с водяными парами воздуха. HCl поглощается также на слизистых оболочках с образованием кислоты, вызывающей их сильное раздражение. При длительной работе в атмосфере HCl наблюдаются катары дыхательных путей, разрушение зубов, изъязвление слизистой оболочки носа, желудочно-кишечные расстройства. Допустимое содержание HCl в воздухе рабочих помещений не более 0, 005 мг/л. Для защиты используют противогаз, защитные очки, резиновые перчатки, обувь, фартук.
В то же время, наше пищеварение невозможно без соляной кислоты, её концентрация в желудочном соке достаточно высока. Если в организме кислотность понижена, то пищеварение нарушается, и врачи прописывают таким больным приём соляной кислоты перед началом еды.
Применение в быту соляной кислоты
Концентрированная «солянка» смешивается с водой в любой пропорции для бытовых нужд. Сильный раствор этой неорганической кислоты без труда очищает фаянсовую сантехнику от известкового налета и ржавчины, а более слабым можно убрать с тканей пятна ржавчины, чернил, ягодного сока.
Если приглядитесь, на средстве для чистки унитазов «Туалетный утенок» написано, что в состав сходит соляная кислота, поэтому работать с ним нужно в резиновых перчатках и беречь глаза от попадания в них брызг.
Кроме того, без этой кислоты немыслима жизнь ни одного человека – она содержится в желудке и именно благодаря ей пища, попавшая в желудок, растворяется (переваривается).
К тому же, эта кислота служит первым барьером от болезнетворных бактерий, попавших в желудок – они погибают в кислой среде.
Ну а людям, страдающим от гастрита с повышенной кислотностью, эта кислота тоже хорошо знакома. Они даже уменьшают ее действие, чтобы она не разрушала стенки желудка, с помощью специальных препаратов, которые взаимодействуют с ней и уменьшают ее концентрацию.
Самые популярные – это препараты, содержащие оксиды магния и алюминия, например, «Маалокс». Впрочем, есть и экстремальщики, которые пьют пищевую соду, хотя уже доказано, что это приводит лишь к временному облегчению.
Соляная кислота – полное руководство
Определение
Соляная кислота представляет собой едкую кислоту, образующуюся при растворении хлористого водорода (HCl) в воде, и, следовательно, представляет собой водный галогеноводород. решение, Соляная кислота используется в различных отраслях промышленности в качестве моющего, травильного или регулирующего pH раствора, а также содержится в разбавленном виде в желудочном соке. Хлористый водород иногда называют соляной кислотой, хлористым гидронием, хлораном, солями или кислотами.
В промышленности
Промышленное использование соляной кислоты охватывает широкий спектр отраслей. Это важный ингредиент в готовых промышленных товарах, таких как поливинилкарбонат (ПВХ), бисфенол А (БФА) и дихлорид этилена (ДХЭ). BPA используется в производстве поликарбонатных пластиков и эпоксидных смол, но является источником угрозы для здоровья из-за канцерогенных эффектов. По этой причине многие пластмассы в настоящее время производятся и рекламируются как продукты без BPA. Все эти органические соединения вносят свой вклад в промышленность пластмасс и в качестве лабораторных растворителей, но могут быть очень канцерогенными.
Подготовка металла для дальнейшего производства включает один из двух аналогичных процессов: травление и пассивацию. В то время как пассивация дает более легкий эффект, используя слегка едкие кислоты для удаления загрязнений, оставшихся в процессе производства металла, защиты металла от загрязнений, выравнивания поверхности и увеличения долговечности, травление приводит к более сильному эффекту благодаря использованию сильной кислоты. Эта кислота обычно является хлористым водородом. Металлы, обработанные в хлористо-водородных ваннах, называются травленными металлами HCl.
Соляная кислота часто используется на одном этапе обработки кожи в кожевенных кожевенных заводах. Дубление кожи включает введение соли хрома, чтобы изменить коллагеновую сеть внутри и, таким образом, избежать окрашивания в будущем. Во время этого процесса соли хрома добавляют в ванну с pH от 2,5 до 3 вместе с хлоридом натрия. Это стадия травления. Затем хром прикрепляется к шкуре, что повышает рН и так называется стадией подщелачивания. Для достижения низкого уровня pH на стадии травления необходим хлористый водород.
Другое использование хлористого водорода в промышленности – это производство неорганических соединений, таких как полиалюминийхлорид (ПАУ), хлорид железа (III) (трихлорид железа) и хлоргидрат алюминия. Использование хлористого водорода необходимо в начале процессов производства этих соединений, например, добавление 20% HCl и серная кислота боксит для производства PAC. Соли алюминия используются в косметической промышленности (например, в дезодорантах-антиперспирантах) или в фазах химической коагуляции и флокуляции питьевой и сточной воды, где добавленные катионы алюминия (или железа) нейтрализуют заряд коллоидных частиц загрязняющих веществ и позволяют им соединяться, образуя хлопьями (хлопьями) их можно откачивать.
HCl также используется для «очистки» соли, используемой в производстве пищевых продуктов и на наших столах. В насыщенном растворе NaCl существует постоянное равновесие между отдельными положительными ионами натрия и отрицательного хлорида и неионизированным NaCl. Пропуская газообразный HCl через этот раствор, он диссоциирует с образованием ионов H + и Cl-. Поскольку хлорид-ион является общим как для хлорида натрия, так и для хлористого водорода, его концентрация увеличивается и создает сдвиг в соответствии с принципом Ле-Шателье. Это значит, что доступные ионы натрия, более вероятно, свяжутся со свободно доступным хлоридом с увеличенными отложениями NaCl в результате, Этот процесс называется очисткой соли. В качестве альтернативы, вы можете добавить соляную кислоту к гидроксиду натрия (NaOH) или карбонату натрия (Na2Co3), и обе реакции приведут к образованию соли хлорида натрия.
Естественно, сильная кислота, такая как хлористый водород, также используется для регулирования кислотности широкого спектра растворов, используемых в фармацевтических продуктах, в пищевых добавках, включая фруктозу, лимонную кислоту и гидролизованный растительный белок, в щелочных отходах и в нашей питьевой воде. вода.
Соляная кислота также используется для увеличения добычи нефти в нефтяных скважинах. При закачке в основную породу образуются более крупные поры, способные транспортировать больше нефти в скважину. Это лишь некоторые из наиболее распространенных видов использования соляной кислоты в промышленности.
Использование соляной кислоты в домашних условиях ограничено более низкими концентрациями, которые являются менее коррозийными, но все же обладают замечательными характеристиками очистки и регулирования pH. Те, у кого есть плавательные бассейны, могут попробовать раствор из 10 частей воды в 1 части HCl, чтобы удалить пятна от раствора.
Тот же раствор удалит пятна с металлов и, следовательно, используется в продуктах, которые продаются для очистки железа, меди, латуни и других металлов. Эффекты аналогичны травлению стали, окислению поверхностных слоев для удаления пятен и загрязнений. Большинство кислот, включая хлористый водород, также удаляют известковые отложения, но следует обратить внимание на используемую концентрацию. Большинство мощных моющих средств, которые мы используем в домашних условиях, содержат HCl. Если вы пролили соляную кислоту на деликатную поверхность, добавьте пасту из бикарбоната соды и воды, чтобы нейтрализовать ее; подготовьте его и держите под рукой, чтобы избежать максимального повреждения.
Реакции кислотных оснований часто используются для создания реакции шипения, которая, как говорят, увеличивает мощность кислотного моющего средства; однако вы ускоряете реакцию только путем добавления щелочи, где в идеале добавленная кислота должна работать, чтобы нейтрализовать щелочи на грязной поверхности. Соляная кислота будет реагировать с большинством карбонатов и металлов, таких как карбонат кальция, с образованием хлорида кальция, диоксида углерода и воды или с магнием, который образует хлорид магния, диоксид углерода и воду.
В человеческом теле
желудок является местом ранних стадий пищеварения, но играет аналогичную важную роль, когда потенциальные патогенные микроорганизмы, которые могли проглатываться, устраняются из-за сильно кислой среды между 1,5-3,5 рН. Этот уровень кислотности является результатом производства хлористого водорода в желудке,
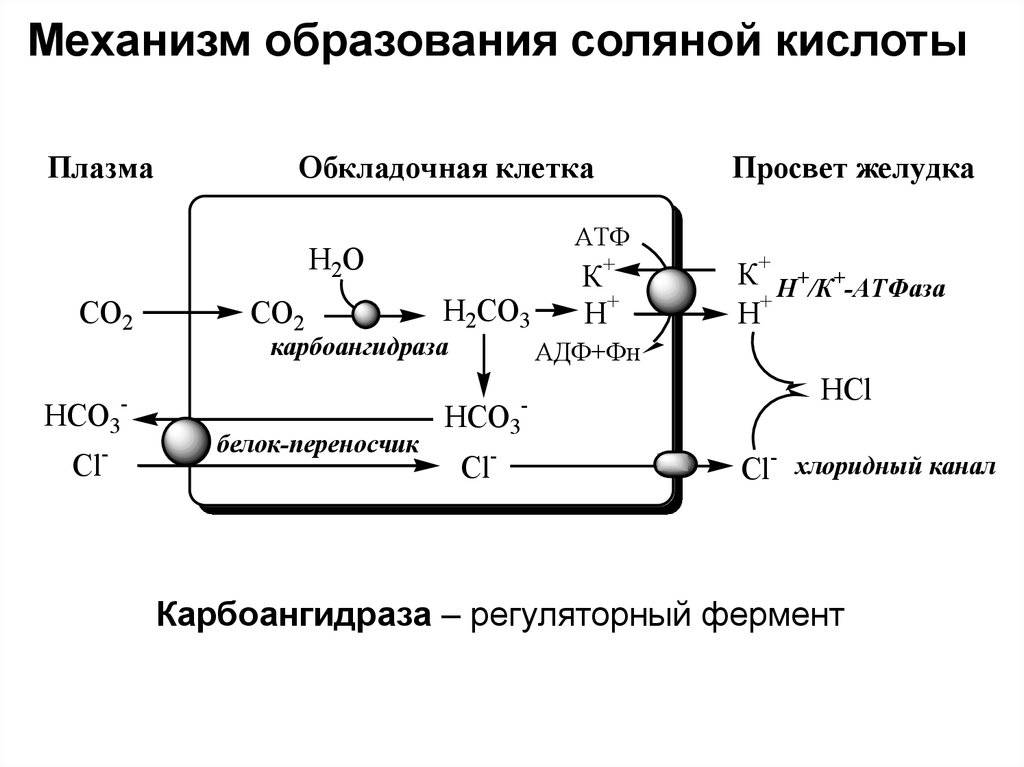
В организме человека HCl вырабатывается париетальными клетками слизистой оболочки желудка. Теменной клетка цитоплазма в сочетании с водой и углекислым газом для производства углекислоты. Фермент карбоангидразы превращает один ион угольной кислоты в один ион водорода (H +) и один ион бикарбоната (HCO3–). Ион водорода транспортируется в желудок через канал H + – K + ATPase, обменивая положительные внеклеточные ионы калия с положительными внутриклеточными ионами водорода. В то же время бикарбонат-ионы переносятся из клетки в кровь через анионит, который обменивает бикарбонат-ионы на отрицательные ионы хлора. Париетальные клетки также имеют хлоридные каналы в своих мембранах. Отрицательные хлорид-ионы переносятся в желудок при повышении внутриклеточной концентрации.
Организм человека может регулировать выработку соляной кислоты за счет непроизвольной стимуляции нейронов, в первую очередь во время стимуляции блуждающего нерва, когда пища видна или разжевана. Когда пища достигает желудка, а желудок растягивается, результирующие нервные импульсы также стимулируют блуждающий нерв, чтобы вырабатывать больше ацетилхолина, который увеличивает секрецию, такую как слюна и желудочный сок, и дает больше энергии для перистальтики кишечника. Третий и основной метод секреция гастрина из G-клеток слизистой оболочки желудка, аналогично активируемых блуждающим нервом, но также и пептидами, продуцируемыми желудком, такими как связанный с гастрином пептид. Гастрин гормон который проходит через кровь к теменным клеткам, где они связываются с гормонами холецистокинина (CKK) посредством CKKB-рецепторов и является частью кишечника.головной мозг ссылка, которая контролирует сытость и аппетит.
С увеличением производства гастрина и ацетилхолина происходит еще одна реакция в виде высвобождения гистамина из энтерохромаффиноподобных клеток (клеток ECL), которые лежат рядом с париетальными клетками в слизистой оболочке желудка. Этот гистамин связывается с рецепторами париетальных клеток, стимулируя их вырабатывать больше желудочной кислоты.
В войне
Использование соляной кислоты в военных действиях чаще всего связано с производством и последствиями горчичный газ или серная горчица, используемая в траншейной войне во время Первой мировой войны, все же он был недавно использован в гражданской войне в Сирии, хотя Конвенция о химическом оружии запрещала его использование в 1993 году. Обычно не смертельно, если воздействие не происходит в высоких концентрациях через регулярные промежутки времени, этот взрывчатый агент атакует кожа и слизистые оболочки дыхательных путей и пищеварительного тракта, вызывающие ожоги, отеки, раздражение и гнойные пузыри. Горчичный газ также вызывает мутации в ДНК и является известным канцерогеном. Противоядия нет.
Используются различные методы производства иприта, но только один из них – метод Мейера-Кларка – использует концентрированную соляную кислоту.
Другим газом, используемым в войне, является фосген, имеющий формулу COCl2. В отличие от горчичного газа со слегка зеленовато-желтым оттенком, фосген бесцветен и пахнет свежескошенным сеном. Это результат угарного газа, активированного угля и газообразного хлора. Соляная кислота не используется в производстве фосгена, но создается в присутствии воды, Вода в большом количестве содержится в слизистых оболочках. Это означает, что при вдыхании или проглатывании фосгена он превращается в углекислую и соляную кислоту. В то время как горчичный газ привел к ряду смертельных случаев, говорится, что по меньшей мере 80 000 человек погибло в результате Первой мировой войны из-за более резких и непосредственных последствий фосгена. Это примерно 85% всех смертей, связанных с химической войной, за этот период.
Соляная кислота Факты
Хлористый водород – это соединение, состоящее из соотношения водорода и хлора один к одному., Без присутствия молекул воды хлористый водород является бесцветным, но токсичным газом. При добавлении воды водород высвобождает многие из своих молекул водорода с образованием сильнокислого раствора. Чуть более 97% молекулярной массы HCl приходится на один хлорид-ион. Этот хлорид-ион имеет атомную массу 35,543, а ион водорода – атомную массу 1,00794. Поскольку имеется только один атом каждого, молярная масса HCl рассчитывается путем сложения этих двух цифр – 36,46094 г / моль. Как уже упоминалось, формулой хлористого водорода является HCl.
В случае молекулярной массы результаты зависят от количества молей HCl. Например, в растворе, где имеется достаточное количество атомов хлористого растворенного газа (Cl2) для числа атомов молекулярного водорода (H2), мы можем с уверенностью сказать, что 4 моля HCl будут давать 4,00 моль HCl.
Используя уравнение Масса HCl = Моль HCl х Молярная масса HCl, мы можем определить, что 4,00 моль х 36,46 г моль-1 составляет 146 г.
Работа с соляной кислотой – MSDS Совет
Соляная кислота едкая; концентрированные формы также выделяют токсичный кислотный туман. Если кислота или туман попали на кожу, глаза или внутренних органов, любое повреждение может быть необратимым или, возможно, смертельным исходом. Хотя HCl не классифицируется как канцероген, его промышленное использование требует средств индивидуальной защиты такие как респиратор, резиновые перчатки и ботинки, а также защитная маска. Кроме того, любые помещения, в которых используется соляная кислота, должны иметь доступ к системе для промывки глаз. Даже при уборке в домашних условиях разбавленными средствами брызги на глаза или кожу могут вызвать ожоги.
Рекомендации MSDS для контакта соляной кислоты с кожей состоят в том, чтобы промыть область в течение не менее 15 минут и удалить все предметы одежды, которые попали в раствор. Там, где видны ожоги, рекомендуется мытье антибактериальным мылом или антибактериальным кремом, а также посещение медицинского центра. При контакте с глазами необходима промывочная система, которая промывает пораженный глаз не менее 15 минут и требует медицинской помощи.
Прием внутрь соляной кислоты любой концентрации может вызвать ожоги полости рта, горла и пищевод, Хотя желудочный сок очень кислый, он остается в резервуаре желудка. Расстройство желудка, вызванное ростом желудочной кислоты в нижнюю часть пищевода, может вызвать эзофагит Барретта и увеличить риск развития рака пищевода. Распространенным расстройством желудочно-кишечного тракта является гастроэзофагеальная рефлюксная болезнь или ГЭРБ, Изображение ниже показывает признаки и симптомы этого часто болезненного патология, При проглатывании HCl важно не рвать, а немедленно обратиться за медицинской помощью. Вдыхание тумана HCl также требует посещения отделения неотложной помощи.
викторина
1. Какие из следующих органических соединений выводятся из производства пластмасс?A. фосгенB. BPAC. Серная кислотаD. HCl
Ответ на вопрос № 1
В верно. BPA или бисфенол А является канцерогенным средством, используемым при производстве пластмасс и смол. Многие пластики в настоящее время не содержат БФА, и эта тенденция, безусловно, будет продолжаться.
2. Что вы должны сначала сделать, если вы принимаете хлористый водород?A. Пить много водыB. рвотноеC. Пьют бикарбонатный растворD. Обратиться за медицинской помощью
Ответ на вопрос № 2
D верно. Питьевая вода обеспечивает дополнительные молекулы водорода и может повысить уровень кислотности, но, что более важно, будет только сбрасывать кислоту дальше в пищевод и увеличивать поврежденную площадь поверхности. Рвота повышает кислотность благодаря присутствию желудочной кислоты. Бикарбонатные или щелочные продукты будут вызывать летучую реакцию, возможно, через желудочно-кишечный тракт. Медикаментозное лечение имеет важное значение при вмешательствах, начиная от промывания желудка и заканчивая интубацией и переводом в реанимацию.
3. Где происходит коагуляция и флокуляция с точки зрения HCl?A. Травление металловB. Очистка водыC. Лечение ожоговD. Очистка соли
Ответ на вопрос № 3
В верно. Коагуляция и флокуляция загрязняющих веществ в воде позволяют легче удалять их, обеспечивая меньше загрязненной воды.
4. Какие клетки продуцируют гастрин?A. Теменные клеткиB. Т-клеткиC. G клеткиD. Клетки ECL
Ответ на вопрос № 4
С верно. Клетки ECL продуцируют гистамин, T-клетки участвуют в иммунитете, париетальные клетки выделяют ионы водорода и хлора и внутренний фактор. Буква G указывает нам правильное направление – клетки G вырабатывают гастрин.
5. Какой черепной нерв наиболее вовлечен в регуляцию выработки желудочного сока?A. Блуждающий нервB. Похищает нервC. Гипоглоссальный нервD. Окуломоторный нерв
Ответ на вопрос № 5
верно. И похищение, и глазодвигательные нервы играют роль в движении глаз. Подъязычный нерв контролирует язык. Блуждающий нерв необходим для множества нервных путей, которые заканчиваются в широком диапазоне внутренних органов, таких как сердце, пищеварительная система и легкие.