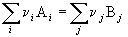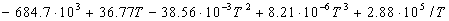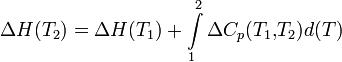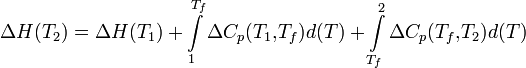Стандартная энтальпия как найти
Энергетика химических процессов. Закон Гесса
Материалы портала onx.distant.ru
Тепловой эффект процесса
Количество выделенной (или поглощенной) теплоты Q в данном процессе называют тепловым эффектом процесса. Экзотермической является реакция, протекающая с выделением теплоты, а эндотермической – с поглощением теплоты из окружающей среды.
Для лабораторных и промышленных процессов наиболее типичен изобарный режим (Р=const). Поэтому обычно рассматривают тепловой эффект при Р,Т = const, т.е. изменение энтальпии процесса ΔН.
Следует отметить, что абсолютные значения энтальпии Н определить не представляется возможным, так как не известна абсолютная величина внутренней энергии.
Для экзотермической реакции (Q > 0) ΔН 0.
Термохимические уравнения
Химические уравнения, в которых дополнительно указывается величина изменения энтальпии реакции, а также агрегатное состояние веществ и температура, называются термохимическими уравнениями.
В термохимических уравнениях отмечают фазовое состояние и аллотропные модификации реагентов и образующихся веществ: г – газообразное, ж – жидкое, к – кристаллическое; S(ромб), S(монокл), С(графит), С(алмаз) и т.д.
Важно подчеркнуть, что с термохимическими уравнениями можно проводить алгебраические операции сложения, вычитания, деления, умножения.
Закон Гесса
Изменение энтальпии (внутренней энергии) химической реакции зависит от вида, состояния и количества исходных веществ и продуктов реакции, но не зависит от пути процесса.
Следствия из закона Гесса
Стандартные термодинамические величины
Стандартные термодинамические величины – это такие величины, которые относятся к процессам, все ингредиенты которых находятся в стандартных состояниях.
Стандартным состоянием вещества, находящегося в конденсированной фазе (кристаллической или жидкой), является реальное состояние вещества, находящегося при данной температуре и давлении 1 атм.
Следует подчеркнуть, что стандартное состояние может иметь место при любой температуре.
Обычно тепловой эффект (изменение энтальпии) реакции приводится для температуры 25 о С (298,15 К) и давления 101,325 кПа (1 атм), т.е. указывается стандартная энтальпия ΔН о 298.
Стандартные энтальпии образования и сгорания
Стандартная энтальпия образования ΔН о f,298 (или ΔН о обр,298) – это изменение энтальпии в процессе образования данного вещества (обычно 1 моль), находящегося в стандартном состоянии, из простых веществ, также находящихся в стандартном состоянии, причем простые вещества присутствуют в наиболее термодинамически устойчивых состояниях при данной температуре.
при Т = 298,15 К и Р = 1 атм.
Стандартная энтальпия образования простых веществ равна нулю по определению (для наиболее устойчивых их модификаций при данной температуре).
Стандартной энтальпией сгорания ΔН o сгор,298 называют энтальпию сгорания вещества (обычно 1 моль), находящегося в стандартном состоянии с образованием СО2(г), Н2О(ж) и других веществ, состав которых должен быть специально указан. Все продукты сгорания также должны находиться в стандартном состоянии.
Примеры решения задач
Задача 1. Используя справочные термодинамические данные вычислить ΔН o 298 реакции:
Решение. Решим задачу, используя оба следствия из закона Гесса. Ниже для исходных веществ и продуктов реакции приведены значения энтальпий образования и сгорания в кДж/моль (энтальпия сгорания сероводорода до SO2(г) и H2O(ж)):
| Вещество | H2S(г) | O2(г) | SO2(г) | H2O(ж) |
| ΔН o f,298 | -20,60 | 0 | -296,90 | -285,83 |
| ΔН o сгор,298 | -562,10 | 0 | 0 | 0 |
Cогласно первому следствию закона Гесса энтальпия этой реакции ΔН о х.р. равна:
В соответствии со вторым следствием закона Гесса получаем:
ΔН о х.р.,298 = 2ΔН о сгор,298(H2S(г)) = 2(-562,10) = — 1124,20 кДж.
Задача 2. Вычислите ΔН о 298 реакции N2(г) + 3H2(г) = 2NH3(г), используя следующие данные:
Определите стандартную энтальпию образования NH3(г).
Решение. Поскольку с термохимическими уравнениями можно производить все алгебраические действия, то искомое уравнение получится, если:
Таким образом, тепловой эффект реакции N2(г) + 3H2(г) = 2NH3(г) равен:
Δ Н о 298 = (- ΔН о 1/2) + (- 3/2·ΔН о 2) = 765,61 + (- 857,49) = — 91,88 кДж.
Поскольку в рассматриваемой реакции образуется 2 моль NH3(г), то
ΔН о f,298(NH3(г)) = — 91,88/2 = — 45,94 кДж/моль.
Задача 3. Определите энтальпию процесса
если при 298,15 К энтальпия растворения CuSO4(к) в n моль Н2О с образованием раствора CuSO4(р-р, nH2O) равна –40, а энтальпия растворения CuSO4·5H2O(к) с образованием раствора той же концентрации равна +10,5 кДж/моль.
Решение. Составляем цикл Гесса:
ΔН о 1 = ΔН о 2 + ΔН о х (по закону Гесса). Отсюда получаем:
Другой вариант решения.
По закону Гесса: ΔН о 1 = ΔН о х+ ΔН о 3, т.е. при сложении уравнений (2) и (3) получим уравнение (1).
Задача 4. Вычислите энтальпию образования химической связи С= С в молекуле этилена, если его стандартная энтальпия образования равна 52,3 кДж/моль, энтальпия возгонки графита составляет 716,7 кДж/моль, энтальпия атомизации водорода равна +436,0 кДж/моль, энтальпия образования связи С–Н равна –414,0 кДж/моль.
Решение. Составляем цикл Гесса:
ΔН о (С = С) = 52,3 — 2·716,7 — 2·436,0 + 4·414,0 = — 597,1 кДж/моль.
Задачи для самостоятельного решения
1. Составьте уравнение реакции, для которой ΔН о соответствует стандартной энтальпии образования ВaCl2·2H2O(к).
Стандартная энтальпия как найти
Термохимия изучает тепловые эффекты химических реакций. Во многих случаях эти реакции протекают при постоянном объеме или постоянном давлении. Из первого закона термодинамики следует, что при этих условиях теплота является функцией состояния. При постоянном объеме теплота равна изменению внутренней энергии:
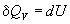
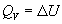
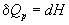
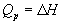
Эти равенства в применении к химическим реакциям составляют суть закона Гесса:
Тепловой эффект химической реакции, протекающей при постоянном давлении или постоянном объеме, не зависит от пути реакции, а определяется только состоянием реагентов и продуктов реакции.
Из закона Гесса вытекают важные следствия, которые позволяют рассчитывать энтальпии химических реакций.
Следствие 1. Стандартная энтальпия химической реакции
равна разности стандартных энтальпий образования продуктов реакции и реагентов (с учетом стехиометрических коэффициентов):
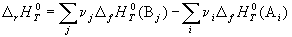
Стандартной энтальпией (теплотой) образования вещества 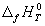
Следствие 2. Стандартная энтальпия химической реакции
равна разности энтальпий сгорания реагентов и продуктов реакции (с учетом стехиометрических коэффициентов):
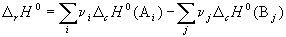
(c означает «combustion»). Стандартной энтальпией (теплотой) сгорания вещества называют энтальпию реакции полного окисления одного моля вещества. Это следствие обычно используют для расчета тепловых эффектов органических реакций.
Следствие 3. Энтальпия химической реакции равна разности энергий разрываемых и образующихся химических связей.
Энергией связи A- B называют энергию, необходимую для разрыва связи и разведения образующихся частиц на бесконечное расстояние:
Энергия связи всегда положительна.
Большинство термохимических данных в справочниках приведено при температуре 298 К. Для расчета тепловых эффектов при других температурах используют уравнение Кирхгофа:
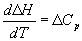
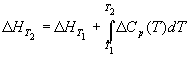
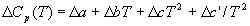
ПРИМЕРЫ
Решение. Энтальпии образования соответствуют следующим реакциям:
Вторую реакцию можно провести в две стадии: сначала сжечь водород с образованием жидкой воды по первой реакции, а затем испарить воду:
Тогда, согласно закону Гесса,
Пример 3-2. Рассчитайте энтальпию реакции
а) по энтальпиям образования; б) по энергиям связи, в предположении, что двойные связи в молекуле C6H6 фиксированы.
б) В данной реакции химические связи не разрываются, а только образуются. В приближении фиксированных двойных связей молекула C6H6 содержит 6 связей C- H, 3 связи C- C и 3 связи C=C. Энергии связей (в кДж/моль) (P.W.Atkins, Physical Chemistry, 5th edition, p. C7): E(C- H) = 412, E(C- C) = 348, E(C=C) = 612. Энтальпия реакции равна:
Пример 3-3. Пользуясь справочными данными, рассчитайте энтальпию реакции
Решение. Сокращенное ионное уравнение реакции имеет вид:
По закону Гесса, энтальпия реакции равна:
(энтальпии образования меди и иона H + равны, по определению, 0). Подставляя значения энтальпий образования (P.W.Atkins, Physical Chemistry, 5th edition, pp. C9-C15), находим:
(в расчете на три моля меди).
Решение. Энтальпия реакции сгорания метана
Найдем разность теплоемкостей как функцию температуры:
Энтальпию реакции при 1000 К рассчитаем по уравнению Кирхгофа:
ЗАДАЧИ
3-2. Стандартная энтальпия реакции CaCO3(тв) = CaO(тв) + CO2(г), протекающей в открытом сосуде при температуре 1000 К, равна 169 кДж/моль. Чему равна теплота этой реакции, протекающей при той же температуре, но в закрытом сосуде?
3-3. Рассчитайте стандартную внутреннюю энергию образования жидкого бензола при 298 К, если стандартная энтальпия его образования равна 49.0 кДж/моль.
3-4. Рассчитайте энтальпию образования N2O5(г) при T = 298 К на основании следующих данных:
3-6. Определите энтальпию образования диборана B2H6(г) при T = 298 К из следующих данных:
3-7. Рассчитайте теплоту образования сульфата цинка из простых веществ при T = 298 К на основании следующих данных:
3-9. Рассчитайте тепловой эффект реакции
при T = 298 K, если известны следующие данные:
3-12. Рассчитайте стандартный тепловой эффект реакции нейтрализации
NaOH + HCl = NaCl + H2O,
протекающей в водном растворе при 298 К.
3-13. Рассчитайте стандартный тепловой эффект реакции
3-14. Напишите уравнение Кирхгофа для реакции, протекающей при постоянном объеме.
3-15. Зависимость теплового эффекта реакции CH3OH(г) + 3/2O2 = CO2 + 2H2O(г) от температуры выражается уравнением:
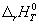


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
Урок 19. Изменение энтальпии
В уроке 19 «Изменение энтальпии» из курса «Химия для чайников» рассмотрим понятие теплоты реакции и ее единицу измерения; выясним, что происходит при экзотермических и эндотермических реакциях, а также познакомимся с законом Гесса. Данный урок потребует от вас знания химических основ из прошлых уроков. Обязательно прочитайте о составлении химических реакций и формулировку законов сохранения массы и энергии, чтобы не возникало лишних вопросов.
Хоть данная глава и называется «Законы сохранения массы и энергии«, однако пока мы ничего не говорили о законе сохранения энергии. Для тех, кто забыл: закон сохранения энергии гласит, что теплОты реакций аддитивны и энергия процесса не зависит от того, проводится ли он в одну или несколько стадий.
Единица измерения теплоты
Так как это курс химии, а не физики, то совсем мельком напомню, что теплота и работа являются хоть и различными, но формами энергии, поэтому измеряются в одинаковых единицах (в Дж). Если вы совершаете работу над каким-либо телом или совокупностью тел, можно повысить энергию этой системы или нагреть ее в зависимости от того, каким образом совершается работа. К примеру, когда мы поднимает какой-либо предмет, работа превращается в потенциальную энергию, а если потереть этот предмет, то работа (трение) переходит в теплоту. И наоборот, при падении тяжелого предмета энергия превращается в теплоту, а при работе двигателя внутреннего сгорания выделяемая в нем теплота переходит в работу. Химиков, в отличии от физиков, занимает не работа, а теплота, которая может поглощаться и выделяться при протекании химической реакции.
Единицей измерения теплоты служит — Джоуль (Дж). 1 Джоуль можно определить как количество теплоты, необходимое для повышения температуры 1 г чистой воды на 1/4 градуса. В повседневной жизни 1 джоуль энергии требуется для поднятия небольшого яблока (102 г) строго вертикально на высоту один метр.
Теплота реакции
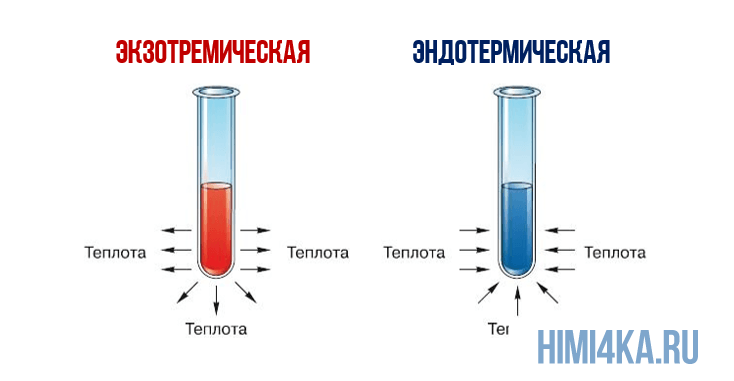
Представление о законе сохранения энергии можно получить на примере разложения пероксида водорода, H2O2. Когда водный раствор H2O2 реагирует с образованием газообразного кислорода и жидкой воды, происходит заметное выделение тепла: разложение 1 моля H2O2 при 25°С (комнатная температура) сопровождается выделением 94,7 кДж (94700 Дж) тепла.
Это количество теплоты, которое выделяется при разложении 1 моля пероксида водорода на 1 моль воды и 1/2 моля газообразного кислорода, т.е. в расчете на 1 моль реагента. Если удвоить все коэффициенты в уравнении реакции, то придется удвоить и теплоту реакции, поскольку она будет относиться теперь к вдвое большему количеству реагента:
Физическое состояние реагентов и продуктов также оказывает влияние на теплоту реакции (изменение энтальпии). Если H2O2 заставить разлагаться на газообразный кислород и водяной пар, а не жидкую воду, часть молярной теплоты разложения H2O2 (94,7 кДж) затратится на испарение H2O, которое описывается уравнением:
и поэтому при таком разложении пероксида водорода будет выделяться меньше теплоты:
Закон Гесса
Аддитивность теплот реакций вытекает непосредственно из первого закона термодинамики : изменение энергии или энтальпии между двумя состояниями системы зависит только от самих этих состояний, а не от того, каким образом осуществляется переход между ними. Следовательно, разность между энтальпиями реагентов и продуктов, т.е теплота реакции, должна зависеть только от исходного и конечного состояний, а не от того конкретного пути, по которому следует реакция. Это утверждение носит название закон аддитивности теплот реакций (закон Гесса).
Благодаря закону Гесса совсем не обязательно измерять изменение энтальпии каждой возможной химической реакции. Например, если известны теплота испарения жидкой воды (3), то совсем не обязательно измерять теплоту разложения пероксида водорода с образованием водяного пара; эту величину гораздо проще получить путем вычислений. Если какую-либо реакцию трудно провести в лабораторных условиях, можно попытаться подобрать последовательность легче осуществляемых реакций, сумма которых дает необходимую реакцию. После измерения изменений энтальпии для всех индивидуальных реакций в такой последовательности можно просуммировать соответствующие изменения энтальпии подобно самим химическим уравнениям и найти теплоту трудно проводимой реакции.
Урок 19 «Изменение энтальпии» бесспорно был сложным, но чрезвычайно важным. Скорее всего у вас сейчас каша в голове, но не пугайтесь, ведь в следующем уроке все встанет на свои места. Если у вас возникли вопросы по данному уроку, то пишите их в комментарии.
Энтальпия образования
Тепловой эффект химической реакции или изменение энтальпии системы вследствие протекания химической реакции – отнесенное к изменению химической переменной количество теплоты, полученное системой, в которой прошла химическая реакция и продукты реакции приняли температуру реагентов.
Чтобы тепловой эффект являлся величиной, зависящей только от характера протекающей химической реакции, необходимо соблюдение следующих условий:
Содержание
Стандартная энтальпия образования (стандартная теплота образования)
Например, стандартная энтальпия образования 1 моль метана из углерода и водорода равна тепловому эффекту реакции:
Энтальпия образования простых веществ принимается равной нулю, причем нулевое значение энтальпии образования относится к агрегатному состоянию, устойчивому при T = 298 K. Например, для йода в кристаллическом состоянии ΔHI2(тв) 0 = 0 кДж/моль, а для жидкого йода ΔHI2(ж) 0 = 22 кДж/моль. Энтальпии образования простых веществ при стандатных условиях являются их основными энергетическими характеристиками.
Тепловой эффект любой реакции находится как разность между суммой теплот образования всех продуктов и суммой теплот образования всех реагентов в данной реакции (следствие закона Гесса):
Термохимические эффекты можно включать в химические реакции. Химические уравнения в которых указано количество выделившейся или поглощенной теплоты, называются термохимическими уравнениями. Реакции, сопровождающиемя выделением тепла в окружащию среду имеют отрицательный тепловой эффект и называются экзотермическими. Реакции, сопровождающиеся поглощением тепла имеют положительный тепловой эффект и называются эндотермическими. Тепловой эффект обычно относится к одному молю прореагировавшего исходного вещества, стехиометрический коэффициент которого максимален.
Температурная зависимость теплового эффекта (энтальпии) реакции
Чтобы рассчитать температурную зависимость энтальпии реакции, необходимо знать мольные теплоемкости веществ, участвующих в реакции. Изменение энтальпии реакции при увеличении температуры от Т1 до Т2 рассчитывают по закону Кирхгофа (предполагается, что в данном интервале температур мольные теплоемкости не зависят от температуры и нет фазовых превращений):
Если в данном интервале температур происходят фазовые превращения, то при расчете необходимо учесть теплоты соответствующих превращений, а так же изменение температурной зависимости теплоемкости веществ, претерпевших такие превращения:
Стандартная энтальпия сгорания
Стандартная энтальпия растворения
Стандартная энтальпия нейтрализации
Стандартная энтальпия нейтрализации – ΔHнейтр о энтальпия реакции взаимодействия сильных кислот и оснований с образованием 1 моля воды при стандартных условиях:
Стандартная энтальпия нейтрализации для концентрированных растворов сильных электролитов зависит от концентрации ионов, вследствии измения значения ΔHгидратации° ионов при разбавлении.
Расчет энтальпии и энтропии химической реакции с использованием 3-го следствия из закона Гесса
Расчет энтальпии и энтропии реакции горения ацетилена
Задача 1.
Реакция горения ацетилена протекает по уравнению: С2Н2(г) + 5/2О2(г) = 2СО2(г) + Н2О(ж).
Вычислите изменение энтропии системы в стандартных условиях и объясните причины её уменьшения.
Решение.
Согласно следствию из закона Гесса, изменение энтропии определяется как разность сумм энтропий продуктов и реагентов процесса с учетом стехиометрических коэффициентов реакции. Тогда
∆S 0 х.р. = [2·S 0 обрСО2(г) + S 0 обрН2О(ж)] – [S 0 обрС2Н2(г) + (5/2)·S 0 обрО2(г)].
По табличным данным найдем значения энтропии для требуемых веществ:
S 0 обрСО2(г) = 213,65Дж/моль·К;
S 0 обрН2О(ж) = 69,94Дж/моль·К;
S 0 обрС2Н2(г) = 219,45Дж/моль·К;
S 0 обрО2(г) = 205,03Дж/моль·К.
Подставив эти значения в уравнение изменения энтропии процесса, и произведя расчеты, получим:
Уменьшение энтропии процесса объясняется ростом упорядоченности системы, так как количество вещества газов в продуктах реакции в 2,7 раза меньше, чем в реагентах (5,5/2).
Расчет энтальпии и энтропии реакции разложения нитрата магния
Задача 2.
Реакция разложения магния нитрата по уравнению:2Mg(NO3)2(т) = 2MgO(т) + 4NO2(г) + O2(г) сопровождается увеличением энтропии системы на 891 Дж/К и изменением энтальпии на 510 кДж. Рассчитайте стандартную энтальпию образования и энтропию образования магния нитрата. Определите, какой из факторов – энтальпийный или энтропийный – способствует самопроизвольному протеканию этого процесса.
Решение:
Расчеты ∆H 0 обр[Mg(NO3)2(т)] и S 0 обр[Mg(NO3)2(т)] произведем на основании 3-го следствия из закона Гесса, согласно которому:
Используя данные таблицы, найдем значения энтальпий образования и энтропий продуктов реакции:
Подставив найденные значения в уравнения а) и б), рассчитаем искомые величины:
Как известно, самопроизвольному протеканию реакции способствует уменьшение её энтальпийного фактора (∆H 0 х.р. 0 х.р. > 0). Согласно данным условия задачи, энтропия во время процесса возрастает, и, следовательно, возрастает и произведение Т·∆S 0 х.р., что способствует его самопроизвольному протеканию. С другой стороны, возрастает и энтальпия реакции, что не способствует самопроизвольности процесса в прямом направлении.