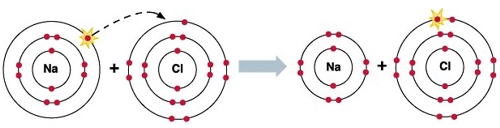
Степень окисления как объяснить
Степени окисления элементов. Как найти степени окисления?
3) Высшая степень окисления элемента, как правило, совпадает с номером группы, в которой находится данный элемент (например, фосфор находится в V группе, высшая с. о. фосфора равна +5). Важные исключения: F, O.
4) Поиск степеней окисления остальных элементов основан на простом правиле:
Несколько простых примеров на определение степеней окисления
Что делать, если неизвестны степени окисления двух элементов
А можно ли определить степени окисления сразу нескольких элементов, пользуясь похожим уравнением? Если рассматривать данную задачу с точки зрения математики, ответ будет отрицательным. Линейное уравнение с двумя переменными не может иметь однозначного решения. Но ведь мы решаем не просто уравнение!
Вывод: если в молекуле содержится несколько атомов с неизвестными степенями окисления, попробуйте «разделить» молекулу на несколько частей.
Как расставлять степени окисления в органических соединениях
Не смешивайте понятия «валентность» и «степень окисления»!
Степень окисления часто путают с валентностью. Не совершайте подобной ошибки. Перечислю основные отличия:
Небольшой тест на тему «Степень окисления»
Потратьте несколько минут, проверьте, как вы усвоили эту тему. Вам необходимо ответить на пять несложных вопросов. Успехов!
Для желающих еще немного потренироваться рекомендую соответствующий тематический тест.
Степень окисления для «чайников»
Степень окисления или окислительное число дает количественную характеристику состояния атома в соединении.
| Степень окисления — условный заряд атома в соединении, если предположить, что соединение состоит только из ионов |
Исходя из вышесказанного, в окислительно-восстановительных реакциях вычисляют неизвестную степень окисления элементов, исходя из двух моментов:
Составляем и решаем уравнение:
| Высшая степень окисления — наибольшее положительное ее значение |
Высшая степень окисления является очень важной количественной характеристикой элемента, чаще всего, она равна номеру группы элемента в Периодической таблице:
| Низшая степень окисления — наименьшее возможное ее значение для данного элемента |
Если элемент имеет три и более возможных степеней окисления, то все остальные степени окисления, лежащие между высшей и низшей, называются промежуточными или средними.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
1.3.2. Электроотрицательность. Степень окисления и валентность химических элементов.
Электроотрицательность
Электроотрицательность — способность атома какого-либо химического элемента в соединении оттягивать на себя электроны связанных с ним атомов других химических элементов.
Электроотрицательность, как и прочие свойства атомов химических элементов, изменяется с увеличением порядкового номера элемента периодически:
График выше демонстрирует периодичность изменения электроотрицательности элементов главных подгрупп в зависимости от порядкового номера элемента.
При движении вниз по подгруппе таблицы Менделеева электроотрицательность химических элементов уменьшается, при движении вправо по периоду возрастает.
Электроотрицательность отражает неметалличность элементов: чем выше значение электроотрицательности, тем более у элемента выражены неметаллические свойства.
Степень окисления
Степень окисления – условный заряд атома химического элемента в соединении, рассчитанный исходя из предположения, что все связи в его молекуле ионные, т.е. все связывающие электронные пары смещены к атомам с большей электроотрицательностью.
Как рассчитать степень окисления элемента в соединении?
1) Степень окисления химических элементов в простых веществах всегда равна нулю.
2) Существуют элементы, проявляющие в сложных веществах постоянную степень окисления:
Элементы, проявляющие постоянную СО
Значение постоянной СО этого элемента
IA группы — Li, Na, K, Rb, Cs, Fr
Be, Mg, Ca, Sr, Ba, Ra, Zn, Cd
3) Существуют химические элементы, которые проявляют в подавляющем большинстве соединений постоянную степень окисления. К таким элементам относятся:
Элемент
Степень окисления практически во всех соединениях
Исключения
Фторид кислорода —
4) Алгебраическая сумма степеней окисления всех атомов в молекуле всегда равна нулю. Алгебраическая сумма степеней окисления всех атомов в ионе равна заряду иона.
5) Высшая (максимальная) степень окисления равна номеру группы. Исключения, которые не попадают под это правило, — элементы побочной подгруппы I группы, элементы побочной подгруппы VIII группы, а также кислород и фтор.
Химические элементы, номер группы которых не совпадает с их высшей степенью окисления (обязательные к запоминанию)
Химический элемент
Номер группы
Высшая степень окисления
6) Низшая степень окисления металлов всегда равна нулю, а низшая степень окисления неметаллов рассчитывается по формуле:
низшая степень окисления неметалла = №группы − 8
Отталкиваясь от представленных выше правил, можно установить степень окисления химического элемента в любом веществе.
Нахождение степеней окисления элементов в различных соединениях
Пример 1
Определите степени окисления всех элементов в серной кислоте.
Решение:
Запишем формулу серной кислоты:
Степень окисления водорода во всех сложных веществах +1 (кроме гидридов металлов).
Обозначим степень окисления серы как x:
Молекула серной кислоты, как и молекула любого вещества, в целом электронейтральна, т.к. сумма степеней окисления всех атомов в молекуле равна нулю. Схематически это можно изобразить следующим образом:
Т.е. мы получили следующее уравнение:
Таким образом, степень окисления серы в серной кислоте равна +6.
Пример 2
Определите степень окисления всех элементов в дихромате аммония.
Решение:
Запишем формулу дихромата аммония:
Как и в предыдущем случае, мы можем расставить степени окисления водорода и кислорода:
Однако мы видим, что неизвестны степени окисления сразу у двух химических элементов — азота и хрома. Поэтому найти степени окисления аналогично предыдущему примеру мы не можем (одно уравнение с двумя переменными не имеет единственного решения).
Мы знаем степени окисления водорода и кислорода. Зная, что сумма степеней окисления атомов всех элементов в ионе равна заряду, и обозначив степени окисления азота и хрома как x и y соответственно, мы можем записать:
Т.е. мы получаем два независимых уравнения:
Решая которые, находим x и y:
Как определять степени окисления элементов в органических веществах можно почитать здесь.
Валентность
Валентность атомов обозначается римскими цифрами: I, II, III и т.д.
Валентные возможности атома зависят от количества:
1) неспаренных электронов
2) неподеленных электронных пар на орбиталях валентных уровней
3) пустых электронных орбиталей валентного уровня
Валентные возможности атома водорода
Изобразим электронно-графическую формулу атома водорода:
Было сказано, что на валентные возможности могут влиять три фактора — наличие неспаренных электронов, наличие неподеленных электронных пар на внешнем уровне, а также наличие вакантных (пустых) орбиталей внешнего уровня. Мы видим на внешнем (и единственном) энергетическом уровне один неспаренный электрон. Исходя из этого, водород может точно иметь валентность, равную I. Однако на первом энергетическом уровне есть только один подуровень — s, т.е. атом водорода на внешнем уровне не имеет как неподеленных электронных пар, так и пустых орбиталей.
Таким образом, единственная валентность, которую может проявлять атом водорода, равна I.
Валентные возможности атома углерода
Рассмотрим электронное строение атома углерода. В основном состоянии электронная конфигурация его внешнего уровня выглядит следующим образом:
Т.е. в основном состоянии на внешнем энергетическом уровне невозбужденного атома углерода находится 2 неспаренных электрона. В таком состоянии он может проявлять валентность, равную II. Однако атом углерода очень легко переходит в возбужденное состояние при сообщении ему энергии, и электронная конфигурация внешнего слоя в этом случае принимает вид:
Несмотря на то что на процесс возбуждения атома углерода тратится некоторое количество энергии, траты с избытком компенсируются при образовании четырех ковалентных связей. По этой причине валентность IV намного более характерна для атома углерода. Так, например, валентность IV углерод имеет в молекулах углекислого газа, угольной кислоты и абсолютно всех органических веществ.
Помимо неспаренных электронов и неподеленных электронных пар на валентные возможности также влияет наличие вакантных ( ) орбиталей валентного уровня. Наличие таких орбиталей на заполняемом уровне приводит к тому, что атом может выполнять роль акцептора электронной пары, т.е. образовывать дополнительные ковалентные связи по донорно-акцепторному механизму. Так, например, вопреки ожиданиям, в молекуле угарного газа CO связь не двойная, а тройная, что наглядно показано на следующей иллюстрации:
Резюмируя информацию по валентным возможностям атома углерода:
1) Для углерода возможны валентности II, III, IV
2) Наиболее распространенная валентность углерода в соединениях IV
3) В молекуле угарного газа CO связь тройная (!), при этом одна из трех связей образована по донорно-акцепторному механизму
Валентные возможности атома азота
Запишем электронно-графическую формулу внешнего энергетического уровня атома азота:
Как видно из иллюстрации выше, атом азота в своем обычном состоянии имеет 3 неспаренных электрона, в связи с чем логично предположить о его способности проявлять валентность, равную III. Действительно, валентность, равная трём, наблюдается в молекулах аммиака (NH3), азотистой кислоты (HNO2), треххлористого азота (NCl3) и т.д.
Выше было сказано, что валентность атома химического элемента зависит не только от количества неспаренных электронов, но также и от наличия неподеленных электронных пар. Связано это с тем, что ковалентная химическая связь может образоваться не только, когда два атома предоставляют друг другу по одному электрону, но также и тогда, когда один атом, имеющий неподеленную пару электронов — донор( ) предоставляет ее другому атому с вакантной (
) орбиталью валентного уровня (акцептору). Т.е. для атома азота возможна также валентность IV за счет дополнительной ковалентной связи, образованной по донорно-акцепторному механизму. Так, например, четыре ковалентных связи, одна из которых образована по донорно-акцепторному механизму, наблюдается при образовании катиона аммония:
Несмотря на то что одна из ковалентных связей образуется по донорно-акцепторному механизму, все связи N-H в катионе аммония абсолютно идентичны и ничем друг от друга не отличаются.
Валентность, равную V, атом азота проявлять не способен. Связано это с тем, что для атома азота невозможен переход в возбужденное состояние, при котором происходит распаривание двух электронов с переходом одного из них на свободную орбиталь, наиболее близкую по уровню энергии. Атом азота не имеет d-подуровня, а переход на 3s-орбиталь энергетически настолько затратен, что затраты энергии не покрываются образованием новых связей. Многие могут задаться вопросом, а какая же тогда валентность у азота, например, в молекулах азотной кислоты HNO3 или оксида азота N2O5? Как ни странно, валентность там тоже IV, что видно из нижеследующих структурных формул:
em>Резюмируя информацию по валентным возможностям атома азота:
1) Для азота возможны валентности I, II, III и IV
2) Валентности V у азота не бывает!
3) В молекулах азотной кислоты и оксида азота N2O5 азот имеет валентность IV, а степень окисления +5 (!).
Валентные возможности фосфора
Изобразим электронно-графическую формулу внешнего энергетического уровня атома фосфора:
Как мы видим, строение внешнего слоя у атома фосфора в основном состоянии и атома азота одинаково, в связи с чем логично ожидать для атома фосфора так же, как и для атома азота, возможных валентностей, равных I, II, III и IV, что и наблюдается на практике.
Однако в отличие от азота, атом фосфора имеет на внешнем энергетическом уровне еще и d-подуровень с 5-ю вакантными орбиталями.
Таким образом, недоступная для азота валентность V для атома фосфора возможна. Так, например, валентность, равную пяти, атом фосфора имеет в молекулах таких соединений, как фосфорная кислота, галогениды фосфора (V), оксид фосфора (V) и т.д.
Валентные возможности атома кислорода
Электронно-графическая формула внешнего энергетического уровня атома кислорода имеет вид:
Мы видим на 2-м уровне два неспаренных электрона, в связи с чем для кислорода возможна валентность II. Следует отметить, что данная валентность атома кислорода наблюдается практически во всех соединениях. Выше при рассмотрении валентных возможностей атома углерода мы обсудили образование молекулы угарного газа. Связь в молекуле CO тройная, следовательно, кислород там трехвалентен (кислород — донор электронной пары).
Из-за того что атом кислорода не имеет на внешнем уровне d-подуровня, распаривание электронов s и p-орбиталей невозможно, из-за чего валентные возможности атома кислорода ограничены по сравнению с другими элементами его подгруппы, например, серой.
Таким образом, кислород практически всегда имеет валентность, равную II, однако в некоторых частицах он трехвалентен, в частности, в молекуле угарного газа C≡O. В случае, когда кислород имеет валентность III, одна из ковалентных связей образована по донорно-акцепторному механизму.
Валентные возможности атома серы
Внешний энергетический уровень атома серы в невозбужденном состоянии:
У атома серы, как и у атома кислорода, в обычном состоянии два неспаренных электрона, поэтому мы можем сделать вывод о том, что для серы возможна валентность, равная двум. И действительно, валентность II сера имеет, например, в молекуле сероводорода H2S.
Как мы видим, у атома серы на внешнем уровне появляется d-подуровень с вакантными орбиталями. По этой причине атом серы способен расширять свои валентные возможности в отличие от кислорода за счет перехода в возбужденные состояния. Так, при распаривании неподеленной электронной пары 3p-подуровня атом серы приобретает электронную конфигурацию внешнего уровня следующего вида:
В таком состоянии атом серы имеет 4 неспаренных электрона, что говорит нам о возможности проявления атомами серы валентности, равной IV. Действительно, валентность IV сера имеет в молекулах SO2, SF4, SOCl2 и т.д.
При распаривании второй неподеленной электронной пары, расположенной на 3s-подуровне, внешний энергетический уровень приобретает конфигурацию:
В таком состоянии уже становится возможным проявление валентности VI. Примером соединений с VI-валентной серой являются SO3, H2SO4, SO2Cl2 и т.д.
Аналогично можно рассмотреть валентные возможности остальных химических элементов.
Как расставлять и как определить степень окисления элементов
В химических процессах главную роль играют атомы и молекулы, свойства которых определяют исход химических реакций. Одной из важных характеристик атома является окислительное число, которое упрощает метод учета переноса электронов в частице. Как определить степень окисления или формальный заряд частицы и какие правила необходимо знать для этого?
Определение

Термин окисление (оксидация) в химии означает реакцию, в ходе которой группа атомов или один из них теряют электроны или приобретают, в случае приобретения реакцию называют «восстановлением».
Степень окисления – это величина, которая измеряется количественно и характеризует перераспределяемые электроны в ходе реакции. Т.е. в процессе оксидации электроны в атоме уменьшаются или увеличиваются, перераспределяясь между другими взаимодействующими частицами, и уровень оксидации показывает, как именно они реорганизуются. Данное понятие тесно связано с электроотрицательностью частиц – их умением притягивать и отталкивать от себя свободные ионы.
Это интересно! Что такое алканы: строение и химические свойства
Определение уровня оксидации зависит от характеристик и свойств конкретного вещества, поэтому нельзя однозначно назвать процедуру вычисления легкой или сложной, но ее результаты помогают условно записать процессы окислительно-восстановительных реакций. Следует понимать, что полученный результат вычислений является результатом учета переноса электронов и не имеет физического смысла, а также не является истинным зарядом ядра.
Важно знать! Неорганическая химия часто использует термин валентности вместо степени окисления элементов, это не является ошибкой, но следует учитывать, что второе понятие более универсальное.
Понятия и правила вычислений движения электронов являются основой для классификации химических веществ (номенклатура), описания их свойств и составления формул связи. Но наиболее часто данное понятие используется для описания и работы с окислительно-восстановительными реакциями.
Правила определения степени окисления
Как узнать степень окисления? При работе с окислительно-восстановительными реакциями важно знать, что формальный заряд частицы всегда будет равен величине электрона, выраженного в числовом значении. Эта особенность связана с тем предположением, что электронные пары, образующие связь, всегда полностью смещаются в сторону более отрицательных частиц. Следует понимать, что речь идет об ионных связях, а в случае реакции при ковалентной связи электроны будут делиться поровну между одинаковыми частицами.
Окислительное число может иметь как положительные, так и отрицательные значения. Все дело в том, что в процессе реакции атом должен стать нейтральным, а для этого нужно либо присоединить к иону некое количество электронов, если он положительный, либо отнять их, если он отрицательный. Для обозначения данного понятия при записи формулы обычно прописывают над обозначением элемента арабскую цифру с соответствующим знаком. Например, 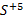
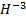
Следует знать, что формальный заряд металлов всегда будет положительным, а в большинстве 
Запомнив эти особенности, достаточно просто будет определять окислительное число у элементов, независимо от сложности и количества уровней атомов.
Полезное видео: определение степени окисления
Как определить степень окисления
Периодическая таблица Менделеева содержит почти всю необходимую информацию для работы с химическими элементами. Например, школьники используют только ее для описания химических реакций. Так, чтобы определить максимальные положительные и отрицательные значения окислительного числа необходимо свериться с обозначением химического элемента в таблице:
Таким образом, достаточно просто узнать крайние границы формального заряда того или иного элемента. Такое действие можно совершить с помощью вычислений на основе таблицы Менделеева.
Важно знать! У одного элемента могут быть одновременно несколько различных показателей оксидации.
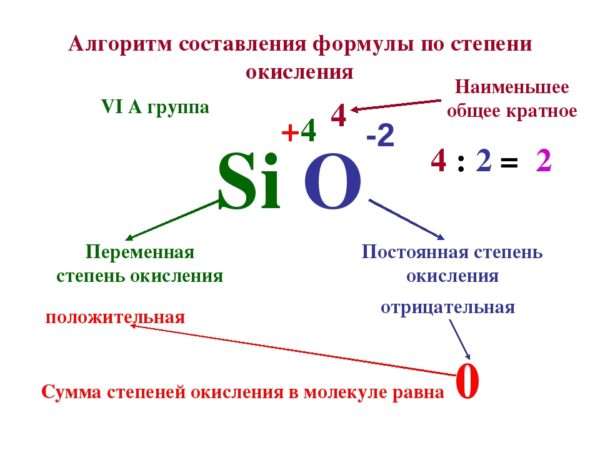
Различают два основных способа определения уровня оксидации, примеры которых представлены ниже. Первый из них – это способ, который требует знаний и умений применять законы химии. Как расставлять степени окисления с помощью этого способа?

Для этого необходимо:
Это интересно! Уроки химии: что это такое галогены
Этот способ весьма хорош, поскольку правильность решения всегда можно проверить, если сложить все уровни оксидации вместе.
Второй метод можно применять без знания химических законов:
Рассмотрим второй метод на примере вещества Na2SO4, в котором не определен атом серы S, известно лишь, что он отличен от нуля.
Это интересно! Уроки химии: катионы и анионы – что это такое
Чтобы найти, чему равны все степени окисления необходимо:
Таким образом, чтобы использовать второй метод, достаточно знать простые законы арифметики.
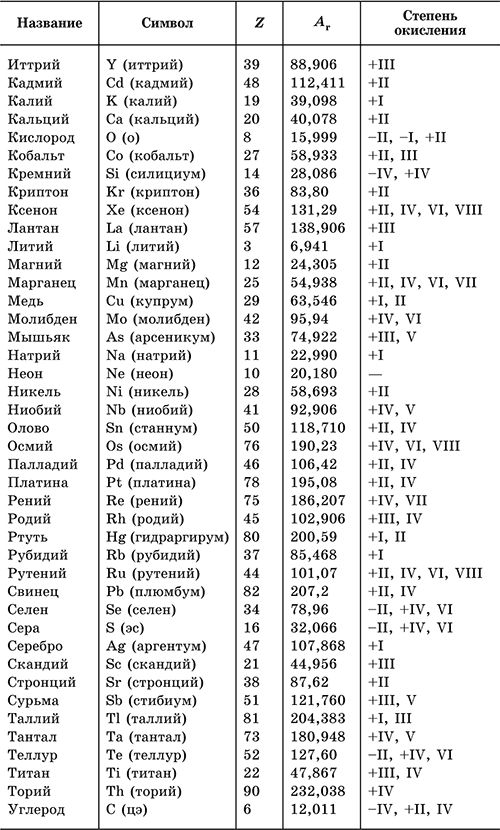
Таблица оксидации
Для простоты работы и вычисления показателей оксидации для каждого химического вещества используют специальные таблицы, где прописаны все данные.
Она выглядит следующим образом:
Полезное видео: учимся определять степень окисления по формулам
Вывод
Нахождение степени окисления для химического вещества – это простое действие, которое требует лишь внимательности и знания основных правил и исключений. Зная исключения и пользуясь специальными таблицами, это действие не будет занимать много времени.