Сульфат железа как пишется
Сульфат железа(III)
| Сульфат железа(III) | |
 | |
   | |
| Общие | |
|---|---|
| Систематическое наименование | сульфат железа(III) |
| Традиционные названия | сернокислое железо(III), тетрасульфид(VI) железа(III) |
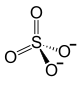
| Химическая формула | Fe2(SО4)3 |
| Эмпирическая формула | Fe2O12S3 |
| Физические свойства | |
| Состояние (ст. усл.) | безводный — светло-жёлтый порошок |
| Молярная масса | (безв.) 399.88 г/моль |
(пентагидрат) 489.96 г/моль
(безв.) растворим в разбавленной серной кислоте, ацетоне
15244-10-7 (для всех гидратов с формулой Fe2(SО4)3·nН2О (где n=1, 3, 4, 6, 7, 9, 10, 12)
Содержание
Физические свойства
Безводный сульфат железа(III) — светло-желтые, парамагнитные, очень гигроскопичные кристаллы моноклинной сингонии, пространственная группа P21/m, параметры элементарной ячейки a = 0,8296 нм, b = 0,8515 нм,c = 1,160 нм, β = 90,5°, Z = 4. Есть данные, что безводный сульфат железа образовывает орторомбическую и гексагональную модификации. Растворим в воде и ацетоне, не растворяется в этаноле.
Из воды кристаллизуется в виде кристаллогидратов Fe2(SO4)3·n H2O, где n = 12, 10, 9, 7, 6, 3. Наиболее изученный кристаллогидрат — нонагидрат сульфата железа(III) Fe2(SO4)3·9H2O — жёлтые гексагональные кристаллы, параметры элементарной ячейки a = 1,085 нм, c = 1,703 нм, Z = 4. Хорошо растворяется в воде (440 г на 100 г воды) и этаноле, не растворяется в ацетоне. В водных растворах сульфат железа(III) из-за гидролиза приобретает красно-коричневый цвет.
При нагревании нонагидрат превращается при 98 °C в тетрагидрат, при 125 °C — в моногидрат и при 175 °C — в безводный Fe2(SO4)3, который выше 600 °C разлагается на Fe2O3 и SO3.
Нахождение в природе
Все перечисленные выше природные гидраты железа являются непрочными соединениями и в открытом состоянии быстро выветриваются.
Получение
В промышленности сульфат железа(III) получают прокаливанием пирита или марказита с NaCl на воздухе:
или растворяют оксид железа(III) в серной кислоте:
В лабораторной практике сульфат железа(III) можно получить из гидроокиси железа(III):
Препарат той же чистоты можно получить окислением сульфата железа(II) азотной кислотой:
также окисление можно провести кислородом или оксидом серы:

Концентрированные серная и азотная кислоты окисляют сульфид железа до сульфата железа(III):
Дисульфид железа можно окислить концентрированной серной кислотой:
Сульфат-аммоний железа(II) (соль Мора) также можно окислить дихроматом калия. Вследствие данной реакции выделятся сразу четыре сульфата — железа(III), хрома(III), аммиака и калия, и вода:

Сульфат железа(III) можно получить как один из продуктов термического разложения сульфата железа(II):
Ферраты с разбавленной серной кислотой восстанавливаются до сульфата железа(III):
Нагрев пентагидрат до температуры 70—175 °C получим безводный сульфат железа(III):
Сульфат железа(II) можно окислить таким экзотическим окислителем, как оксид ксенона(III):
Химические свойства
Сульфат железа(III) в водных растворах подвергается сильному гидролизу по катиону, при этом раствор окрашивается в красновато-коричневый цвет:


Горячая вода или пар разлагают сульфат железа(III):
Безводный сульфат железа(III) при нагревании разлагается:

Растворы щелочей разлагают сульфат железа(III), продукты реакции зависят от концентрации щёлочи:

Если с щёлочью взаимодействует эквимолярный раствор сульфатов железа(III) и железа(II), то в результате получится сложный оксид железа:
Активные металлы (такие как магний, цинк, кадмий, железо) восстанавливают сульфат железа(III):
Некоторые сульфиды металлов (например, меди, кальция, олова, свинца, ртути) в водном растворе восстанавливают сульфат железа(III):
С растворимыми солями ортофосфорной кислоты образует нерастворимый фосфат железа(III) (гетерозит):
Сульфат железа(II)
| Сульфат железа(II) | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Железа сульфат (II) |
| Традиционные названия | Железный купорос |
| Химическая формула | FeSO4 |
| Физические свойства | |
| Молярная масса | 151,91 г/моль |
| Плотность | 1,8—1,9 г/см³ |
| Термические свойства | |
| Температура плавления | 400 °C |
| Химические свойства | |
| Растворимость в воде | 25.6 г/100 мл |
| Классификация | |
| Рег. номер CAS | 7720-78-7 |
| Регистрационный номер EC | 231-753-5 |
Сульфат железа(II), железный купорос, FeSO4 — соль серной кислоты и 2-валентного железа. Твёрдость — 2.
В химии железным купоросом называют кристаллогидрат сульфата железа(II). Кристаллы светло-зелёного цвета. Применяется в текстильной промышленности, в сельском хозяйстве как фунгицид, для приготовления минеральных красок.
Природный аналог — минерал мелантерит; в природе встречается в кристаллах моноклиноэдрической системы, зелёно-жёлтого цвета, в виде примазок или натёков.
Содержание
Свойства
Сульфат 2-валентного железа выделяется при температурах от 1,82 °C до 56,8 °C из водных растворов в виде светло-зелёных кристаллов кристаллогидрата FeSO4 · 7H2О, который называется в технике железным купоросом. В 100 г воды растворяется: 26,6 г безводного FeSO4 при 20 °C и 54,4 г при 56 °C.
Растворы сульфата железа(II) под действием кислорода воздуха постепенно окисляются, переходя в сульфат железа (III):
При нагревании свыше 480 °C разлагается:
Получение
Железный купорос можно приготовить действием разбавленной серной кислоты на железный лом, обрезки кровельного железа и т. д. В промышленности его получают как побочный продукт при травлении железных листов, проволоки, удалении окалины и др. разбавленной H2SO4.
Другой способ — окислительный обжиг пирита:
Применение
Применяют в производстве чернил, в красильном деле (для окраски шерсти в чёрный цвет), для консервирования дерева.
В медицине используется в качестве лекарственного средства для лечения и профилактики железодефицитной анемии. В России зарегистрирован под торговыми марками «Гемофер пролонгатум», «Тардиферон», а также «Сорбифер Дурулес» и «Ферроплекс» (в двух последних в качестве антиоксиданта добавляется аскорбиновая кислота).
См. также
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Hg2 2+ | Pb 2+ | Sn 2+ | Cu + | Cu 2+ | |
| OH − | P | P | P | — | P | М | Н | М | Н | Н | Н | — | Н | Н | Н | Н | Н | — | — | Н | Н | Н | Н | |
| F − | P | Н | P | P | Р | М | Н | Н | М | Р | Н | Н | Н | Р | Р | М | Р | Р | М | М | Н | Р | Н | Р |
| Cl − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | Н | М | — | Н | Р |
| Br − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | Н | М | Р | H | Р |
| I − | P | P | P | P | Р | Р | Р | Р | Р | Р | ? | Р | — | Р | Р | Р | Р | Н | Н | Н | Н | М | Н | — |
| S 2− | P | P | P | P | — | Р | М | Н | Р | — | — | Н | — | Н | Н | Н | Н | Н | Н | — | Н | Н | Н | Н |
| SO3 2− | P | P | P | P | Р | М | М | М | Н | ? | ? | М | ? | Н | Н | Н | М | Н | Н | Н | Н | ? | Н | ? |
| SO4 2− | P | P | P | P | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Н | Р | Р | Р |
| NO3 − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | — | Р | Р |
| NO2 − | P | P | P | P | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? | ? | ? |
| PO4 3− | P | Н | P | P | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | ? | Н | Н | Н | Н |
| CO3 2− | М | Р | P | P | Р | Н | Н | Н | Н | — | — | Н | — | Н | Н | — | Н | Н | — | Н | — | — | ? | — |
| CH3COO − | P | Р | P | P | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | М | Р | — | Р | Р |
| CN − | P | Р | P | P | Р | Р | Р | Р | Р | ? | Н | Н | — | Н | Н | Н | Н | Н | Р | Н | Р | — | — | Н |
| SiO3 2− | H | Н | P | P | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | ? | Н | ? | ? | ? |
 Препараты железа ( B03A ) Препараты железа ( B03A ) | |
|---|---|
| Пероральные препараты двухвалентного железа | Железа глицин сульфат* • Железа фумарат • Железа глюконат* • Железа карбонат* • Железа хлорид • Железа сукцинат* • Железа сульфат • Железа тартрат* • Железа аспартат* • Железа аскорбат* • Железа йодид* |
| Пероральные препараты трёхвалентного железа | Железа натрия цитрат* • Железа гидроксид сахарозный комплекс • Натрия феределат* • Железа гидроксид* • Железа гидроксид полимальтозат • Железа цитрат* • Железа сульфат-хондроитина комплекс* • Железа ацетил трансферрин* • Железа протеинсукцинилат |
| Парентеральные препараты трёхвалентного железа | Железа гидроксид полимальтозат • Железа гидроксид сахарозный комплекс • Железа сорбитол-лимонной кислоты комплекс* • Железа сорбитол-глюконовой кислоты комплекс* • Железа гидроксид декстран • Железа-натрия глюконат комплекс* |
| Препараты железа в комбинации с фолиевой кислотой | Препараты железа в комбинации с аминокислотами и фолиевой кислотой • Железа фумарат в комбинации с фолиевой кислотой • Железа сульфат в комбинации с фолиевой кислотой • Железа гидроксид полимальтозат в комбинации с фолиевой кислотой* |
| Препараты железа в комбинациях с другими препаратами | Препараты железа в комбинациях с цианокобаламином и фолиевой кислотой • Препараты железа в комбинациях с поливитаминами и фолиевой кислотой • Препараты железа в комбинациях с поливитаминами • Препараты железа в комбинациях с поливитаминами и минеральными веществами |
| * — препарат не зарегистрирован в России | |
Полезное
Смотреть что такое «Сульфат железа(II)» в других словарях:
Сульфат железа — Сульфаты железа общие названия химических веществ с формулой Fex(SO4)y. Неорганические соединения: Сульфат железа(II) соединение с формулой FeSO4 Сульфат железа(III) соединение с формулой Fe2(SO4)3 … Википедия
СУЛЬФАТ ЖЕЛЕЗА — (ferrous sulphate) соль железа; назначается больным внутрь для лечения или предотвращения развития железодефицитной анемии. Данное соединение обладает несколькими серьезными побочными эффектами;появление неприятных ощущений в желудке и понос… … Толковый словарь по медицине
Сульфат железа (II) — … Википедия
сульфат железа(II) — сернокислое железо(II) … Cловарь химических синонимов I
Сульфат железа(III) — У этого термина существуют и другие значения, см. Сульфат железа. Сульфат железа(III) … Википедия
СУЛЬФАТ ЖЕЛЕЗА, ЖЕЛЕЗНЫЙ КУПОРОС — (сернокислое железо закисное) H14FeO11S М.м. 277,9 Железа (II) сульфат, гептагидрат Голубовато зеленые кристаллы. Растворимость в воде (в г/л): при 0°С 135, при 10°С 170, при 20°С 210, при 30°С 248. Нелетуч. Выпускается в виде 53% го тех.… … Пестициды и регуляторы роста растений
Сульфат Железа (Ferrous Sulphate) — соль железа; назначается больным внутрь для лечения или предотвращения развития железодефицитной анемии. Данное соединение обладает несколькими серьезными побочными эффектами;появление неприятных ощущений в желудке и понос можно устранить путем… … Медицинские термины
сульфат железа(III) — сернокислое железо(III) … Cловарь химических синонимов I
Сульфат кобальта(II) — Систематическое название … Википедия
Сульфат хрома(II) — Общие Систематическое наименование Сульфат хрома(II) Традиционные названия Сернокислый хром Химическая формула CrSO4 Физические свойства Состояние … Википедия
Сульфат Железа
Химическое название
Железа(II) сульфат, сульфат железа (III).
Химические свойства
Двухвалентное сернокислое железо – неорганическое соединение, соль образованная серной кислотой и железом. Вещество не имеет запаха, не летуче. Безводная форма имеет вид бесцветных не прозрачных мелких гигрокопичных кристаллов. Кристаллогидраты имеют характерный зеленовато-голубой окрас, тетрагидраты зеленого цвета. Химическая формула Сульфата Железа 2: FeSO4, рацемическая: O4SFe. На вкус соединение вяжущее, с привкусом металла. Средство хорошо растворяется в воде. Молекулярная масса = 151,9 грамм на моль.
Вещество выделяется из железного купороса. Раствор сульфата Fe(2) под действием кислорода окисляется в переходит в Сульфат Железа 3. Разлагается при температуре выше 480 градусов Цельсия на оксиды.
Сульфат Железа 2 можно получить при воздействии разбавленной серной кислоты на обрезки железа; в виде побочного продукта реакции травления железных листов, при удалении окалины, при окислительном обжиге пирита.
Гидролиз Сульфата Железа 2 протекает по катиону в кислой среде. Первая ступень гидролиза: Fe2+ + SO42- + HOH ↔ FeOH+ + SO42- + H+; теоретически может протекать и вторая ступень гидролиза: FeOH+ + SO42- + HOH ↔ Fe(OH)2↓ + SO42- + H+.
Сернокислое железо 3 или тетрасульфид 6 железа 3 – это светло-желтые парамагнитные мелкие кристаллы. Вещество хорошо растворяется в воде, медленно – в этиловом спирте. Химическая формула Сульфата Железа 3: Fe2(SО4)3, рацемическая: Fe2O12S3. Вещество обладает способностью кристаллизоваться в форме кристаллогидратов Fe2(SO4)3•n H2O. Наибольшее значение имеет нонагидрат сульфата железа(III). Водные растворы приобретают красно-коричневую окраску из-за реакции гидролиза, протекающей по катиону. Соединение разлагается под действие горячей воды и высоких температур. При 98 градусах нонагидрат превращается в тетрагидрат, при температуре выше 125 градусов – в моногидрат и выше 175 – в безводный сульфат Fe, который при температуре более 600 градусов разлагается на оксиды серы и железа.
Фармакологическое действие
Противоанемическое, устраняющее железодефицит. Кровоостанавливающее (Сульфат Железа 3).
Фармакодинамика и фармакокинетика
Железо является основным микроэлементом, входящим в состав гемоглобина, миоглобина и прочих компонентов крови. Вещество принимает участие в окислительно-восстановительных реакциях, связывается и переносит молекулы кислорода по организму, стимулирует гемопоэз и эритропоэз. Сульфат Железа обеспечивает синтез всех железосодержащих метаболитов. После поступления Fe с пищей, оно усваивается в двенадцатиперстной кишке и переносится в депо тканей с помощью ферментов трансферетинов.
После приема лекарства внутрь, его активные компоненты полностью усваиваются организмом. Максимальная концентрация в крови наблюдается через 2-4 часа.
Показания к применению
Противопоказания
Сульфат Железа 2 противопоказан к приему:
Побочные действия
Побочные реакции во время лечения Сульфатом Железа возникают не часто.
Инструкция по применению (Способ и дозировка)
Лекарство назначают внутрь. Минимальная эффективная дозировка в пересчете на элементарное железо составляет 100 мг. Максимальное количество лекарства, которое можно принять – до 400 мг.
В профилактических целях назначают от 30 до 60 мг элементарного железа в сутки.
Передозировка
При передозировке усиливаются побочные реакции от приема лекарства. Возникают: диарея, тошнота, болезненные ощущения в животе, рвота, аритмия и рост ЧСС, повышается проницаемость капилляров, возможен сердечно-сосудистый коллапс. В качестве терапии промывают желудок, вводят дефероксамин для связывания ионов железа.
Взаимодействие
При сочетании с аскорбиновой кислотой улучшается всасывание препаратов железа.
Сочетанный прием сульфата и антацидных средств с магнием, алюминием, кальцием, пеницилламином и колестирамином замедляет всасывание железа.
Не рекомендуется сочетать лекарство с тетрациклиновыми антибиотиками, так как происходит взаимное снижение системной абсорбции обоих препаратов.
При сочетании лекарства с ГКС взаимно усиливается эритропоэз.
Условия хранения
Препараты хранят в сухом, темном, прохладном месте в оригинальной упаковке. Нельзя использовать лекарство после истечения срока годности.
Особые указания
Во время лечения Сульфатом Железа ii может наблюдаться окрашивание кала в черный цвет и потемнение эмали зубов.
При заболеваниях почек и печени железо может накапливаться в организме.
Особую осторожность соблюдают при лечении пациентов с язвенной болезнью желудка и 12-персной кишки, при язвенном колите и энтерите.
Вещество рекомендуется комбинировать с Фолиевой кислотой при железодефицитной анемии с дефицитом фол. к-ты.
При курсовом приеме лекарства рекомендуют периодически проводить контроль гемоглобина и уровня сывороточного железа.
При беременности и лактации
Лекарство можно использовать во время кормления грудью и при беременности по показаниям.
Препараты, в которых содержится (Аналоги)
Отзывы
Некоторые отзывы о применении препаратов Сульфата Железа:
Цена Сульфата Железа, где купить
Цена на лекарство варьирует в зависимости от производителя и лек. формы. Купить Сульфат Железа можно в любой аптеке. Например, стоимость таблеток пролонгированного действия Тардиферон составляет порядка 200 рублей за 30 штук.
Образование: Окончила Ровенский государственный базовый медицинский колледж по специальности «Фармация». Окончила Винницкий государственный медицинский университет им. М.И.Пирогова и интернатуру на его базе.
Опыт работы: С 2003 по 2013 г. – работала на должностях провизора и заведующего аптечным киоском. Награждена грамотами и знаками отличия за многолетний и добросовестный труд. Статьи на медицинскую тематику публиковались в местных изданиях (газеты) и на различных Интернет-порталах.

























