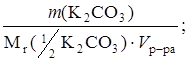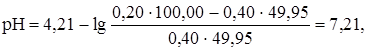Титрование задачи как решать
Титрование задачи как решать
В соответствии с основным принципом титриметрии
Если обозначить молярную концентрацию раствора трилона Б как C (ЭДТА), то количество вещества (моль) титранта выразится как
Приравнивая эти выражения и проведя несложные преобразования, получим, что молярная концентрация раствора ЭДТА равна
Подставляя числовые значения, получаем
Титр раствора ЭДТА равен
где M ( Na 2 H 2 Y × 2 H 2 O )=372,24 г/моль – молярная масса трилона Б.
Подставляя числовые значения, получаем
Рассчитаем условный титр раствора трилона Б по CaO
Ответ: 0,01085 моль/л; 0,004038 г/мл; 0,0006085 г/мл.
Подставляя числовые значения, получаем
После подстановки числовых значений получаем
MgY 2- + Hg 2+ → HgY 2- + Mg 2+
затрачено 19,85 мл 0,05 М ЭДТА ( K =1,055). Вычислить концентрацию (г/л) раствора Hg ( NO 3 )2.
При титровании по методу замещения
n ( Hg 2+ ) = n ( Mg 2+ ) = n (ЭДТА).
Выразим количество вещества ЭДТА (моль) с учетом условия задачи
Тогда массу определяемого вещества можно представить формулой
Концентрацию исходного раствора Hg ( NO 3 )2 можно выразить в виде
После подстановки числовых значений получаем:
Вычисления при обратном титровании
Титрометрическое определение извести
Уравнение реакции имеет вид:
NaOH + HCl = NaCl + H2O
Определяемое вещество (А) – CaO; М = 56 г/моль; Титранты: HCl (B1) и NaOH (В2), их молярные концентрации равны нормальным.
1. Расчет нормальности раствора второго титранта
Нормальность раствора NaOH рассчитаем по формуле:
СН(NaOH) = [Т(NaOH) · 1000]/Э(NaOH) = (0,004216 · 1000)/40 = 0,1054 моль.
2. Расчет массы определяемого вещества в навеске образца
Массу (m) CaO определяем по формуле:
3. Расчет массовой доли определяемого вещества в навеске пробы
Массовую долю СаО в навеске извести, рассчитаем по формуле:
w% = (m · 100%)/a, где
w% (СаО) = (0,2210 · 100%)/0,7500 = 29,47%.
Ответ:w% (СаО) = 29,47%.
Вычисление массы азотной кислоты
Уравнение реакции имеет вид:
HNO3 – определяемое вещество (А); NaOH – титрант (В).
1. Расчет нормальности раствора титрана
Нормальность раствора NaOH рассчитаем по формуле:
СН(NaOH) = [T(NaOH/HNO3) · 1000]/Э(HNO3) = (0,063000 · 1000/63 = 1 Н.
2. Расчет нормальности раствора определяемого вещества
Нормальность раствора HNO3 рассчитаем по формуле:
3. Расчет массы кислоты в 250 см 3 ее раствора
Массу HNO3 находим по формуле:
m(HNO3) = [V(к) · СН(HNO3) · Э(HNO3)]/1000 = (250 · 1,28 · 63)/1000 = 20,16 г.
Анализ буры методом титрования
Определяемое вещество (А) – Na2B4O7 · 10H2O; М = 381,37 г/моль; Э = 190,685 г/моль. Титрант: HCl
1. Рассчитаем массу буры, содержащейся в навеске образца
m = [СН(B) · V(B) · Э(А)]/1000, где
Искомую величину w, %, находим по формуле:
Примеры решения типовых задач
Прямое титрование.Решение типовых задач по результатам прямого титрования основано на использовании закона эквивалентов:
C ( 

Пример. Из навески К2CO3 массой 1,3811 г приготовили 200,0 мл раствора. На титрование 15,0 мл раствора израсходовали 11,3 мл раствора Н2SO4. Рассчитать молярную концентрацию раствора Н2SO4 и ее титр по цинку Т(Н2SO4/Zn).
Решение. Рассчитаем молярную концентрацию эквивалента приготовленного раствора К2CO3 с учетом фактора эквивалентности, равного 
С ( 
С ( 

Используя закон эквивалентов, определим молярную концентрацию эквивалента Н2SO4 (fэкв = 
С ( 

С ( 

Тогда молярная концентрация раствора Н2SO4 равна:
С (Н2SO4) = 0,1326 · 
Далее рассчитаем титр Т(Н2SO4/Zn), используя формулу
Т(Н2SO4/Zn) = 

Титрование смесей.Раздельное определение смеси кислот или смеси оснований возможно, если константы диссоциации компонентов смеси различаются между собой более чем 10 4 раз. При кислотно-основном титровании смесей обычно используют два индикатора – метиловый оранжевый и фенолфталеин. Изменение окраски каждого из индикаторов соответствует протеканию различных реакций компонентов смеси с титрантом. По результатам титрования смеси с двумя индикаторами определяют объемы титранта, пошедшие на взаимодействие с каждым компонентом смеси.
Пример. В мерную колбу вместимостью 250 мл поместили 10,0 мл смеси хлороводородной и ортофосфорной кислот, содержимое довели до метки. В две колбы для титрования поместили по 15,0 мл (Vал) полученного раствора. На титрование первой пробы с метиловым оранжевым израсходовали 27,4 мл (VT1) раствора NaOH с концентрацией 0,09678 моль/л. На нейтрализацию второй пробы в присутствии фенолфталеина затратили 33,2 мл (VT2) раствора NaOH той же концентрации. Рассчитать массу хлороводородной и ортофосфорной кислот в исходной смеси.
Решение. Рассмотрим кривые титрования хлороводородной и ортофосфорной кислот (рис. 4.5). HCl – сильная кислота, и на ее кривой титрования наблюдается большой скачок (ΔрН = 4–10). В этом случае можно использовать два индикатора: и метиловый оранжевый (ΔрН = 3,1–4,4), и фенолфталеин (ΔрН = 8,2–10,0).
Рис.4.5 Кривые титрования хлороводородной
и ортофосфорной кислот
На кривой титрования H3PO4 наблюдается два скачка: первый соответствует оттитровыванию H3PO4 до NaH2PO4. Ему соответствует изменение окраски метилового оранжевого. Второй скачок соответствует оттитровыванию H3PO4 до Na2HPO4 и фиксируется по изменению окраски фенолфталеина.
При титровании смеси хлороводородной и ортофосфорной кислот в присутствии метилового оранжевого протекают реакции:
| HСl + NaOH = NaCl + 2H2O H3PO4 + NaOH = NaH2PO4 + H2O | > | VT1 = 27,4 мл, |
а в присутствии фенолфталеина
| HСl + NaOH = NaCl + 2H2O H3PO4 + 2NaOH = Na2HPO4 + 2H2O | > | VT2 = 33,2 мл. |
При титровании с метиловым оранжевым раствор NaOH расходуется на нейтрализацию всей HCl и H3PO4 по одной ступени, а с фенолфталеином – на нейтрализацию всей HCl и H3PO4 по двум ступеням. Тогда объем раствора NaOH, пошедшего на титрование ортофосфорной кислоты по одной ступени:
DV = 33,2 – 27,4 = 5,8 мл.
По закону эквивалентов определим концентрацию ортофосфорной кислоты в мерной колбе:
С1 = 

Концентрация H3PO4 в исходной анализируемой смеси (10,0 мл) равна:
С2 = 
По справочнику найдем значение Мr(H3PO4) = 97,9952 г/моль, тогда масса H3PO4 в исходной анализируемой смеси
m(H3PO4) = 0,9355 · 10,0 · 10 –3 · 97,9952 = 0,9168 г.
Массу HСl можно рассчитать на основании результатов титрования и в присутствии метилового оранжевого, и в присутствии фенолфталеина.
Объем раствора NaOH, пошедший на титрование хлороводородной кислоты в присутствии метилового оранжевого
V (NaOH) = 27,4 – 5,8 = 21,6 мл.
Объем раствора NaOH, пошедший на титрование хлороводородной кислоты в присутствии фенолфталеина
V (NaOH) = 33,2 – 2 · 5,8 = 21,6 мл,
т. е. численные значения в том и другом случае совпадают. Затем рассчитаем концентрацию HСl в мерной колбе:
С1(HCl) = 
Тогда концентрация HСl в исходной смеси (10,0 мл) составляет:
С2 (HCl) = 
Рассчитаем массу HСl в исходной смеси:
m(HCl) = 3,4841 · 10,0 · 10 –3 · 36,461 = 1,2703 г.
Обратное титрование.Результат обратного титрования всегда рассчитывается по разности между количеством молей эквивалента титранта, взятого на реакцию с определяемым веществом, и оставшимся количеством другого титранта после реакции.
Пример. Навеску технического образца BaCO3 массой 0,3197 г растворили в 20,0 мл 0,2000 М раствора НСl. После полного удаления диоксида углерода избыток кислоты оттитровали 8,6 мл 0,09705 М раствора КОН. Найти массовую долю (%) BaCO3 и ВaO в образце.
Решение. Запишем уравнения протекающих реакций:
HCl + KOH = KCl + H2O
Сущность обратного титрования отражает следующая формула:
ν( 
С учетом условий задачи выразим число молей эквивалентов BaCO3 через количества реагирующих веществ:
ν( 
Тогда масса BaCO3 равна:
m(BaCO3) = ν( 

где Mr( 
m(BaCO3) = 3,165 · 10 –3 · 98,67 = 0,3123 г.
Рассчитаем массовую долю BaCO3:
ω(BaCO3) = 
Массу BaO рассчитываем аналогично, так как ν( 

m(BaO) = 3,165 · 10 –3 · 76,67 = 0,2427 г.
ω(BaO) = 
Построение кривых титрования и подбор индикаторов.При построении кривых кислотно-основного титрования необходимо провести 4 типа расчетов рН раствора в отдельные моменты титрования:
1) до начала титрования;
2) до точки эквивалентности (область буферных растворов);
3) в точке эквивалентности;
4) после точки эквивалентности.
Выбор индикатора осуществляют на основании правила выбора индикатора: для каждого данного титрования можно применять только те индикаторы, показатель титрования которых лежит в пределах скачка рН на кривой титрования. Интервал перехода окраски индикатора должен полностью или частично укладываться на скачок рН кривой титрования. рТ индикатора должен по возможности совпадать со значением рН в т. э. или быть близким к этому значению.
Пример. Построить кривую титрования C6H5COOH (бензойной кислоты) (С0= 0,20 моль/л) раствором КОН c концентрацией 0,40 моль/л и подобрать индикаторы.
Решение. Бензойная кислота – слабая кислота (рKа = 4,21), а KОН – сильное основание, поэтому в данном случае рассмотримтитрование слабой кислоты сильным основанием.
Предположим, что для титрования взяли 100,00 мл (V0) раствора C6H5COOH (С0 = 0,20 моль/л). По закону эквивалентов рассчитаем объем раствора КОН (Vх), необходимый для полного оттитровывания C6H5COOH.
1. рН исходного раствора рассчитаем по формуле для расчета рН раствора слабой кислоты:
рН = 



2. В любой момент титрования до точки эквивалентности в растворе существует буферная смесь, состоящая из неоттитрованной бензойной кислоты и образовавшегося бензоата калия.
При добавлении 50% от эквивалентного количества раствора гидроксида калия (25,00 мл) рН равен:
При добавлении 90% от эквивалентного количества раствора гидроксида калия (45,00 мл) рН равен:
Если добавлено 99% от эквивалентного количества раствора КОH (49,50 мл), рН равен:
При добавлении 99,9% от эквивалентного количества раствора гидроксида калия (49,95 мл) рН равен:
что соответствует точке начала скачка титрования.
3. В точке эквивалентности вся бензойная кислота прореагировала и превратилась в соль, концентрация которой Ссоли = Скислоты = 0,2 моль/л (без учета разбавления). рН раствора соли слабой кислоты рассчитаем по формуле
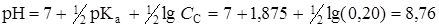
4. После точки эквивалентности величина рН раствора определяется только избытком добавленного титранта. При добавлении 50,05 мл раствора КОН (100,1 %) рН равен:
рН = 14 + lg 
Это значение рН соответствует точке конца скачка титрования.
При добавлении 50,50 мл раствора КОН (101%)
рН = 14 + lg 
При добавлении 55,00 мл раствора КОН (110%)
рН = 14 + lg 
Результаты сведем в табл. 4.1, по данным которой построим кривую титрования (рис. 4.6).
Таблица 4.1 Изменение рН в процессе титрования С6Н5СООН
| Объем титранта VT, мл | рН-определяющий компонент | Формула для расчета рН | рН |
| С6Н5СООН | рН =  рКа – рКа –  lg С0 lg С0 | 2,45 | |
| 45,00 | С6Н5СООН С6Н5СООK | 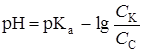 | 5,16 |
| 49,50 | С6Н5СООН С6Н5СООK | « – » | 6,21 |
| 49,95 | С6Н5СООН С6Н5СООK | « – » | 7,21 |
| 50,00 | С6Н5СООK | рН = 7 +  рКа + рКа +  lg Сc lg Сc | 8,76 |
| 50,05 | KOH | pH = 14+lg СT | 10,30 |
| 50,50 | KOH | « – » | 11,30 |
| 55,00 | КОН | « – » | 12,30 |
Скачок титрования находится в интервале значений рН 7,21–10,30. Для данного титрования подходят индикаторы: нейтральный красный (ΔрН = 6,8–8,4; рТ = 8,0), фенолфталеин (ΔрН = 8,2–10,0).
 |
| Рис. 4.6 Кривая титрования 0,20 моль/л раствора С6Н5СООН 0,40 моль/л раствором KOH |
Возможно использование фенолового красного (ΔрН = 6,8–8,4; рТ = 8,0) и тимолового синего (ΔрН = 8,0–9,6; рТ = 9,0). Интервалы перехода окраски выбранных индикаторов лежат в пределах скачка кривой титрования.
Титрование задачи как решать
При титровании H 2 SO 4 раствором KOH протекает реакция
Разделим левую и правую части уравнения на 2
Становится очевидным, что f э ( H 2 SO 4 )= 1 /2. Тогда молярная масса эквивалента серной кислоты равна
В соответствии с принципом эквивалентности число молей эквивалента титранта равно числу молей эквивалента определяемого вещества
где n ( NaOH ) – число молей эквивалента щелочи, затраченное на титрование аликвоты раствора щавелевой кислоты.
Запишем уравнение реакции, протекающей при титровании
Каждая молекула щавелевой кислоты содержит 2 иона водорода, поэтому f э ( H 2 C 2 O 4 × 2 H 2 O )= 1 /2. Из условия задачи следует, что
где V к – объем мерной колбы, в которой растворена навеска щавелевой кислоты; V а – объем аликвоты полученного раствора, отобранного пипеткой на титрование.
Если обозначить молярную концентрацию раствора гидроксида натрия C ( NaOH ), то количество вещества эквивалента NaOH можно выразить как
Объединяя полученные выражения, получаем
Титр T ( NaOH ) и титр по щавелевой кислоте T ( NaOH / H 2 C 2 O 4 ) в г/мл можно рассчитать по формулам

где M ( NaOH ) и M ( 1 /2 H 2 C 2 O 4 × 2 H 2 O ) – молярные массы эквивалента NaOH и щавелевой кислоты соответственно.

Ответ: 0,1038 моль/л; 0,004152 г/мл; 0,004673 г/мл.
где 
Сочетание этих соотношений дает
Подставляя числовые значения, получим
При титровании смеси с фенолфталеином протекает реакция
а в присутствии метилового оранжевого
При подстановке численных значений получим
Подставляя численные значения, получим
После охлаждения избыток щелочи оттитровали 20,12 мл раствора HCl с T ( HCl )=0,03798. Вычислить массовую долю (%) формальдегида в препарате пестицида.
В соответствии с принципом, лежащим в основе обратного титрования, количество молей эквивалента определяемого вещества равно разности между количеством молей эквивалента вещества в основном и вспомогательном рабочих растворах
Согласно условию задачи, выражаем число молей реагирующих веществ


Составим расчетное уравнение
Подставляя числовые значения, получаем