Артерия втк что это
Артерия втк что это
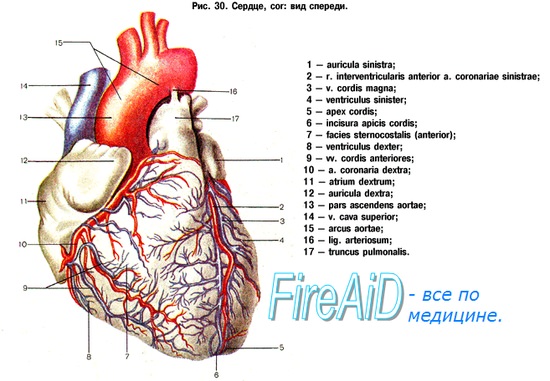
Оказывая помощь при ранениях сердца, хирург должен четко ориентироваться в топографии сосудов сердца, чтобы избежать нарушений его кровоснабжения при ушивании ран.
Артерии, вены и лимфатические сосуды сердца расположены в жировом слое эпикарда. В редких случаях небольшие участки коронарных артерий могут располагаться в глубине миокарда.
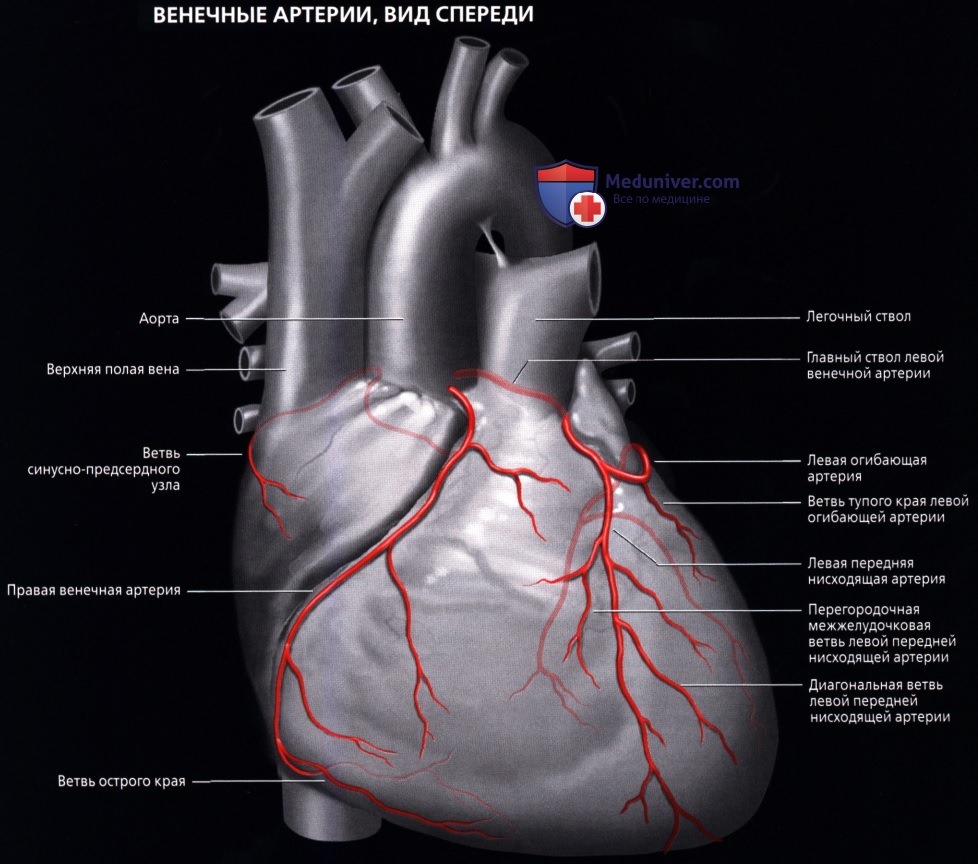
ПМЖА спускается но межжелудочковой борозде к верхушке сердца, давая диагональные ветви, снабжающие всю переднюю поверхность левого желудочка, часть передней стенки правого желудочка, а также ветви, идущие внутрь, к межжелудочковой перегородке и к передней папиллярной мышце.
Огибающая артерия идет практически горизонтально влево по предсердно-желудочковой борозде и дает многочисленные ветви, снабжающие боковую и заднюю стенки левого желудочка.
Правая коронарная артерия проходит между правым предсердием и правым желудочком спереди назад, продолжаясь в виде задней межжелудочковой артерии, достигающей верхушки сердца. Она питаетнижние и задние стенки обеих желудочков и заднюю треть межжелудочковой перегородки. Крупные ветви правой коронарной артерии (ветви острого края) — снабжают кровью переднюю стенку правого желудочка.
Коронарные вены следуют по ходу основных коронарных артерий, располагаясь более поверхностно, нежели артерии. Через коронарный синус венозная кровь возвращается в правое предсердие.
Лимфатические сосуды следуют также по ходу коронарных артерий и вен и впадают в крупный лимфатический коллектор средостения, а затем в грудной проток. Впрочем большого значения лимфосистема сердца при его ранении не имеет.
Учебное видео кровоснабжения сердца (анатомии артерий и вен)
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Артерии и вены сердца (ангиография, КТ).
Представлены коронарные артерии в латеральной проекции.
Анатомия коронарных артерий используемая при ангиографии.
Вены сердца
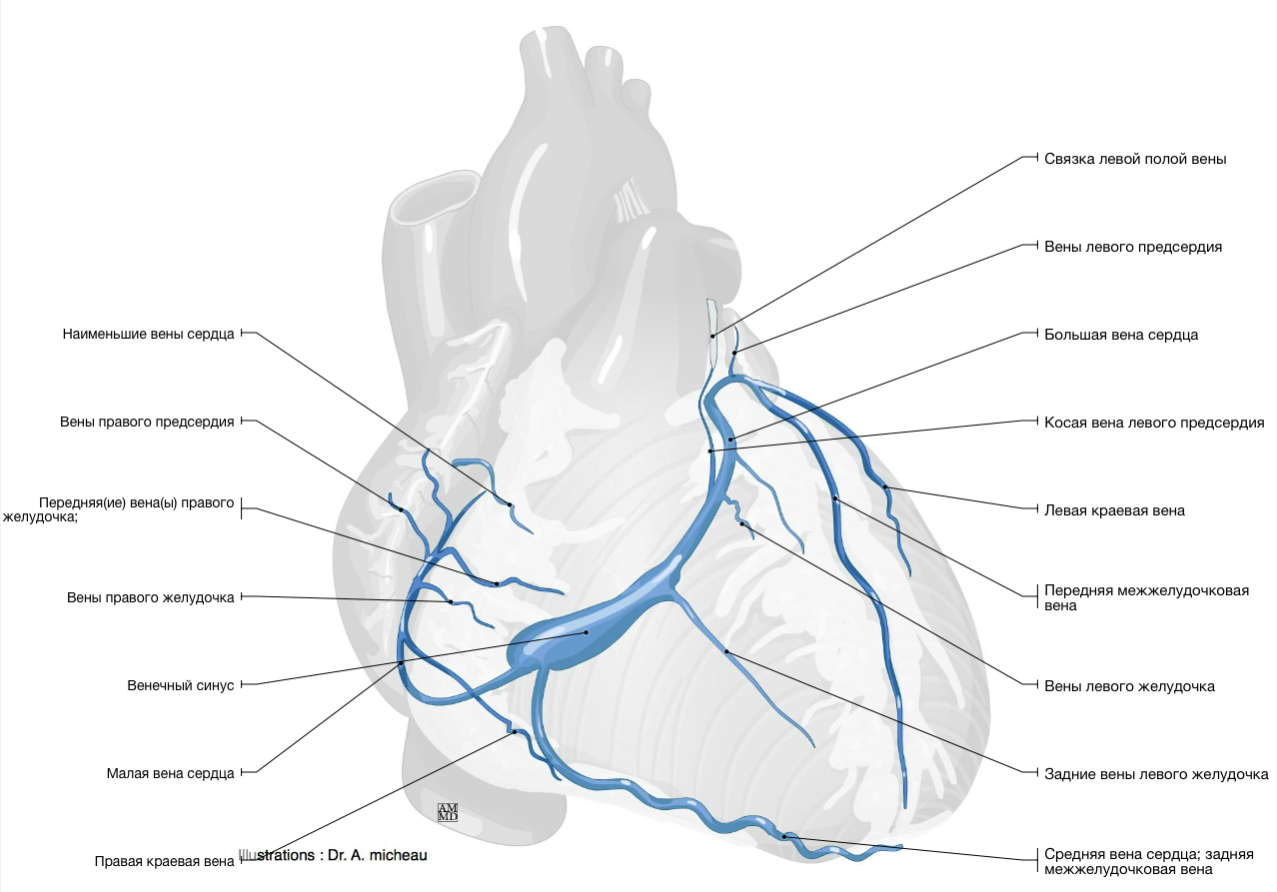
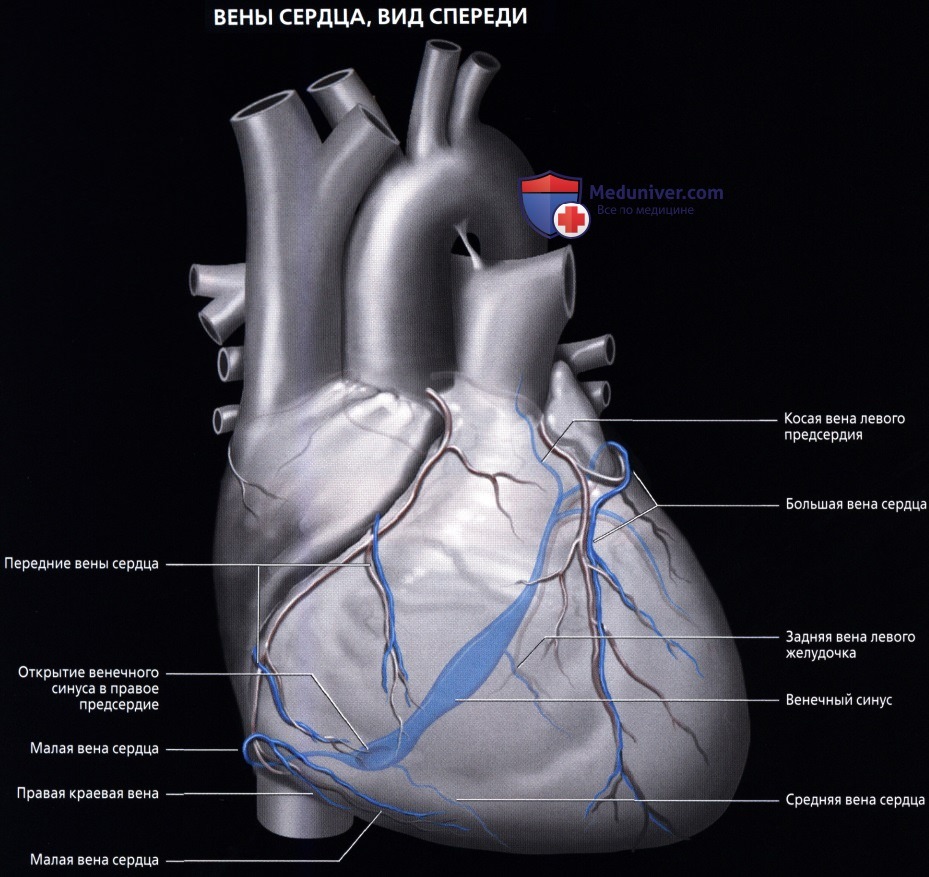
Вены сердца открываются не в полые вены, а непосредственно в полость сердца. Они начинаются в виде сетей, располагающихся в различных слоях его стенки. Венозное русло значительно преобладает над артериальным.
Венозный отток идет по трем путям: в венечный синус, sinus coronarius; в передние вены сердца; в малые вены Тебезия [Thebesian], впадающие непосредственно в правый отдел сердца.
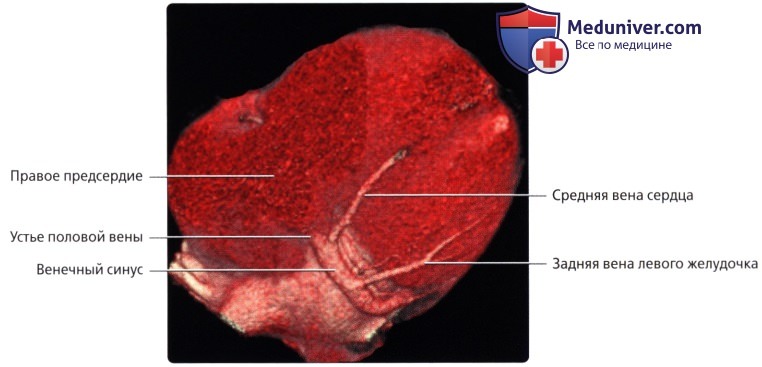
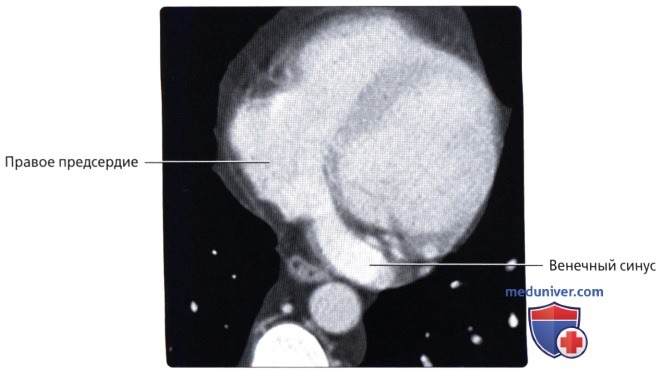
Венечный синус, sinus coronarius лежит сзади, в венечной борозде, и открывается в правое предсердие несколько ниже ствола нижней полой вены.
В венечный синус приносят кровь большая вена сердца, v. cordis magna, которая собирает кровь от передней поверхности обоих желудочков. Сначала она располагается в передней межжелудоч-ковой борозде, рядом с ramus interventricularis anterior левой венечной артерии, затем уходит под левое ушко и переходит на заднюю поверхность, где впадает (продолжается) в венечный синус.
Средняя вена сердца, v. cordis media, из задней межжелудочковой борозды переходит в венечную борозду и впадает в венечный синус справа. Кроме этих крупных вен, в венечный синус впадают малая вена сердца, v. cordis parva, задняя вена левого желудочка, v. posterior ventriculi sinistri, и косая вена левого предсердия, v. obliqua atrii sinistra [Marshall].
Передние вены сердца, vv. cordis anteriores, несут кровь от верхнего отдела передней стенки правого желудочка и впадают в правое предсердие.
Малые вены, vv. cordis minimae, собирают кровь в глубине стенок сердца и через множество отверстий впадают непосредственно в правое предсердие.
Артерия втк что это
а) Сокращения:
• Левая передняя нисходящая артерия (ЛПНА)
• Левая огибающая артерия (ЛОА)
• Задняя нисходящая артерия (ЗНА)
• Правая венечная артерия (ПКА)
• Заднелатеральная артерия (ЗЛА)
• Большая вена сердца (ВВС)
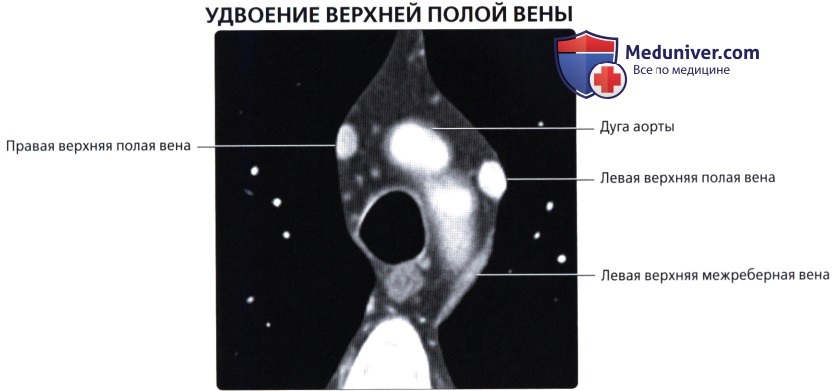
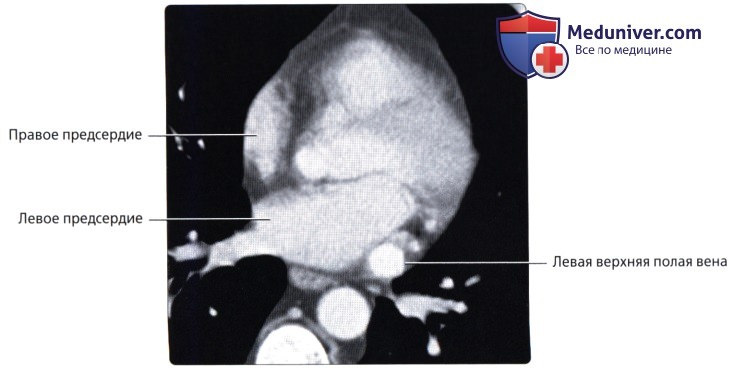
• Верхняя полая вена (ВПВ)
б) Определение:
• Венечная борозда: предсердно-желудочковая борозда
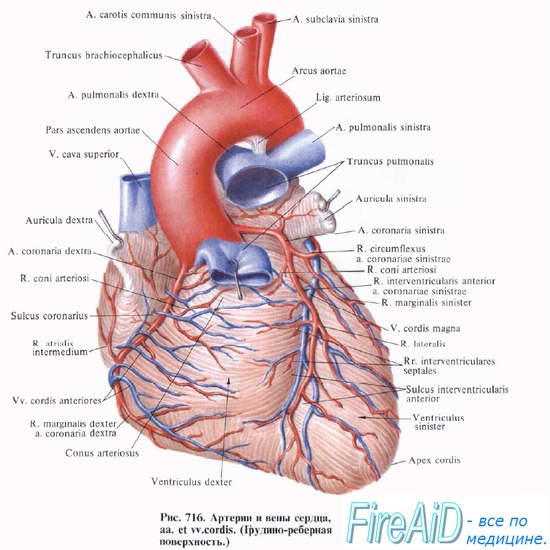
Артерии сердца
а) Венечные артерии:
• Правая и левая венечные артерии:
о Каждая отходит от соответствующего синуса аорты (синуса Вальсальвы)
• Ветви венечных артерий обычно считаются терминальными артериями:
о Сегменты миокарда кровоснабжаются преимущественно сегментарными ветвями венечных артерий о Возможно развитие коллатерального кровообращения
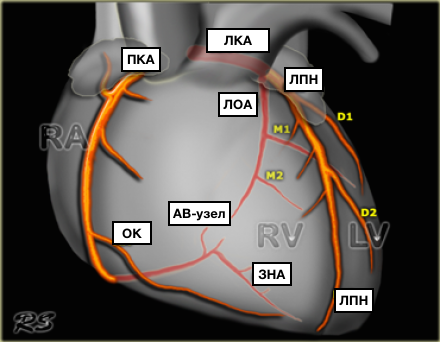
• Типы кровоснабжения сердца:
о Определяется артерией(-ями), отдающей ЗНА и ЗЛА:
— Правый тип кровоснабжения: ПКА отдает обеартерии(85% случаев)
— Левый тип кровоснабжения: ЛОА отдает обеартерии (7,5%)
— Сбалансированный (кодоминантный) тип кровоснабжения: ПКА отдает ЗНА, а ЛОА отдает ЗЛА (-7,5%)
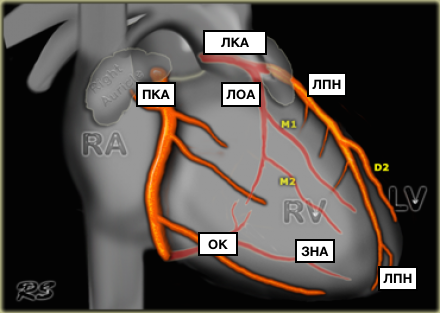
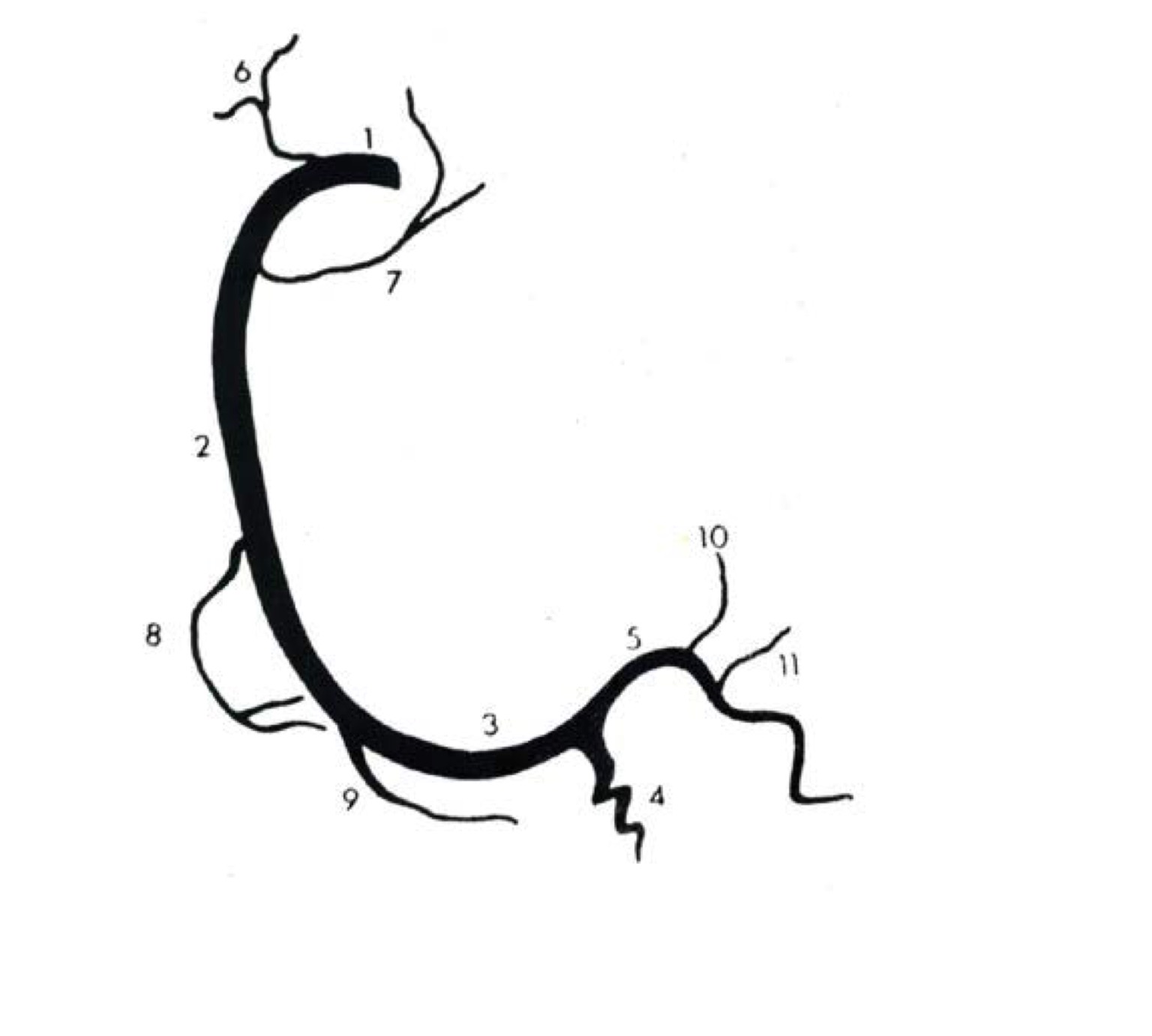
б) Левая венечная артерия:
• Начинается от левого венечного синуса (синуса Вальсальвы)
• Проходит влево, позади легочного ствола, и делится на ЛПНА и ЛОА
• Иногда делится на ЛПНА, ЛОА и промежуточную ветвь:
о Промежуточная ветвь: также, как и первая диагональная ветвь ЛПНА, проходит по направлению к передним отделам левого желудочка
• Может отсутствовать:
о ЛПНА и ЛОА разобщенно отходят от левого венечного синуса
• ЛПНА:
о Располагается в передней межжелудочковой борозде и оканчивается вблизи верхушки сердца:
— Диагональные ветви отходят к передней свободной стенке левого желудочка (нумеруются в порядке отхождения от ЛПНА):
— Перегородочные ветви отходят к передней межжелудочковой перегородке (нумеруются в порядке отхождения от ЛПНА)
• ЛОА:
о Располагается в левой венечной борозде:
— Ветви тупого края отходят к боковым отделам левого желудочка (нумеруются в порядке отхождения от ЛОА)
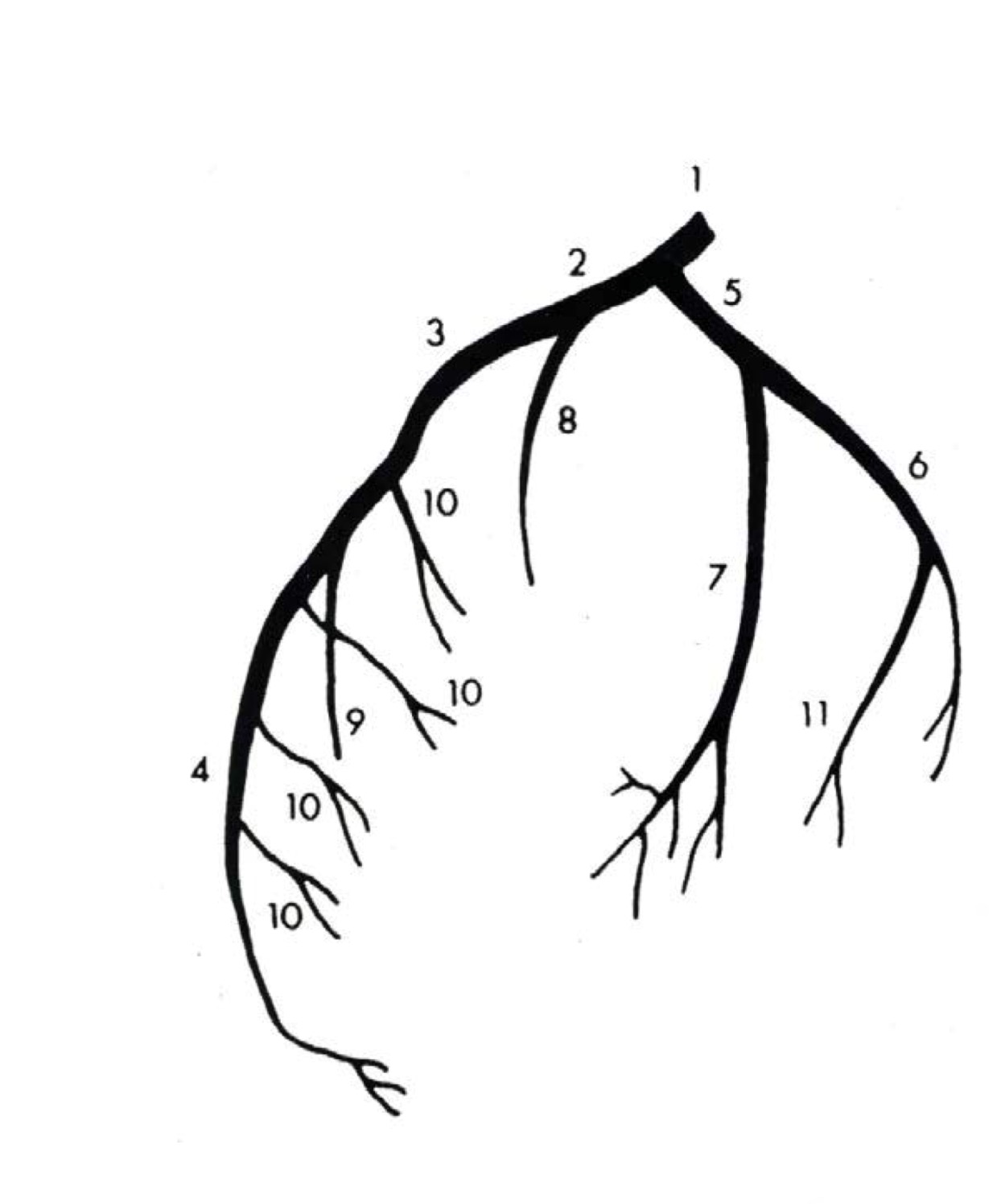
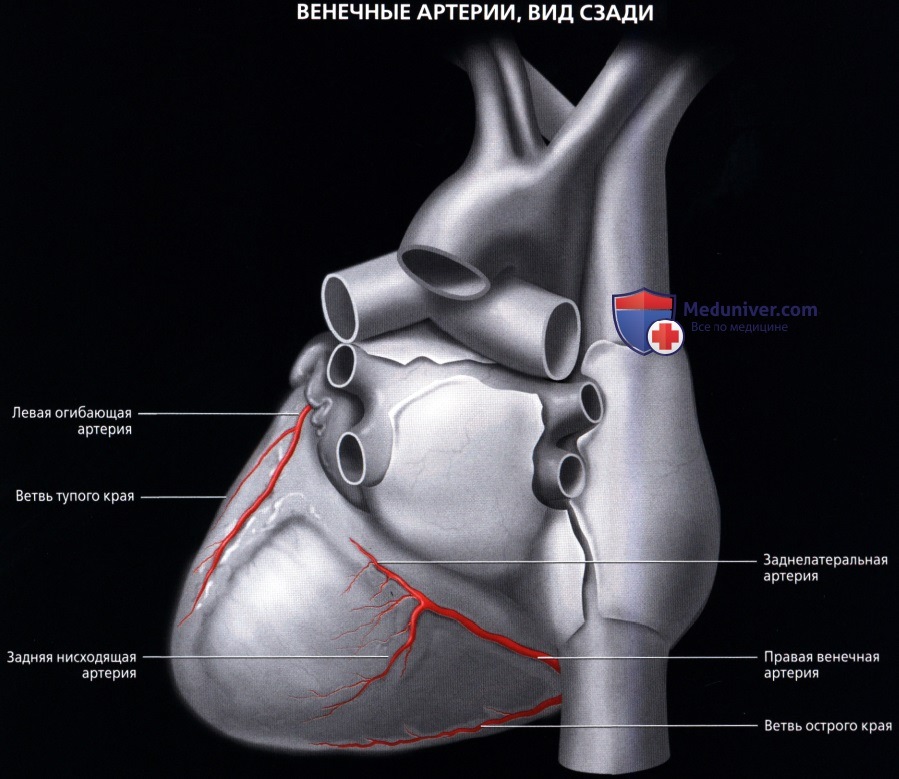
в) ПКА:
• Начинается от правого венечного синуса (синуса Вальсальвы)
• Проходит вправо, позади легочного ствола, затем книзу по правой венечной борозде
• Проходит в правой венечной борозде между правым предсердием и правым желудочком к задней части межжелудочковой перегородки
• Ветви ПКА:
о Ветвь артериального конуса:
— Первая ветвь ПКА:
— Может начинаться непосредственно от правого венечного синуса
— Кровоснабжает выносящий тракт легочного ствола
о Ветвь синусо-предсердного узла:
— У 60% лиц начинается от проксимального отдела ПКА
— Может начинаться от проксимального отдела ЛОА
— Кровоснабжает синусно-предсердный узел
о Передние ветви к свободной стенке правого желудочка
о Ветвь острого края:
— Начинается в месте перехода среднего сегмента ПКА в дистальный
— Кровоснабжает свободную стенку правого желудочка
о ЗНА:
— Терминальная ветвь ПКА
— Проходит по задней межжелудочковой борозде
— Может огибать верхушку сердца для кровоснабжения передней межжелудочковой перегородки при малой длине ЛПНА
о ЗЛА (ретровентрикулярная артерия):
— Одна из двух терминальных ветвей ПКА
— Возможны различные варианты: от полного отсутствия до значительной длины с большим количеством ветвей, кровоснабжающих часть бассейна ЛОА
о Ветвь предсердно-желудочкового (ПЖ) узла:
— Чаще всего отходит от ПКА в качестве дистальной ветви вблизи «креста» сердца
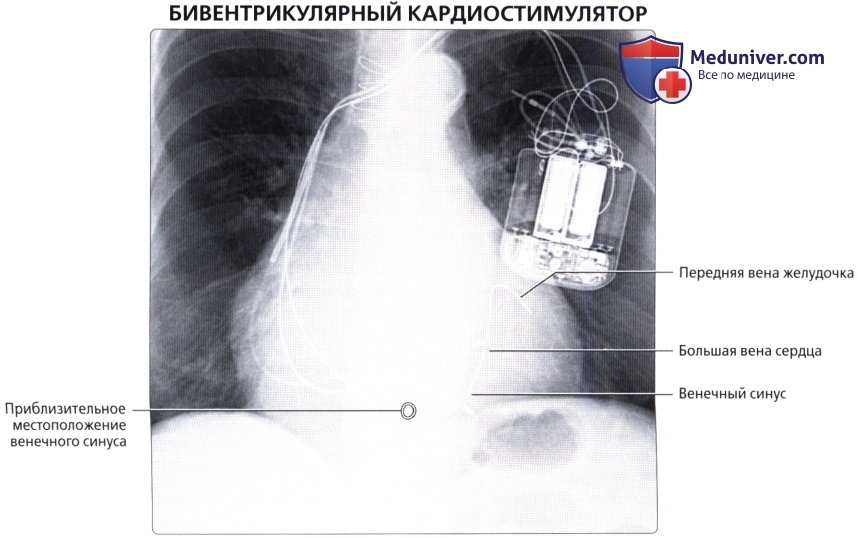
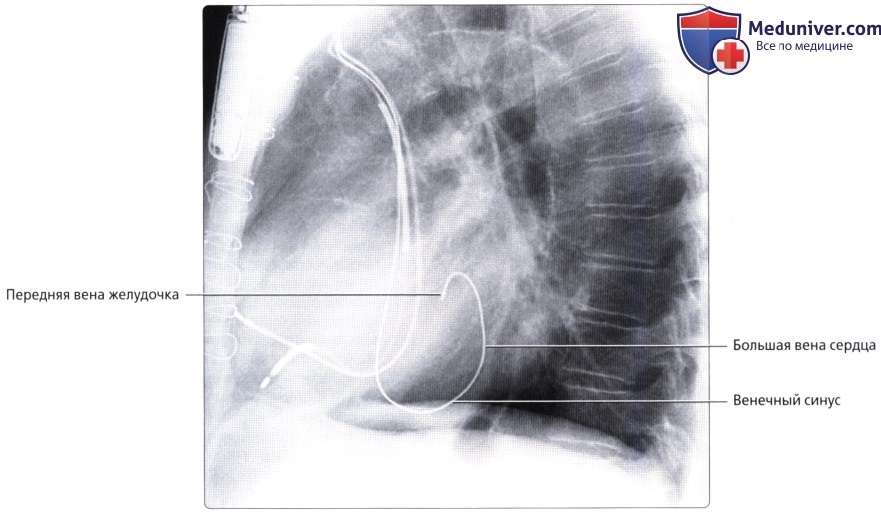
Вены сердца
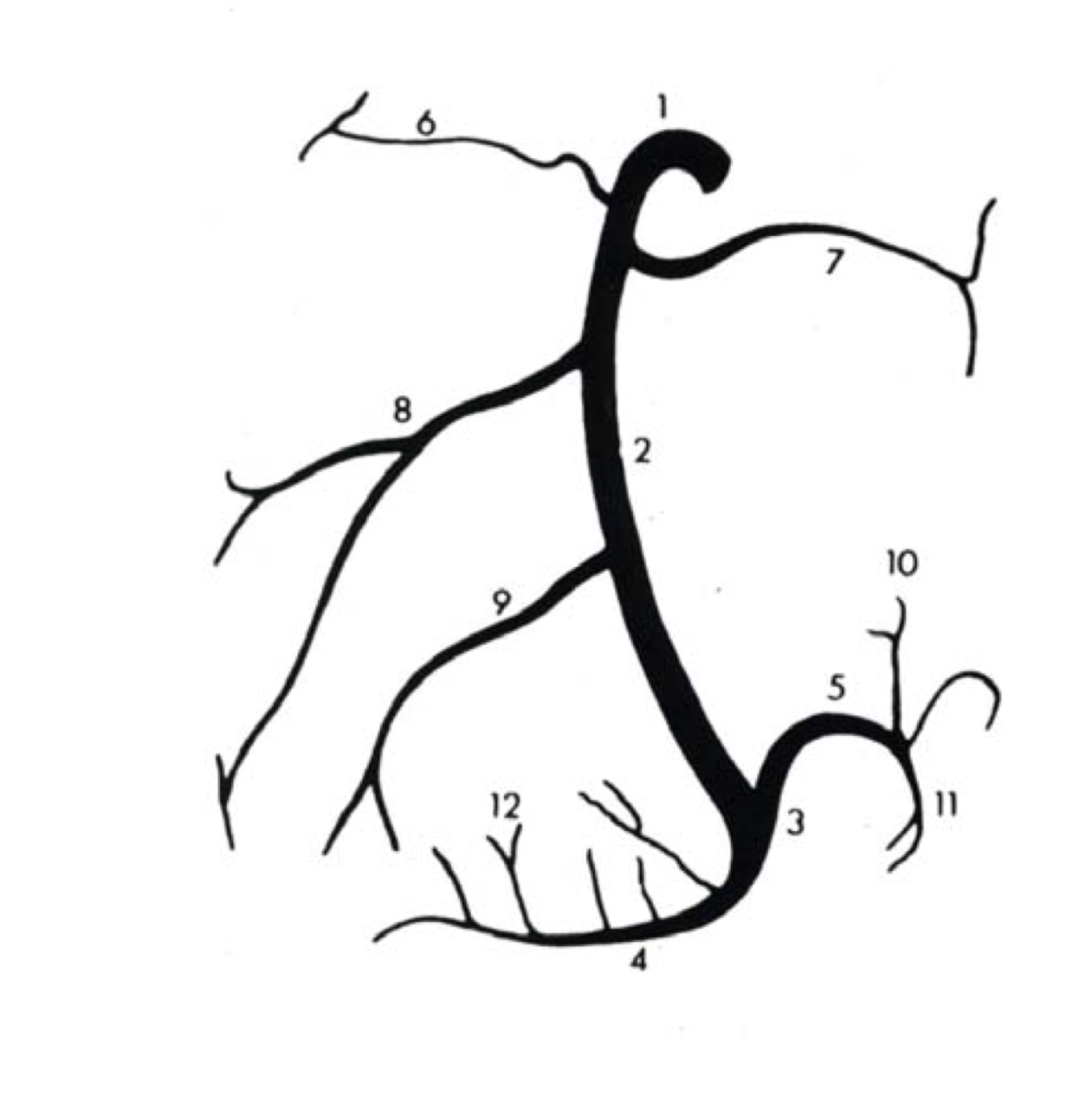
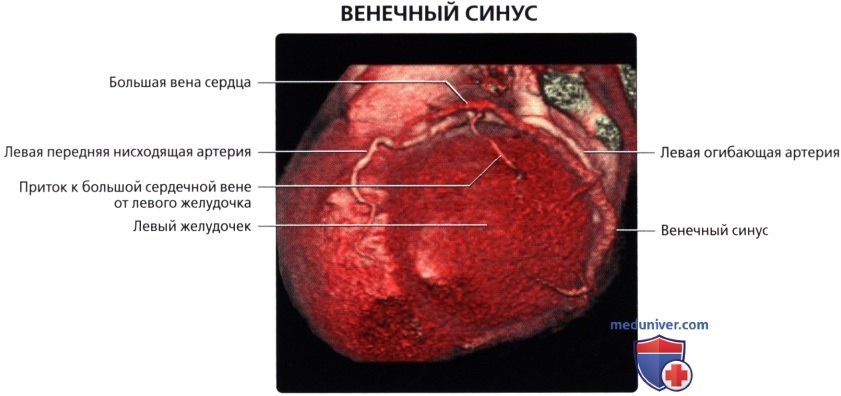
б) Венечный синус:
• Широкий венозный канал в задней части венечной борозды, который впадает в правое предсердие
• Является продолжением БВС:
о Продолжение БВС в венечный синус характеризуется присоединением косой вены левого предсердия (вены Маршалла) снаружи и заслонки Вьессена внутри
• БВС (левая венечная вена):
о Продолжение передней межжелудочковой вены
о Проходит вдоль левой предсердно-желудочковой борозды параллельно ЛОА
о В конечном итоге впадает в венечный синус
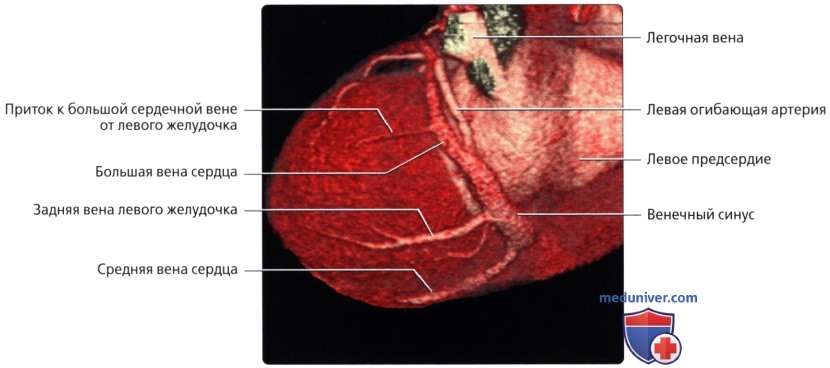
• Средняя вена сердца (задняя межжелудочковая вена):
о Лежит в задней межжелудочковой борозде рядом с ЗНА
о Впадает в нижнюю часть венечного синуса тотчас проксимальнее места его впадения в правое предсердие
• Малая вена сердца (правая венечная вена):
о Присутствует не всегда
о Сопровождает ветвь острого края
о Лежит в правой предсердно-желудочковой борозде
о Открывается в венечный синус или напрямую в полость правого предсердия
• Левая краевая вена:
о Проходит вблизи ветви тупого края вдоль боковых отделов левого желудочка
о Впадает в ВВС или непосредственно в венечный синус
• Задняя вена левого желудочка:
о Обеспечивает венозный отток от диафрагмальной и боковой стенок левого желудочка, и, в большинстве случаев, впадает в венечный синус
— В редких случаях вена также может впадать в ВВС
о Может быть одиночным крупным сосудом или состоять из нескольких вен меньшего размера
• Косая вена левого предсердия:
о Проходит по задней поверхности и левым отделам левого предсердия
о Расположена в рудиментарной складке, известной как связка Маршалла, которая является остатком зародышевой левой ВПВ о Может сохраняться в качестве левой ВПВ
Лучевая визуализация артерий и вен сердца
Рекомендации по визуализации:
• Катетеризационная ангиография остается «золотым стандартом» визуализации венечных артерий:
о Инвазивная процедура
о Главным преимуществом является возможность выполнять оперативные вмешательства на венечных артериях при обнаружении их стеноза
• КТ-коронарография набирает популярность как превосходная неинвазивная методика для визуализации венечных артерий
о Хорошая корреляция с катетеризационной ангиографией:
— Большинство исследований демонстрируют совпадение порядка ± 20%
— Имеет место тенденция переоценивать (а не недооценивать) степень стеноза просвета сосуда
о Высокие чувствительность, специфичность, точность и отрицательное прогностическое значение при ишемической болезни сердца:
— Ложноположительные результаты чаще всего встречаются при низком качестве изображений:
Двигательные артефакты
Высокий уровень «шума» на изображениях
о Особенно хорошо подходит для выявления аномалий развития венечных артерий:
— Возможности многоплоскостной визуализации
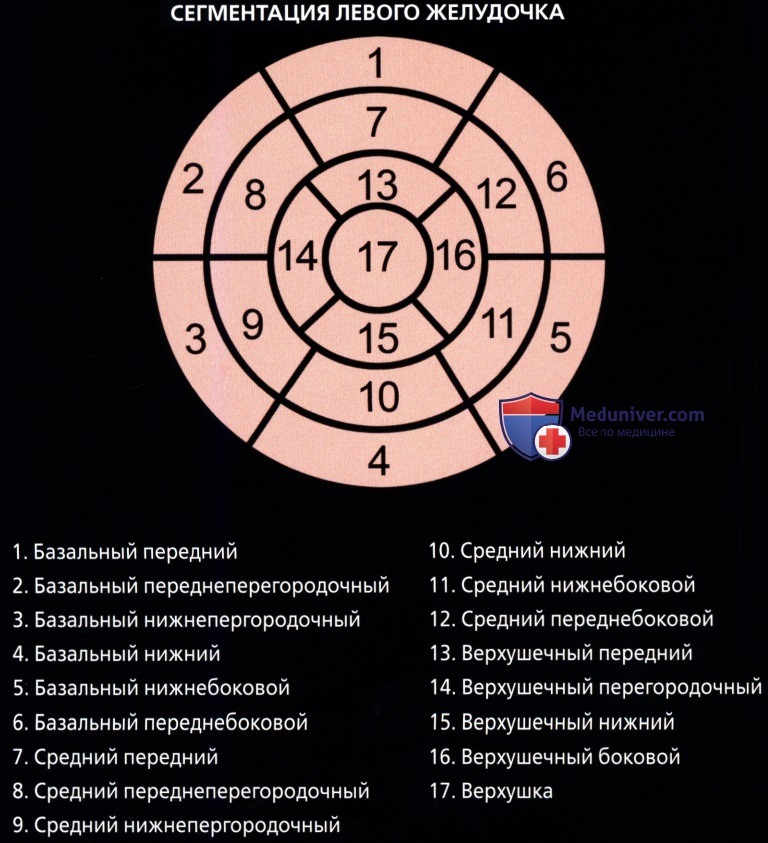
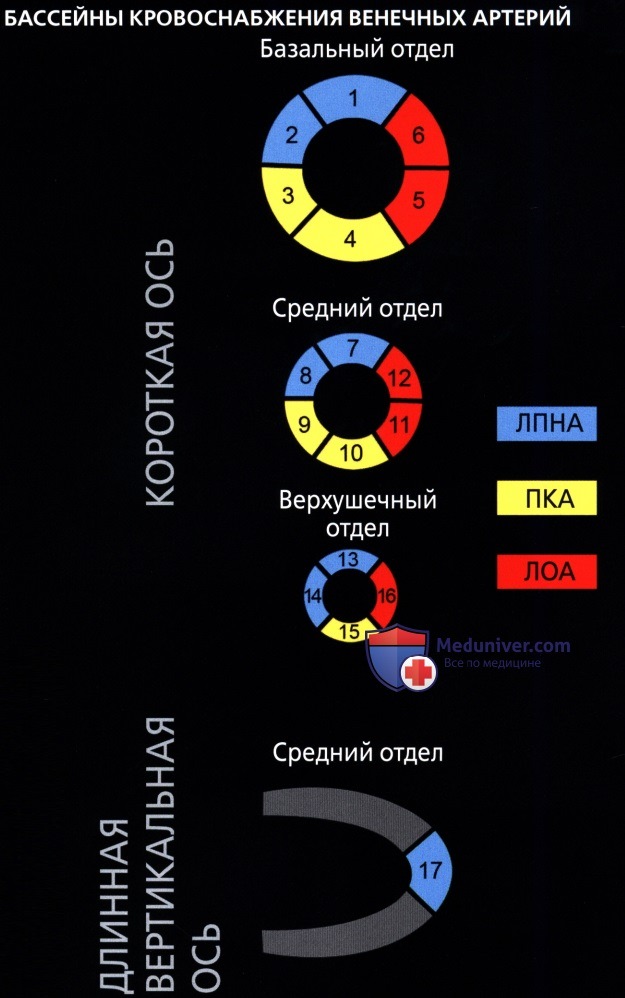
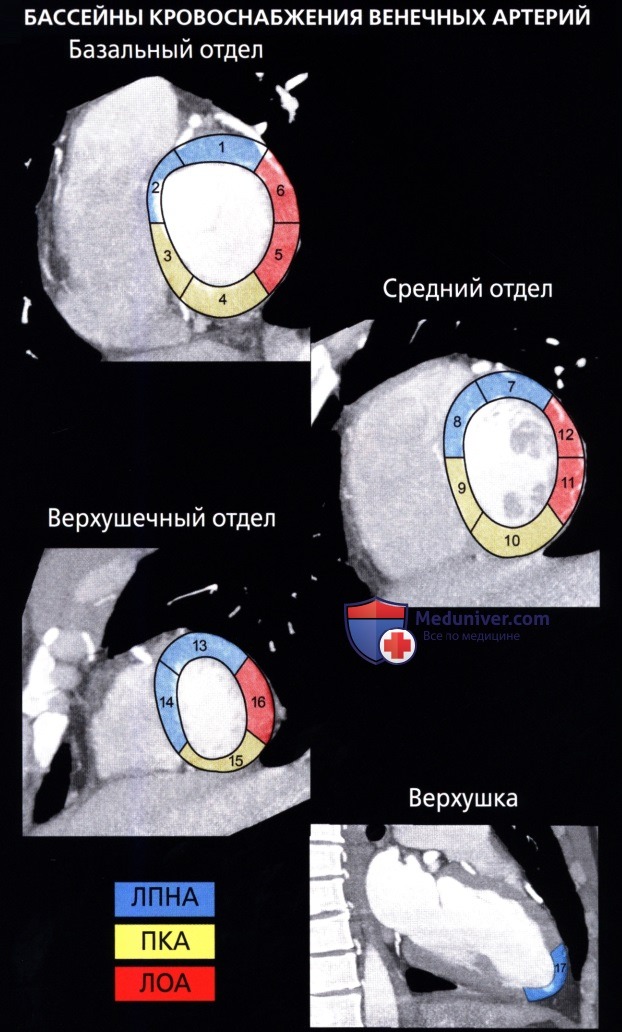
• Комитетом по визуализации сердца Консульства по клинической кардиологии Американской ассоциации сердца были приняты номенклатура и стандарт по сегментарному делению миокарда:
о Для левой стенки желудочка была принята стандартная 17-сегментная модель:
— Используется для оценки перфузии миокарда, функции левого желудочка и анатомии венечных сосудов
о На диаграмме типа «мишень» сегменты базального (сегменты 1-6) и среднего (сегменты 7-12) отделов занимают секторы по 60° каждый
о Сегменты верхушечного отдела (сегменты 13-16) занимают секторы по 90° каждый
о Верхушка сердца является сегментом 17
Анатомические варианты нормы и клинические особенности
б) Миокардиальный мостик:
• Наличие миокардиального тяжа, лежащего над сегментом венечной артерии
• Чаще всего локализуется на уровне среднего сегмента ЛПНА
Редактор: Искандер Милевски. Дата публикации: 16.4.2020
Наш опыт бифуркационного стентирования коронарных артерий у больных ишемической болезнью сердца с помощью стентов с антипролиферативным покрытием
Закарян Н.В., Панков А.С., Давтян А.Г.
Введение.
Бифуркационные сужения коронарных артерий по праву считаются одним из серьезных вызовов в практике эндоваскулярных хирургов. Несмотря на значительный прогресс при вмешательствах на подобных поражениях, многие вопросы остаются нерешенными. Главной проблемой остается высокая частота рестенозов в отдаленном периоде после стентирования; при этом избыточная пролиферация клеток стенки артерий затрагивает как основную, так и боковую ветви бифуркационных стенозов (1, 2, 3, 8, 10).
В современных условиях большинство интервенционных хирургов придерживается стратегии провизионального (“provisional”) Т-стентирования бифуркационных поражений. Суть техники заключается в имплантации стента в основную ветвь коронарной артерии с последующей одномоментной ангиопластикой по технике “kissing balloons” основной и боковой ветвей. Дополнительный стент в боковую ветвь устанавливается только в случае субоптимального ангиографического результата после “kissing”-дилатации (наличие резидуальных сужений или диссекций в боковой ветви). Тем не менее, существуют анатомические варианты, при которых предпочтительнее выглядят другие эндоваскулярные методики. Так, в случае наличия крупной боковой ветви в сочетании с поражением проксимальной трети этой артерии, выходящего за пределы устья, рекомендовано стентирование обеих ветвей. Наиболее частыми техниками бифуркационных вмешательств в такой ситуации являются “crush-”, “V-”, “kissing stent” и “culotte” – стентирование. На рис. 2 показаны данные исследований, сравнивающие отдаленные результаты использования подобных методик с результатами провизионального стентирования.
В ряде исследований продемонстрировано, что использование стентов с антипролиферативным покрытием способствует снижению риска развития рестенозов, а также уменьшению частоты повторных реваскуляризаций и неблагоприятных кардиальных событий по сравнению с непокрытыми стентами. Так, в рандомизированном исследовании SCANDSTENT показано, что частота кардиальных осложнений в отдаленном периоде (на протяжениии 3 лет) после бифуркационного стентирования коронарных артерий составляет 19, 3% при использовании стентов, покрытых сиролимусом, и 36, 5% при применении непокрытых устройств (3).
В последние годы на рынке появилось много различных стентов с антипролиферативным покрытием. Все ли они эффективны при коррекции бифуркационных поражений? В работе Latib et al. (2008) проводилось сравнение двух наиболее распространенных типов стентов – покрытых сиролимусом (“Cypher”) и паклитакселем (“Taxus”) при вмешательствах на коронарных бифуркациях. В этой работе отмечено, что существенной разницы между этими видами стентов по частоте рестеноза, тромбоза и уровню кардиальных осложнений в отдаленном периоде (3 года) после выполнения операций нет. Так, частота рестеноза в группе стентов с сиролимусом составила 20, 9% против 25, 9% в группе стентов, покрытых паклитакселем; частота кардиальных осложнений – 26, 7% против 25%, частота повторной реваскуляризации стентированных артерий – 12, 9% и 15, 1% соответственно (4). Сходные результаты получены и в других работах (3, 5).
По данным большинства исследований, использование стентов с антипролиферативным покрытием эффективнее непокрытых стентов практически во всех случаях бифуркационного стентирования (2, 7, 9). Продолжают вызывать споры некоторые ситуации, при которых отчетливого превосходства стентов с покрытием не было получено:
1) при острых инфарктах миокарда с сопутствующим высоким риском последующего тромбоза стента;
2) у пациентов с противопоказаниями к продолжительной двойной антиагрегантной терапии;
3) в случае короткого по длине поражения в крупной основной ветви (при анатомическом варианте, когда бифуркация не является истинной)
В отечественной литературе встречаются лишь единичные работы, посвященные изучению эффективности эндоваскулярных вмешательств у больных с бифуркационными поражениями коронарных артерий. Таким образом, проблема выбора стратегии эндоваскулярного лечения при данной патологии является чрезвычайно актуальной и требует дальнейшего изучения.
Материал и методы.
С мая 2004 г. по май 2015 г. в отделении рентгенохирургических методов исследования и лечения ФГУ “Клиническая больница №1” УД Президента РФ было выполнено 362 стентирования бифуркационных поражений коронарных артерий у 351 больного ИБС. Средний возраст пациентов составил 63 + 18 года, 224 (63, 8%) больных были мужского пола, 127 (36, 2%) – женского. У 319 (90, 9%) пациентов до вмешательства наблюдалась стабильная стенокардия 1-4 ФК по классификации ССS, стентирование при остром коронарном синдроме проводились у 32 (9, 1%) больных. Длительность клиники стенокардии варьировала от 2 месяцев до 6, 5 лет, в среднем составив 4 + 2, 1 года. Наличие сахарного диабета в анамнезе было отмечено у 31 (8, 8%) больного. Пациентов с фракцией выброса левого желудочка менее 40% было 20 (5, 7%). В анамнезе у 35 (10%) пациентов имелись эндоваскулярные вмешательства на коронарных артериях; операции коронарного шунтирования ранее проводились 4 (1, 1%) пациентам. Признаки хронической сердечной недостаточности различных степеней были обнаружены у 243 (69, 2%) больных (по классификации Нью-Йоркской ассоциации сердца).
Чаще всего выполнялось стентирование бифуркационных поражений передней межжелудочковой ветви (ПМЖВ) и диагональной ветви (ДВ) левой коронарной артерии – всего 256 (70, 7%) из 362 случаев. Огибающая артерия (ОА) и ее ветви (ВТК, ЗБВ, ЗМЖВ) были стентированы в 42 (11, 6%) случаях, правая коронарная артерия (ПКА) и ее ветви (ЗБВ, ЗМЖВ, ВОК) – в 31 (8, 6%). Также нами было проведено стентирование 33 (9, 1%) бифуркационных поражений, локализованных в стволе ЛКА (в сочетании с устьевыми поражениями ПМЖВ, ОВ или а. intermedia). Согласно классификации Medina, 284 (78, 5%) бифуркационных сужений из 362 являлись истинными.
Провизиональное Т-стентирование выполнялось в 324 (89, 5%) случаях (в 310 случаях – стентирование только основной ветви, в 14 – имплантация еще одного стента в боковую ветвь). Причинами установки дополнительных стентов оказались диссекция боковой ветви у 5 пациентов и субоптимальный результат после “kissing”-дилатации в 9 случаях. Стентирование по технике “culottes” было проведено у 21 (5, 8%) больного, по методике “crush”- у 13 (3, 6%). Относительно редко (у 4 (1, 1%) пациентов) нами применялось “V”-стентирование. В 356 (98, 3%) случаях после всех типов бифуркационных стентирований нам удалось выполнить финальную “kissing”-дилатацию, что является достаточно высоким показателем даже по сравнению с опытом ведущих мировых клиник. В 6 (1, 7%) случаях воспользоваться данной методикой не представилось возможным, т. к. у 4-х пациентов не удалось провести проводник в боковую ветвь через ячейки раскрытого стента, еще у 2-х больных возникли затруднения с доставкой в боковую ветвь баллонного катетера.
Результаты и обсуждение.
Хороший непосредственный клинический результат (отсутствие или уменьшение функционального класса стенокардии) был достигнут у 345 (98, 3%) из 351 пациента. Госпитальная летальность составила 0, 6%. У одного больного после провизионального стентирования бифуркации ПМЖВ-ДВ через несколько часов в реанимационном отделении развился обширный инсульт, через неделю пациент скончался. Еще один пациент с острым инфарктом миокарда скончался на следующий день после операции ввиду исходно тяжелого состояния, несмотря на технически успешно проведенное стентирование бифуркации ПМЖВ-ДВ. Нефатальные осложнения были представлены пульсирующими гематомами в области пункции. Всего было зафиксировано 11 (3, 1%) подобных осложнений, все они были корригированы консервативно с помощью мануальной компрессии.
В отдаленном периоде в сроки от 6 до 52 месяцев коронарография выполнялась 74 (21, 1%) пациентам. Отсутствие рестеноза в области стентированных бифуркационных сегментов было зафиксировано у 51 (68, 9%) пациентов. Клинически незначимые рестенозы были выявлены у 8 (10, 8%) пациентов. Во всех случаях они развивались в области устьев боковых ветвей и не требовали повторных вмешательств. Рестенозы, которые вызывали возврат стенокардии, были обнаружены у 15 (20, 3%) обследованных пациентов. Всем этим больным выполнялись повторные эндоваскулярные вмешательства с хорошим ангиографическим и клиническим результатом. У 11 из этих пациентов были проведены повторные баллонные дилатации по методике “kissing” без имплантации стентов с хорошим итоговым результатом. У 4 пациентов возникла необходимость в имплантации дополнительного стента, также с хорошими итоговыми клиническими и ангиографическими результатами.
Частота острых тромбозов составила 0, 6%. У 1 пациента после классического Т-стентирования с имплантацией 2-х стентов через 20 дней развилась клиника нестабильной стенокардии. На контрольной коронарографии был выявлен тромбоз стента в ЗБВ ПКА, экстренно выполнена ТЛБАП ЗБВ и ЗМЖВ ПКА и имплантация дополнительного стента в дистальную треть ПКА. Больной выписался из клиники с отсутствием стенокардии. Через 52 месяца у этого же пациента при контрольной коронарографии выявлены “in-stent” рестенозы ЗМЖВ ПКА 85% и ЗБВ ПКА 75%, по поводу которых выполнена поочередная баллонная дилатация ЗБВ и ЗМЖВ ПКА баллонами высокого давления; ввиду сохранения резидуального стеноза в ЗМЖВ ПКА с переходом на д/3 ПКА имплантирован стент “Promus” с итоговой “kissing”-дилатацией и хорошим результатом. Еще один острый тромбоз развился на 3 сутки у пациента после “crush”- стентирования бифуркации ПМЖВ-ДВ. Больной был экстренно взят в рентгеноперационную, выполнена реканализация и ТЛБАП окклюзированной ПМЖВ с хорошим итоговым результатом.
Заключение.
В нашей работе удалось подтвердить высокую эффективность бифуркационного стентирования коронарных артерий при помощи стентов с антипролиферативным покрытием. Предпочтительной методикой, рекомендованной в большинстве случаев, является провизиональное стентирование основной ветви, в случае необходимости дополняемое стентированием боковой ветви. Используя данный вид вмешательств, мы добились относительно низкой частоты рестенозов в отдаленном периоде при помощи стентов с лекарственным покрытием. При ряде анатомических вариантов мы применяли “crush”, “culottes” и “V”-методики стентирования, которые также характеризовались вполне приемлемыми клиническими и ангиографическими результатами. Тем не менее, окончательное мнение о роли этих методик при стентировании бифуркационных поражений будет сформулировано в дальнейших крупных рандомизированных исследованиях.
Список литературы.
Автор статьи:
Панков Алексей Сергеевич
врач по рентгенэндоваскулярным диагностике и лечению, к.м.н.