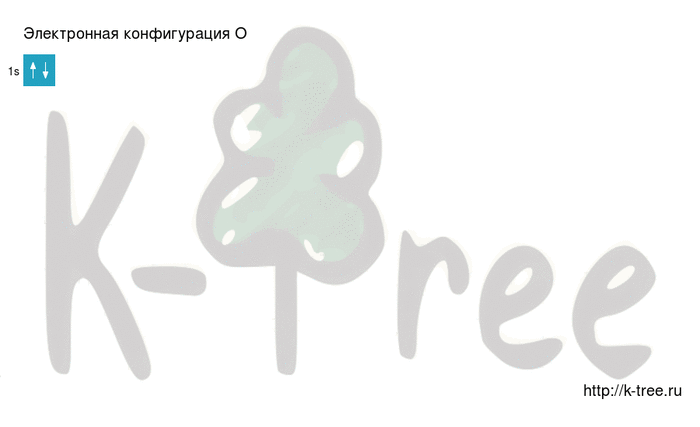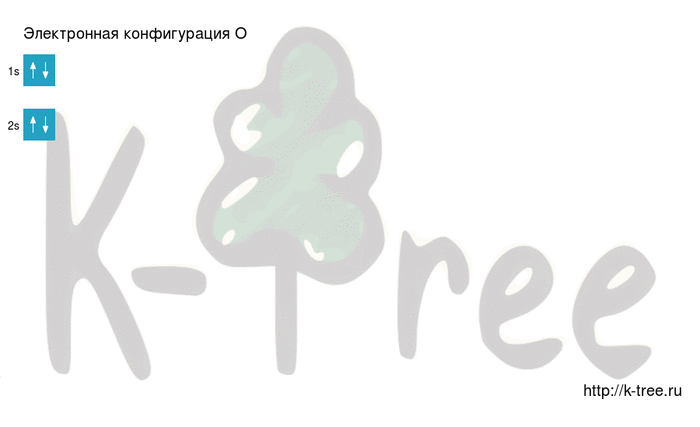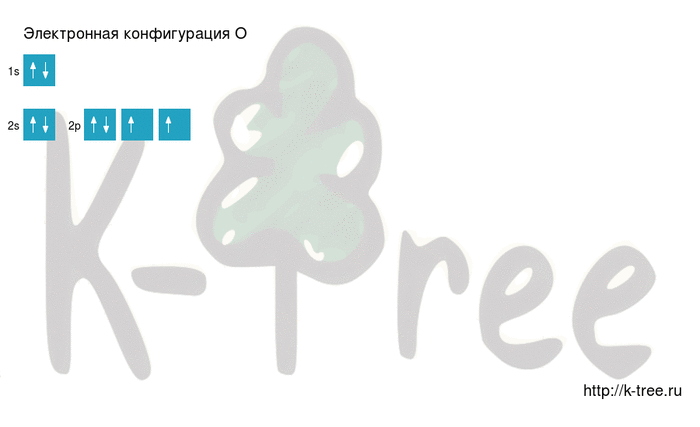какие степени окисления кислород проявляет в соединениях почему
Кислород: химия кислорода
Кислород
Положение в периодической системе химических элементов
Кислород расположен в главной подгруппе VI группы (или в 16 группе в современной форме ПСХЭ) и во втором периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение кислорода
Электронная конфигурация кислорода в основном состоянии :
+8O 1s 2 2s 2 2p 4 1s 

Атом кислорода содержит на внешнем энергетическом уровне 2 неспаренных электрона и 2 неподеленные электронные пары в основном энергетическом состоянии.
Физические свойства и нахождение в природе
Озон О3 — при нормальных условиях газ голубого цвета со специфическим запахом, молекула которого состоит из трёх атомов кислорода.
Кислород — это самый распространённый в земной коре элемент. Кислород входит в состав многих минералов — силикатов, карбонатов и др. Массовая доля элемента кислорода в земной коре — около 47 %. Массовая доля элемента кислорода в морской и пресной воде составляет 85,82 %.
В атмосфере содержание свободного кислорода составляет 20,95 % по объёму и 23,10 % по массе.
Способы получения кислорода
В промышленности кислород получают перегонкой жидкого воздуха.
Лабораторные способы получения кислорода:
Разложение перманганата калия:
Разложение бертолетовой соли в присутствии катализатора MnO2 :
2KClO3 → 2KCl + 3O2
Разложение пероксида водорода:
2HgO → 2Hg + O2
Соединения кислорода
| Степень окисления | Типичные соединения |
| +2 | Фторид кислорода OF2 |
| +1 | Пероксофторид кислорода O2F2 |
| -1 | Пероксид водорода H2O2 Пероксид натрия Na2O2 и др. |
| -2 | Вода H2O Оксиды металлов и неметаллов Na2O, SO2 и др. Соли кислородсодержащих кислот Кислородсодержащие органические вещества Основания и амфотерные гидроксиды |
Химические свойства
При нормальных условиях чистый кислород — очень активное вещество, сильный окислитель. В составе воздуха окислительные свойства кислорода не столь явно выражены.
1.1. Кислород реагирует с фтором с образованием фторидов кислорода:
С хлором и бромом кислород практически не реагирует, взаимодействует только в специфических очень жестких условиях.
1.2. Кислород реагирует с серой и кремнием с образованием оксидов:
1.3. Фосфор горит в кислороде с образованием оксидов:
При недостатке кислорода возможно образование оксида фосфора (III):
Но чаще фосфор сгорает до оксида фосфора (V):
1.4. С азотом кислород реагирует при действии электрического разряда, либо при очень высокой температуре (2000 о С), образуя оксид азота (II):
N2 + O2→ 2NO
1.5. В реакциях с щелочноземельными металлами, литием и алюминием кислород также проявляет свойства окислителя. При этом образуются оксиды:
2Ca + O2 → 2CaO
Однако при горении натрия в кислороде преимущественно образуется пероксид натрия:
2Na + O2→ Na2O2
А вот калий, рубидий и цезий при сгорании образуют смесь продуктов, преимущественно надпероксид:
K + O2→ KO2
Переходные металлы окисляются кислород обычно до устойчивых степеней окисления.
Цинк окисляется до оксида цинка (II):
2Zn + O2→ 2ZnO
2Fe + O2→ 2FeO
4Fe + 3O2→ 2Fe2O3
3Fe + 2O2→ Fe3O4
при недостатке кислорода образуется угарный газ СО:
2C + O2 → 2CO
Алмаз горит при высоких температурах:
Горение алмаза в жидком кислороде:
Графит также горит:
Графит также горит, например, в жидком кислороде:
Графитовые стержни под напряжением:
2. Кислород взаимодействует со сложными веществами:
4FeS + 7O2→ 2Fe2O3 + 4SO2
Ca3P2 + 4O2→ 3CaO + P2O5
2.2. Кислород окисляет бинарные соединения неметаллов:
2H2S + 3O2→ 2H2O + 2SO2
Аммиак горит с образованием простого вещества, азота:
4NH3 + 3O2→ 2N2 + 6H2O
Аммиак окисляется на катализаторе (например, губчатое железо) до оксида азота (II):
4NH3 + 5O2→ 4NO + 6H2O
CS2 + 3O2→ CO2 + 2SO2
2CO + O2→ 2CO2
2.3. Кислород окисляет гидроксиды и соли металлов в промежуточных степенях окисления в водных растворах.
Кислород окисляет азотистую кислоту :
2.4. Кислород окисляет большинство органических веществ. При этом возможно жесткое окисление (горение) до углекислого газа, угарного газа или углерода:
CH4 + 2O2→ CO2 + 2H2O
2CH4 + 3O2→ 2CO + 4H2O
CH4 + O2→ C + 2H2O
Также возможно каталитическое окисление многих органических веществ (алкенов, спиртов, альдегидов и др.)
Степень окисления кислорода
Общие сведения о степени окисления кислорода
Природный кислород состоит из трех стабильных изотопов 16 O (99,76%), 17 O (0,04%) и 18 O (0,2%).
Наиболее устойчива двухатомная молекула кислорода O2. Она парамгнитна и слабо поляризуется. Температуры плавления (-218,9 o С) и кипения (-183 o С) кислорода очень низкие. Кислород плохо растворяется в воде. При нормальных условиях кислород представляет собой газ без цвета и запаха.
Жидкий и твердый кислород притягивается магнитом, т.к. его молекулы парамагнитны. Твердый кислород синего цвета, а жидкий – голубого. Окраска обусловлена взаимным влиянием молекул.
Кислород существует в виде двух аллотропных модификаций – кислорода O2 и озона O3.
Степень окисления кислорода в соединениях
Кислород образует двухатомные молекулы состава O2 за счет наведения ковалентных неполярных связей, а, как известно, в соединениях с неполярными связями степень окисления элементов равна нулю.
В соединении состава OF2 кислород проявляет положительную степень окисления равную (+2), поскольку фтор является самым электроотрицательным элементом и его степень окисления всегда равна (-1).
В качестве производного, в котором кислород проявляет степень окисления(+4), можно рассматривать аллотропическую модификацию кислорода – озон O3 (O +4 O2).
Примеры решения задач
| Задание | Укажите степени окисления углерода в соединениях: CH4, C2H6, C2H4, C2H2, CHOH, CO, CO2. |
| Решение | Известно, что степень окисления углерода в соединениях органической природа равна (-4). Если рассчитывать её значение по уравнению электронейтральности, то получим, что в молекулах CH4, C2H6, C2H4, C2H2, CHOH она равна (-4), (-3), (-2), (-1) и 0, соответственно. |
Степень окисления кислорода в оксидах равна (-2), значит степень окисления углерода в CO и CO2 будут равны (+2) и (+4), соответственно.
Степень окисления
Темы кодификатора ЕГЭ: Электроотрицательность. Степень окисления и валентность химических элементов.
Степень окисления – это вспомогательный условный заряд атома элемента в соединении, вычисленный из предположения, что все соединения состоят из ионов (все полярные связи – ионные).
Что значит «условный заряд»? Мы просто-напросто договариваемся, что немного упростим ситуацию: будем считать любые полярные связи полностью ионными, и будем считать, что электрон полностью уходит или приходит от одного атома к другому, даже если на самом деле это не так. А уходит условно электрон от менее электроотрицательного атома к более электроотрицательному.
Наверняка, у вас возник вопрос — зачем же придумывать то, чего нет? Это не коварный замысел химиков, все просто: такая модель очень удобна. Представления о степени окисления элементов полезны при составлении классификации химических веществ, описании их свойств, составлении формул соединений и номенклатуры. Особенно часто степени окисления используются при работе с окислительно-восстановительными реакциями.
Степени окисления бывают высшие, низшие и промежуточные.
Высшая степень окисления равна номеру группы со знаком «плюс».
Низшая определяется, как номер группы минус 8.
И промежуточная степень окисления — это почти любое целое число в интервале от низшей степени окисления до высшей.
Для нахождения степеней окисления используют следующие правила :
Примеры :
Задание: определите степени окисления элементов в молекуле дихромата калия: K2Cr2O7.
В бинарных соединениях более электроотрицательный элемент характеризуется отрицательной степенью окисления, менее электроотрицательный – положительной.
Обратите внимание, что понятие степени окисления – очень условно! Степень окисления не показывает реальный заряд атома и не имеет реального физического смысла. Это упрощенная модель, которая эффективно работает, когда нам необходимо, например, уравнять коэффициенты в уравнении химической реакции, или для алгоритмизации классификации веществ.
Степень окисления – это не валентность! Степень окисления и валентность во многих случаях не совпадают. Например, валентность водорода в простом веществе Н2 равна I, а степень окисления, согласно правилу 1, равна 0.
Это базовые правила, которые помогут Вам определить степень окисления атомов в соединениях в большинстве случаев.
В некоторых ситуациях вы можете столкнуться с трудностями при определении степени окисления атома. Рассмотрим некоторые из этих ситуаций, и разберем способы их разрешения:
Потренируемся определять степень окисления атомов в органических соединениях. Для этого необходимо нарисовать полную структурную формулу атома, и выделить атом углерода с его ближайшим окружением — атомами, с которыми он непосредственно соединен.
Какие степени окисления кислород проявляет в соединениях почему
§3.7 Окислительно-восстановительные свойства элементов. Степень окисления.
Передача электронов от атома к атому называется окислением-восстановлением. Окисляется тот атом, который отдает свои электроны, а принимающий электроны – восстанавливается.
Таблица 3-4. Ионы, находящиеся в каждой вертикальной колонке, имеют одинаковое электронное строение, совпадающее с электронной оболочкой одного из инертных газов.
1s 2 2s 2 2p 6 3s 2 3p 6
Количество отданных или принятых атомом электронов называется степенью окисления атома в молекуле.
Можно продолжить это определение:
При связывании разных атомов степень окисления равна заряду, который приобрел бы атом в этом соединении, если бы оно могло состоять из ионов.
Довольно просто определять степень окисления в ионных соединениях, где сразу видно, откуда и куда перешли электроны. Из табл. 3-4 видно, что знак и величина степени окисления всегда совпадают со знаком и зарядом одноатомных ионов.
Например, при взаимодействии магния с кислородом образуется ионное соединение Mg 2+ O 2– (где 2+ и 2– заряды ионов магния и кислорода, табл. 3-4). Посмотрите видеоопыт из «Единой коллекции цифровых образовательных ресурсов» – горение магния в кислороде.
Степень окисления магния составляет +2, а степень окисления кислорода составляет –2. Точно так же в соединении CaCl 2 степень окисления кальция +2, а степень окисления хлора –1.
Сложнее обстоит дело с полярными ковалентными соединениями. Здесь на помощь приходит знание относительной электроотрицательности элементов. Например, в молекуле воды Н 2 О кислород более электроотрицателен, чем водород, поэтому электроны связей смещены в сторону кислорода. Если бы вода была ионным соединением, то ее формулу можно было бы записать так:
Можно дать еще одно определение степени окисления:
Степень окисления – это условный заряд атома в молекуле или кристалле. Его определяют, условно считая все полярные связи полностью ионнымии.
Второй заряд «–» не может появиться на атоме кислорода потому, что кислород не в состоянии оттянуть электроны от своего соседа – точно такого же атома кислорода. Вывод: степень окисления кислорода в этом соединении составляет –1 (хотя его валентность по-прежнему II). Степень окисления водорода составляет +1.
Степень окисления и валентность несут разную информацию об атоме в его соединениях. Валентность просто характеризует способность атома образовывать некоторое количество химических связей, а степень окисления описывает смещения электронов при образовании химических связей.
Итак, уточним определение степени окисления с учетом всего того, что было сказано о ковалентных соединениях:
СТЕПЕНЬ ОКИСЛЕНИЯ выражают числом частично или полностью смещенных электронов от одного атома к другому в их соединении.
Если атом отдал электроны, его степени окисления приписывается знак “+”, а если атом принял электроны, то знак “–”. Возможна и нулевая степень окисления атома в молекуле, если электроны никуда не смещались или число отданных и принятых электронов одинаково.
Степень окисления – очень важная величина, относящаяся к основным понятиям химии. Фактически, степень окисления описывает состояние атома в соединении.
Есть несколько полезных правил, которые касаются степеней окисления:
1) Степень окисления атома любого элемента в свободном состоянии равна нулю.
2) Степень окисления любого простого одноатомного иона равна его заряду. Примеры:
3) Степень окисления водорода в его соединениях с другими элементами равна +1.
5) Алгебраическая сумма степеней окисления всех атомов в формуле нейтрального соединения всегда равна нулю.
6) Если в ходе химической реакции степень окисления атома повышается, то говорят, что он ОКИСЛЯЕТСЯ. Если же степень окисления понижается, то говорят, что он ВОССТАНАВЛИВАЕТСЯ.
Действие этого правила можно показать и на примере реакции серы с кислородом, в которой электроны формально переходят от одного атома к другому:
Подобных реакций с изменением степеней окисления реагирующих атомов – огромное множество. Все вместе они называются окислительно-восстановительными реакциями.
В последующих главах мы рассмотрим эти реакции подробнее, а пока еще раз разберемся в новых терминах.
Просто так трудно запомнить, какой процесс – отдачи или захвата электронов – называется окислением, а какой – восстановлением. Какой атом приобретает отрицательную, а какой – положительную степень окисления.
Рис. 3-11. Не совсем обычная запись уравнения химической реакции: Na + Cl = NaCl (см. текст). Хлор – «отрицательный», он отбирает чужие электроны. Натрий «окислился» – это заметно по его кислой физиономии.
Кому-то из вас поможет рис. 3-11, который рассказывает о реакции между натрием и хлором так, как будто это случилось в «химическом детском саду». В этом “детском саду” порядки такие же, как и в обычном. У Хлора целых 7 игрушек (электронов). Натрию же достался только грузовичок (1 электрон). Тут Хлор увидел у Натрия грузовичок и решил, что именно этой игрушки ему и не хватает! Хлор посильнее, поэтому грузовичок мгновенно оказался у него. А чтобы Натрий не ябедничал (у него такой окислившийся вид!), Хлор предложил поиграть вместе. Какое там! Конечно же, все 8 игрушек Хлор подтащил поближе к себе, а Натрию только и остается, что стоять рядом с “окисленным” видом.
** 3.26. Численное значение степени окисления, как вы знаете, может не совпадать с валентностью элемента. Ниже приведены структурные формулы нескольких соединений углерода. Напишите их молекулярные формулы и, пользуясь правилами для определения степеней окисления, определите степени окисления атомов углерода в каждой молекуле:
Кислород O
Кислород в таблице менделеева занимает 8 место, в 2 периоде.
| Символ | O |
| Номер | 8 |
| Атомный вес | 15.9990300 |
| Латинское название | Oxygenium |
| Русское название | Кислород |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема кислорода
Порядок заполнения оболочек атома кислорода (O) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
Кислород имеет 8 электронов, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
4 электрона на 2p-подуровне
Степень окисления кислорода
Ионы кислорода
Валентность O
Атомы кислорода в соединениях проявляют валентность II, I.
Валентность кислорода характеризует способность атома O к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа O
Квантовые числа определяются последним электроном в конфигурации, для атома O эти числа имеют значение N = 2, L = 1, Ml = 2, Ms = ½
Видео заполнения электронной конфигурации (gif):
Результат:
Энергия ионизации
Перейти к другим элементам таблицы менделеева