какие таблетки содержат дроспиренон
Микродозированная оральная контрацепция с дополнительными возможностями
Представлена эффективность использования микродозированного комбинированного орального контрацептива, содержащего в своем составе дроспиренон. Использование данного препарата расширяет возможности применения гормональной контрацепции. Рассматриваются отли
The effectiveness of the microdose hormonal contraceptive containing drospirenone is described. Use of this drug enhances potential of hormonal contraception application. The distinctive features of the drug: reduction in severity of side effects; positive effects were considered.
Гормональная контрацепция в настоящее время — это не только один из путей сохранения репродуктивного здоровья женщины, но и средство профилактики и лечения ряда гинекологических заболеваний.
Что, помимо высокой контрацептивной эффективности, хорошей переносимости, улучшения общего самочувствия, простоты применения, молодые женщины XXI века ожидают от современных оральных контрацептивов (ОК)? Отсутствие повышения веса — 69,9%; профилактику дисменореи, мастодинии, предменструального синдрома (ПМС) и предменструального дисфорического расстройства (ПМДР) — 57,1%; положительное влияние на кожу, себорею и вульгарные угри — 49,7%; хороший контроль цикла — 55,0% [1].
Этим требованиям соответствовала эволюция прогестинов в составе ОК от препаратов первого, второго и третьего поколения до уникального прогестина XXI века, препарата четвертого поколения, отвечающего основным требованиям: отсутствие глюкокортикоидных и андрогенных эффектов.
Гестагены, являющиеся производными различных соединений, включают в себя большой диапазон стероидов с прогестероноподобным действием [2]. В большинстве ОК гестаген, применяемый в соответствующей дозировке, предотвращает наступление беременности путем подавления овуляции. Кроме этого локальные изменения вязкости шеечной слизи препятствуют проникновению сперматозоидов через цервикальный канал. За последнее десятилетие были синтезированы новые гестагены для использования в составе ОК [3]. Главной целью было создание гестагена, который сочетал бы в себе преимущества прогестерона с более эффективным прогестагенным и антиэстрогенным воздействием на эндометрий вместе с выраженным антигонадотропным влиянием и без какого-либо взаимодействия с андрогенными, эстрогенными или глюкокортикоидными рецепторами для предотвращения нежелательных лекарственных реакций [4]. В итоге за полувековую историю развития гормональной контрацепции [16, 17] наиболее важный прогресс в эволюции ОК был достигнут благодаря введению новых более современных прогестинов.
Дросперинон (ДРСП) — новый прогестаген, входящий в состав монофазного микродозированного ОК. Это — антиминералокортикоидный гестаген, произодное спиронолактона [5–7]. Благодаря своей антиминералокортикоидной активности этот гестаген способен контролировать уровень повышения ангиотензиногена, обусловленный действием этинилэстрадиола (ЕЕ), когда обе эти молекулы объединены в противозачаточном препарате. Предотвращая трансактивацию минералокортикоидных рецепторов (МР), сочетание ДРСП и ЕЕ приводит к выведению воды и натрия и небольшому уменьшению массы тела по сравнению с классическими оральными контрацептивами предыдущих поколений, содержащими комбинацию ЕЕ и левоноргестрела или его производных [8]. ДРСП также проявляет антиандрогенную активность, хотя и меньшую, чем ципротерона ацетата (ЦПА), однако достаточную, чтобы быть полезной женщинам с акне [9]. ДРСП в комбинации с ЕЕ вызывает высокий рост глобулинов, связывающих половые гормоны (ГСПГ). Поэтому, кроме использования в контрацепции, сочетание ДРСП и ЕЕ оказалось полезным в лечении умеренно выраженной угревой сыпи, оказывающей значительное негативное влияние на качество жизни подростков и возникающей в результате жирной кожи и расширения пор. Антиандрогенный эффект дроспиренона обусловлен тем, что он переносится альбуминами и не вытесняет тестостерон из связи с ГСПГ, снижает синтез андрогенов яичниками, блокирует андрогенные рецепторы кожи и волосяных фолликулов, не препятствует повышению синтеза ГСПГ, вызванного эстрогенами.
Дроспиренон — единственный прогестагенный компонент ОК, утвержденный для лечения эмоциональных и физических симптомов ПМДР. Эффективность доказана в двойных слепых, плацебо-контролируемых, многоцентровых исследованиях (параллельная и перекрестная модели) [1, 10]. Также в проведенных ранее исследованиях было отмечено положительное влияние на кровяное давление и индекс массы тела [11, 12]. У женщин, принимавших ОК, в состав которых входил ДРСП, не было выявлено отрицательного влияния на фертильность [13, 11].
Идеальная фармакокинетика двух компонентов препарата обеспечивает быстрое достижение максимальной концентрации в сыворотке крови после введения: этинилэстрадиол — 1,5 часа, дроспиренон — 1,7 часа [14].
При приеме первых высокодозированных средств стероиды не выводились полностью из организма в течение 7-дневного перерыва, и поэтому выработка фолликулостимулирующего гормона (ФСГ) и лютеинизирующего гормона (ЛГ) была подавлена и во время перерыва в приеме комбинированных оральных контрацептивов (КОК). В этом причина успеха «старого» режима. Прогрессивное снижение доз этинилэстрадиола и прогестинов в КОК способствовало появлению опасений, связанных с возможным увеличением частоты нарушений цикла и снижением эффективности в случае типичного применения таких низких доз в режиме 21/7, да еще и с возможными «ошибками пользователя». Микродозированный ОК с ДРСП применяется с первого дня менструального цикла в режиме 24 + 4 (24 — активные + 4 — плацебо).
Обоснованиями сокращения безгормонального интервала являются следующие положения: неблагоприятные симптомы значительно ярче выражены в течение 7 безгормональных дней, чем в течение 21 дня терапии активными таблетками при стандартном режиме 21 + 7; низкие дозы этинилэстрадиола и прогестина в современных ОК меньше подавляют овариальную активность, чем высокодозированные ОК в течение стандартного 7-дневного безгормонального интервала, — нет риска синдрома гиперторможения функции гипофиза; повышение уровня ФСГ в течение безгормонального интервала приводит к росту фолликулов и выработке эстрадиола — прорывным кровотечениям; основной синтез андрогенов происходит в 7-дневный перерыв — снижение эффективности лечения дерматопатий.
Необходимо отметить, что, несмотря на пропущенные в начале цикла таблетки, более выраженное подавление овариальной активности наблюдалось при приеме комбинации 20 мкг этинилэстрадиола с дроспиреноном в режиме 24 + 4 по сравнению с использованием низкодозированных (30 мкг ЕЕ) ОК в режиме 21/7. Подавление овариальной функции при применении режима 24 + 4 после плановых ошибок приема препарата было таким же, как в группе режима 21/7 при регулярном безошибочном приемe [15]. Откорректированный индекс Перля составляет 0,44. Микродозированный ОК с ДРСП обеспечивает хороший контроль менструального цикла, такой же, как другие 20 мкг и 30 мкг оральные контрацептивы.
Известно, что себорея и вульгарные угри оказывают значительное негативное влияние на качество жизни молодых женщин. Aнтиандрогенная активность дроспиренона обеспечивается тем, что нет противодействия повышению под возможным влиянием этинилэстрадиола уровня ГСПС, снижается секреция андрогенов в яичниках, происходит антагонистическое влияние на андрогенные рецепторы в коже. Благодаря антиандрогенному и антиминералокортикоидному эффекту дроспиренона уменьшаются изменения голоса, связанные с гормональными колебаниями в течение менструального цикла. Кроме этого, благодаря снижению уровня тестостерона, на фоне дроспиренона + 20 мкг EE отмечается стабильность характеристик вибрации голосовых связок. Не прибавляется и даже снижается масса тела [10].
Таким образом, на фоне приема нового ОК с современным режимом использования, созданного на основе дроспиренона — уникального прогестина четвертого поколения и микродозы ЕЕ, суммарная частота нежелательных лекарственных реакций ничтожна. При этом микродозированный ОК с ДРСП обладает высокой контрацептивной эффективностью, хорошо переносится, имеет ряд преимуществ, таких как уменьшение выраженности симптомов ПМДР, угревой сыпи, акне, себореи при практическом отсутствии влияния на массу тела у молодых женщин.
Литература
А. Л. Тихомиров, доктор медицинских наук, профессор
ГБОУ ВПО МГМСУ им. А. И. Евдокимова МЗ РФ, Москва
Какие таблетки содержат дроспиренон
ФГБУ “Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова” Минздравсоцразвития России, Москва
Сегодня гормональная контрацепция – это не только средство профилактики незапланированной беременности, но и эффективный метод лечения гинекологических заболеваний. Это стало
возможным благодаря тому, что в современных комбинированных препаратах значительно уменьшена доза гормональных компонентов, осуществлен синтез прогестагенов с высокой селективностью к рецепторам прогестерона, разработаны новые пути введения гормонов, изменена продолжительность и кратность схем применения и т. д., что дает реальную возможность для индивидуализации лечения.
Применение современных контрацептивных средств, особенно гормональных, женщинами, не нуждающимися в них, является сегодня не только новой главой в истории контрацепции, но и
новым направлением в гинекологии (David Serfaty, 2011).
Интенсивные исследования и разработки в области гормональной контрацепции в течение последних лет, казалось бы, сделали невозможным дальнейшее улучшение гормональных контрацептивов. Следует подчеркнуть, что контрацептивное действие гормональных препаратов обусловлено в основном действием прогестагенов, эстрогены лишь потенцируют тормозящий эффект прогестагенов
на овуляцию на уровне гипоталамо-гипофизарно-яичниковой системы.
Таким образом, сосредоточив внимание в первую очередь на дополнительных неконтрацептивных эффектах гестагенов, ученые в 1980 г. разработали прогестаген диеногест, не содержащий этинильной группы в положении 17α, который сочетает преимущества производных прогестерона и 19-норстероидов, а в 2000 г. – совершенно новый прогестаген, являющийся производным спиронолактона, – дроспиренон [1].
В настоящее время синтезирована масса разнообразных прогестагенов, что открывает широкие возможности для индивидуального выбора гормонального препарата. Прогестагены относятся к стероидным гормонам. По химической классификации их подразделяют на производные прогестерона (хлорамдинона ацетат, медроксипрогестерона ацетат, ципротерона ацетат), производные 19-нортестостерона, подразделяющиеся на эстраны (норэтинодрел, норэтинодрон, этинодиола диацетат) и гонаны (левоноргестрел, дезогестрел, норгестимат, гестоден), а также диеногест, объединяющий преимущества производных прогестерона и 19-норстероидов, и производные спиронолактона (дроспиренон) [2]. Производные прогестерона не обладают контрацептивным действием при приеме внутрь.
Механизм действия прогестагенов связан с воздействием на стероидные рецепторы. Существует пять типов стероидных рецепторов: для глюкокортикоидов, минералокортикоидов, эстрогенов, гестагенов и андрогенов. Прогестерон и прогестагены специфически связываются с гестагенными рецепторами, но могут в той или иной мере связываться и с другими типами стероидных рецепторов, что определя-
ет особенности их действия. Так, прогестерон помимо гестагенных рецепторов связывается с минералокортикоидными рецепторами, что обусловливает его антиминералокортикоидное действие, медроксипрогестерона ацетат – с глюкокортикоидными рецепторами, поэтому он обладает небольшой глюкокортикоидной активностью, ряд гестагенов (ципротерона ацетат, хлорамдинон, диеногест) связываются с андрогенными рецепторами [1].
Таким образом, спектр фармакологической активности любого прогестагена определяется выраженностью гестагенного эффекта, наличием или отсутствием антиандрогенной, антиэстрогенной, антиминералокортикоидной активности, зависящих от его химической структуры.
Дроспиренон – первый синтетический прогестин, используемый в комбинированных гормональных препаратах, который не является производным половых стероидов, а синтезируется на основе 17α-спиронолактона и химически похож на мочегонный и антигипертензивный препарат – спиронолактон. В отличие от других прогестинов он обладает антиминералокортикоидной и антиандрогенной активностью. А его фармакологический профиль к эндогенному прогестерону ближе, чем у любого другого синтетического прогестина, используемого сегодня. Дроспиренон ингибирует овуляцию путем супрессии синтеза лютеинизирующего гормона. Он также предотвращает оплодотворение путем замедления транспорта сперматозоидов через изменения в шейке матки и цервикальной слизи, препятствует имплантации, т. к. вызывает атрофию эндометрия.
Дроспиренон препятствует овуляции в зависимости от дозы. Результаты ряда рандомизированных исследований, проведенных с участием здоровых менструирующих женщин, показывают, что оптимальная доза дроспиренона для приема внутрь составляет 3,0 мг. В этих исследованиях применение комбинации 3,0 мг дроспиренона и 30 мкг этинилэстрадиола полностью подавляло овуляцию. Как и эндогенный прогестерон, дроспиренон оказывает антиминералокортикоидное действие на ренин-ангиотензин-альдостероновую систему. Антиминералокортикоидная
активность 3,0 мг дроспиренона сравнима с таковой 25 мг спиронолактона, таким образом, антиминералокортикоидная активность дроспиренона в 8 раз выше, чем у спиронолактона.
Дроспиренон и ципротерона ацетат проявляют свою антиандрогенную активность в терапевтических дозах. Как и 2,0 мг ципротерона ацетата/35 мкг этинилэстрадиола, комбинация дроспиренон/этинилэстрадиол уменьшает выработку андрогенов яичниками и себореи у женщин с мягкой и умеренной выраженностью акне в двойном слепом рандомизированном исследовании [3]. Антиандрогенная активность дроспиренона составляет около 30 % активности ципротерона
ацетата. Доклинические исследования показали, что дроспиренон не имеет эстрогенной, андрогенной, глюкокортикоидной или антиглюкокортикоидной активности. Особые свойства молекулы дроспиренона, связанные с отсутствием этинильного радикала, а именно более эффективное воздействие на прогестероновые рецепторы, отсутствие угнетающего действия на печеночные ферменты системы цитохромов (Р450), определяют его дополнительные преимущества.
Ярким примером может служить применение дроспиренон-содержащих препаратов пациентками с синдромом поликистозных яичников (СПКЯ) – патологией структуры и функции яичников, основными критериями которого являются овуляторная дисфункция и гиперандрогения. Синдром поликистозных яичников встречается от 4 до 8 % в женской популяции фертильного возраста и является одной из наиболее распространенных эндокринопатий [4]. Синдром является ведущей причиной ановуляторного бесплодия, кожных проявлений гиперандрогении (гирсутизма, акне), а также связан с
высоким риском развития сахарного диабета 2 типа и сердечно-сосудистой патологии [5]. Вместе с тем до настоящего времени его этиология неизвестна, терапия носит симптоматический характер. Диагностика СПКЯ требует дифференциального подхода и исключения сходной нозологии. Детальное
обследование и выявление основных симптомов СПКЯ, а также исключение сходных по клинике заболеваний необходимы для постановки диагноза.
Многочисленные нарушения обмена веществ при СПКЯ могут приводить к ряду заболеваний, в т. ч. и
раку эндометрия. Длительное влияние эстрогена на эндометрий при дефиците прогестерона является частой причиной гиперплазии эндометрия, что в отсутствие лечения может прогрессировать до карциномы эндометрия даже у молодых женщин. Стратегия сокращения риска рака при СПКЯ
включает использование комбинированных оральных контрацептивов (КОК), адекватное консультирование по поводу диеты, снижение массы тела, физические нагрузки. Лечение СПКЯ вне планирования беременности заключается в коррекции кожных проявлений гиперандрогении (гирсутизма, акне, алопеции), регуляции менструального цикла, профилактике смертности от сердечно-сосудистых заболеваний (лечение метаболических расстройств). При СПКЯ у женщин, не планирующих беременность, микродозированные КОК, содержащие дроспиренон, являются препаратом первой линии, т. к. дроспиренон является метаболически нейтральным прогестином, не вмешивающимся в углеводный и жировой обмен.
Многочисленные исследования показали, что дроспиренон-содержащие контрацептивы можно рассматривать как средства, характеризующиеся хорошей переносимостью и высокой контрацептивной эффективностью (индекс Перля 0,7) [6, 7]. В одном известном крупном многоцентровом исследовании с участием 11 тыс. женщин, проведенном в 2004 г. в 15 странах Европы, было показано достоверное улучшение общего самочувствия женщин, что проявлялось уменьшением симптомов задержки жидкости и изменений настроения, связанных с циклом, а также улучшением состояния кожи [8]. В другом исследовании было показано значимое уменьшение задержки жидкости и булимии в период, предшествующий менструации, а также улучшение настроения у женщин к 6-му циклу приема дроспиренон-содержащего КОК [6].
Таким образом, обобщая вышеприведенные данные, можно выделить следующие основные преимущества дроспиренона:
• антиминералокортикоидный эффект (уменьшает задержку натрия и воды, в результате не оказывает
влияния на массу тела, не вызывает масталгии и оказывает лечебный эффект при предменструальном
синдроме);
• гестагенный эффект (надежная блокада овуляции и контроль цикла);
• антиандрогенный эффект (лечение акне и себореи) [9].
На сегодняшний день в России только три препарата содержат в качестве гестагенного компонента дроспиренон: Ярина (дроспиренон 3 мг, этинилэстрадиол 30 мкг), Джес (дроспиренон 3 мг, этинилэстрадиол 20 мкг) и не так давно зарегистрированный Мидиана (дроспиренон 3 мг, этинилэ-
страдиол 30 мкг).
Хотелось бы привести результаты применения Мидианы, полученные нашими коллегами и нами в НЦ
АГиП МЗСР РФ. В исследование И.Б. Манухина и соавт. были включены 54 женщины в возрасте 16–40 лет (средний возраст – 26,0 ± 1,6 года), из них 34 до этого принимали другие оральные контрацептивы (ОК) и 20 – впервые начали использовать ОК. Препарат применяли в течение 6 циклов (всего 324 цикла). Для уменьшения частоты ациклических кровянистых выделений у пациенток, впервые использовавших ОК, авторы рекомендовали применять препарат с 5-го по 25-й день цикла с дополнительной барьерной контрацепцией в 1-м цикле. Контрацептивная надежность составила 100 %. Кроме того, оценивали характер побочных эффектов, частота которых была выше у пациенток, впервые принявших гормональную контрацепцию. Ациклические кровянистые выделения отмечены лишь в 4 % случаев. Частота циклов с прорывными кровотечениями составила всего 0,3 %. Прибавка массы тела (на 1–2 кг) отмечена у 5 (9,3 %) женщин, в основном это были начинающие пользователи
ОК. А у 28 % женщин (все из “переключившихся” с других ОК), было отмечено снижение массы тела на фоне приема Мидианы. Авторы отметили и другие побочные эффекты, такие как масталгия, головная боль, изменение настроения, тошнота, но они возникали крайне редко. Все побочные эффекты купировались в первые несколько месяцев приема препарата, не оказав существенного влияния
на переносимость и приверженность лечению. Только 1 (1,9 %) женщина в связи с продолжавшимися прорывными кровотечениями отказалась от использования препарата. Таким образом, небольшая частота побочных эффектов (11 %) на фоне приема нового препарата Мидиана свидетельствует о его хорошей переносимости и высокой контрацептивной эффективности [10].
Наши предварительные данные, основанные на применении Мидианы 32 женщинами репродуктивного возраста, свидетельствуют о хорошей переносимости препарата, надежном контроле цикла и отсутствии случаев отказа от его применения. Длительность применения препарата
составила 6 месяцев.
Таким образом, увеличение арсенала дроспиренон-содержащих соединений с внедрением препарата Мидиана позволяет надеяться на дальнейшее расширение возможностей их применения в практике врача акушера-
гинеколога.
Литература
Научная электронная библиотека
8.2. Современные методы плановой контрацепции
8.2. Современные методы плановой контрацепции

Девиз Всемирного дня контрацепции (World Contraception Day), 2012
8.2.1. В настоящем – оральная контрацепция Комбинированные оральные контрацептивы
На сегодняшний день КОК являются наиболее популярным методом контрацепции (Bitzer J. et al., 2011). К КОК относятся препараты, каждая таблетка которых содержит в своем составе эстрогенный и прогестагенный компонент. Контрацептивный эффект обеспечивает прогестаген, который подавляет выработку гонадотропин-рилизинг гормонов. Для обеспечения контроля цикла (предотвращение межменструальных кровянистых выделений) к прогестагенам добавляют эстроген (поэтому они называются комбинированными).
Эстрогены. В качестве эстрогенного компонента в состав КОК входят либо этинилэстрадиол (ЕЕ) – синтетический аналог эстрадиола, либо идентичные естественному гормону 17β-эстрадиол (Е2) и эстрадиола валерат (E2В).
Фармакологическое действие ЕЕ – эстрогенное, анаболическое, гиполипидемическое. Взаимодействует со специализированными эстрогенными рецепторами в клетках-мишенях. Быстро абсорбируется через слизистые оболочки и кожу. Подвергается гепатоэнтеральной рециркуляции, сопровождающейся эффектом «первого прохождения» через печень. Эстрадиол (Е2) является наиболее мощным природным эстрогеном, который секретируется яичниками, однако Е2 обладает низкой активностью при пероральном приеме. Добавление этиниловой группы в положении 17 делает молекулу ЕЕ высоко активной, а также изменяет ее свойства, что препятствует связыванию с глобулином, связывающим половые гормоны, делает ее устойчивой к ферментативному расщеплению с помощью 17-бета-гидроксилазы и придает более высокое сродство к рецептору эстрогена.
Без присутствия гестагенов ЕЕ оказывает эстрогенное влияние и вызывает пролиферацию эндометрия, стимулирует развитие матки и вторичных женских половых признаков. Будучи в составе КОК, ЕЕ поддерживает пролиферацию эндометрия и обеспечивает контроль цикла (отсутствие промежуточных кровотечений при приеме КОК). Кроме того, ЕЕ необходим для замещения эндогенного эстрадиола, поскольку при приеме КОК нет роста фолликула и, следовательно, эстрадиол в яичниках не вырабатывается.
Основные клинические различия между современными КОК, к которым можно отнести индивидуальную переносимость, частоту побочных реакций, особенности влияния на метаболизм, лечебные эффекты и прочее, обусловлены свойствами входящих в их состав прогестагенов.
Современные КОК различаются по дозе этинилэстрадиола:
КОК, содержащие 17β-эстрадиол и эстрадиола валерат, относят к низкодозированным.
Гестагены. Синтетические соединения, обладающие воздействием, сходным с прогестероном, были названы прогестагенами (гестагенами).
В 1996 г. в Германии на Европейской конференции, посвященной гестагенам, была принята классификация и номенклатура гестагенов, утверждены основные показания к их клиническому использованию, а также дано их определение. Согласно этому определению к гестагенам (прогестинам) относятся вещества, которые подобно прогестерону способны трансформировать эндометрий, подвергнутый воздействию эстрогенов, в секреторное состояние (тест Клауберга). Все химические соединения, которые соответствуют этому определению, имеют стероидную структуру. Они сходны по своему действию на эндометрий, но отличаются между собой по действию на другие органы-мишени и различные метаболические процессы.
В организме гестагены взаимодействуют с целым рядом органов-мишеней и метаболических систем, чувствительных к их воздействию, к числу которых относятся: эндометрий; печень; молочные железы; кости; головной мозг; иммунная система; сердечно-сосудистая система; обмен липидов; обмен углеводов; обмен белков, в том числе компонентов системы гемостаза и фибринолиз; обмен воды и электролитов.
Все гестагены на основании их химической структуры
разделяют на следующие группы:
Производные андростана и эстрана
(A) Прогестерон и его производные
(С) Производные 17альфа-гидроксипрогестерона
(3) Гидроксипрогестерона капроат
(4) Медроксипрогестерона 17-ацетат
(5) Ингестрола ацетат
(6) Хлормадинона ацетат
(7) Ципротерона ацетат
(D) Производные норпрогестерона
(Е) Производные 17альфа-гидроксинорпрогестерона
(11) Гестенорона капроат
(12) Номегестрола ацетат
(F) Производные тестостерон
(G) Производные 19-нортестостерона
(14) Норэтистерон (или норэтинодрон)
(17) Этинодиола диацетат
(20) Квингестранола ацетат
(H) Производные спиронолактона
Гестагены, входящие в состав современных гормональных контрацептивов, могут быть производными прогестерона, нортестостерона или спиронолактона.
Производные нортестостерона являются наиболее эффективными прогестагенами.
Они подразделяются на две группы:
Прогестагены первой группы были первыми предложены для контрацепции (первое поколение гестагенов), однако их гестагенная эффективность была невысокой, поэтому синтез левоноргестрела в 1975 году и его внедрение в практику был огромным прогрессивным моментом в истории контрацепции (второе поколение гестагенов) (таблица 8.1).
Левоноргестрел представляет собой синтетическое соединение, по структуре родственное норэтистерону.
Ввиду наиболее прочного и избирательного связывания с рецепторами прогестерона левоноргестрел проявляет более высокую биологическую активность. К производным левоноргестрела относятся более поздние прогестагены – дезогестрел, норгестимат, гестоден (третье поколение).
Гестоден, который в силу высокой селективности к рецепторам прогестерона и 100% биологической активности, при выраженном гестагенном эффекте, обладает еще некоторыми антиминералокортикоидными свойствами.
Сосредоточив внимание в первую очередь на дополнительных эффектах гестагенов, ученым удалось разработать совершенно новый гестаген – диеногест, обладающий хорошей переносимостью и сочетающий преимущества природного прогестерона с метаболической устойчивостью синтетических 19-норгестагенов.
Диеногест не накапливается в организме при ежедневном приеме и не влияет на все основные виды обменов – белковый, липидный и углеводный.
Дроспиренон – представитель четвертого поколения гестагенов – кроме своего основного действия обладает антиминералкортикоидными свойсвами.
Период разработки (гг.)
Международное непатентованное наименование
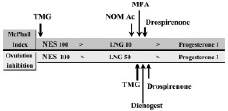
Все прогестагены обладают различным по силе гестагенным действием, иногда в несколько раз превосходящим действие прогестерона (рис. 8.1)
Рис. 8.1. Прогестагенный и антиовуляторный потенцал современных прогестинов тримегестона (TMG), номегестрола ацетата (NOMAc),
диеногеста (DNG) и дроспиренона (DRSP) по сравнению с более «старыми» прогестинами левоноргестрелом (LNG) и медроксипрогестерона ацетата (MPA) и физиологического гормона прогестерона (Р).
Цит. по: Sitruk-Ware R. (2008)
Сродство гестагенов к цитозольным рецепторам стероидных гормонов различных классов (относительные величины)
Глюко- кортикоидные рецепторы
Примечание: за 100% было принято связывание промегестона R5020 с гестагенными, метриболона R1881 с андрогенными, 17β-эстрадиола с эстрогенными, альдостерона с минералокортикоидными и дексаметазона с глюкокортикоидными рецепторами.
Необходимо подчеркнуть, что суммарный биологический эффект прогестагенов складывается из их гестагенного действия и дополнительных возможных эффектов – эстрогенного, андрогенного, антиандрогенного, антиэстрогенного и др. Производные прогестерона обладают гестагенным действием и, как правило, не оказывают ни значимого эстрогенного, ни андрогенного влияния на организм. Производные тестостерона, относящиеся к норэтинодроновой группе, обладают суммарным биологическим действием, которое складывается в зависимости от их вида из гестагенного, эстрогенного и андрогенного эффекта.
Большим достоинством прогестагенов последнего поколения является очень слабый андрогенный эффект (гестоден, дезогестрел) или его отсутствие наряду с наличием антиандрогенных свойств (ципрортерона ацетат, диегногест, хлормадинона ацетат) при сохранении высокой гестагенной активности, что определяет их преимущества в некоторых ситуациях. Данные о сродстве гестагенов к рецепторам других стероидных гормонов представлены в таблице 8.2.
Само по себе сродство гормона к рецептору не позволяет судить о характере фармакологического эффекта, так как стероид может быть его агонистом или антагонистом. Кроме того, иногда стероид выступает в качестве частичного агониста или антагониста. Поэтому, имея данные только о сродстве того или иного гормона к определенному рецептору, нельзя говорить о характере его биологической активности in vivo. Об этом можно судить с помощью специальных тестов, результаты которых в обобщенном виде представлены в таблице 8.3.
Состав и режим приема. Существует значительное число разновидностей КОК. В зависимости от состава таблеток для употребления в течение одного цикла приема, их разделяют на монофазные и многофазные.
Монофазные КОК содержат в каждой таблетке одинаковую дозу эстрогена и прогестагена. Преимущество монофазных оральных контрацептивов – не только высокая контрацептивная активность, но и выраженное многообразие лечебных свойств (табл. 8.4).
Монофазные КОК различаются режимом применения. Большинство из них принимают в течение 21 дня с последующим перерывом на 7 дней (режим «21+7»), во время которого наступает менструальноподобная реакция.
Особый режим приема («24+4») связан с укорочением безгормонального интервала. Такие КОК принимают без перерыва (в упаковке содержатся
Фармакологические эффекты гестагенов
24 активные таблетки и 4 таблетки плацебо), что повышает удобство применения, снижает риск пропуска таблеток.
Состав комбинированных гормональных контрацептивов
Низкодозированные монофазные, режим «21+7», содержащие ЕЕ
Норгестимат 0,25 мг
Левоноргестрел 0,15 мг
Левоноргестрел 0,125 мг
Дезогестрел 0,15 мг
(в состав каждой таблетки включен левомефолат кальция (метафолин 451 мкг)
Низкодозированные монофазные, режим «24+4», содержащие 17β-Е
Микродозированные, режим «21+7», содержащие ЕЕ
Левоноргестрел 0,1 мг
Дезогестрел 0,15 мг
Логест, Линдинет-20, Гестарелла
Микродозированные, режим «24+4», содержащие ЕЕ
Джес, Димиа, Модэлль ТРЭНД, Лея
(в состав каждой таблетки включен левомефолат кальция (метафолин 451 мкг)
Многофазные, содержащие ЕЕ
Левоноргестрел 0,05 мг
Левоноргестрел 0,075 мг
Левоноргестрел 0,125 мг
Левоноргестрел 0,05 мг
Левоноргестрел 0,075 мг
Левоноргестрел 0,125 мг
Дезогестрел 0,05 мг
Дезогестрел 0,15 мг
Многофазные, содержащие Е2В
Имеется препарат с динамическим режимом дозирования («26+2»), относящийся к многофазным препаратам.
Трехфазные КОК содержат переменные дозы стероидов. Основная идея трехфазности — снижение суммарной (цикловой) дозы прогестагена за счет трехступенчатого увеличения его дозировки в течение цикла. При этом в первой группе таблеток доза прогестагена очень низкая –
примерно 1/3 от таковой в монофазном КОК. В середине цикла дозу несколько увеличивают, и лишь в последней группе таблеток она соответствует дозе в монофазном препарате. Надежность подавления овуляции достигают за счет увеличения дозировки эстрогена в начале или середине цикла приема.
В особую категорию можно выделить КОК, в состав которых добавлен метафолин – активная форма фолиевой кислоты. Их применение способствует ликвидации количественного или биохимического дефицита фолатов в организме, снижая тем самым у женщин репродуктивного возраста риски акушерских осложнений, потерь беременности, аномалий развития плода и заболеваний у детей, ассоциированные с недостатком фолатов у матери в период, предшествовавший зачатию, и в периоды ранней плацентации и органогенеза. С точки зрения контрацептивной надежности и фармакологических свойств, КОК с фолатами идентичны своим аналогам, не содержащим метафолина.
8.2.2. Инновационные разработки современных оральных контрацептивов
Низкая доза эстрогенов. Желание создать наиболее безопасный и хорошо переносимый препарат, сохранив при этом его контрацептивную надежность, было реализовано снижением дозы этинилэстрадиола (ЕЕ) до 20 мкг. Никаких различий не было обнаружено в контрацептивной эффективности КОК, содержащих 20 мкг ЕЕ (20ЕЕ) по сравнению с большей дозой (Gallo M.F. et al., 2013).
Высокая эффективность отмечена для всех микродозированных препаратов с различными прогестагенами последнего поколения у молодых женщин – индекс Перля для 20EE/дроспиренон (ДРСП) составил 0,81, 20ЕЕ/диеногест (ДГС) – 0,94 (Endrikat J. et al., 2008), что аналогично комбинации 20EE/левоноргестрел (ЛНГ) (Ahrendt H.J. et al., 2009).
Прогестагены последнего поколения. Вместе с тем различия в переносимости препаратов обусловлены в основном прогестагенным компонентом, в основном за счет их андрогенной и глюкокортикоидной активности, что зависит от их способности активировать соответствующие рецепторы. Очевидно, что для улучшения переносимости КОК целесообразно использовать прогестагены без андрогенного действия (Oelkers W. et al., 1995). Благоприятными эффектами являются антиминералокортикоидный и антиандрогенный, которыми обладает ДРСП – синтетический прогестаген последнего поколения, производное спиронолактона.
Подавление овуляции достигается при использовании ДРСП в суточной дозе 3 мг. Необходимость такой дозы объясняется отсутствием этинильного радикала в молекуле дроспиренона и как следствие – более мягким воздействием на рецепторы прогестерона по сравнению с прогестагенами, содержащими этинильный радикал, которые дозируются в микрограммах в сутки.
Отсутствие этинильного радикала в молекуле ДРСП повышает его безопасность, так как исключает ингибирование цитохрома Р450 в печени, характерного для этинилированных прогестагенов. ДРСП обладает высокой биодоступностью, не требует активации в печени и не кумулирует в организме при многократном введении (Oelkers W. et al., 1995).
По сравнению со своим предшественником спиронолактоном, антиминералокортикоидная активность ДРСП приблизительно в восемь раз выше, и, таким образом, указанный эффект 3 мг ДРСП равен 25 мг спиронолактона (Losert W. et al., 1985).
Режим применения. Кроме того, рядом исследований было продемонстрировано улучшение переносимости препаратов с удлиненным режимом – 24 дня с гормонами и интервал 4 дня – без гормонов. Возможные преимущества укороченной фазы плацебо включают более выраженное подавление фолликулогенеза, уменьшение симптомов предменструального напряжения, которые часто проявляются в течение периода плацебо, и потенциального улучшения эффективности (Nakajima S.T. et al., 2007).
Данные также свидетельствуют о том, что КОК, дозированные в режиме 24/4 связаны с более короткой продолжительностью кровотечения отмены, чем 21/7 и способствуют снижению частоты пропуска таблеток (Карахалис Л.Ю. с соавт., 2015).
В настоящее время доступна только одна такая комбинация – 20 мкг ЕЕ и 3 мг ДРСП в режиме 24/4 в препаратах Джес, Димиа, Модэлль ТРЭНД и Лея (20ЕЕ/ДРСП), обладающая большим «запасом прочности» в отношении надежности для низких доз ЕЕ с более коротким интервалом, свободным от гормонов (Willis S.A. et al., 2006).
Сравнение частоты побочных эффектов микродозированных препаратов с продленным режимом, содержащих прогестины последнего поколения дало следующие результаты. Общие симптомы, относящиеся к приему КОК, содержащему ДРСП, встречаются редко и включают тошноту (3,4%), болезненность в молочных железах (1,2%), межменструальное кровотечение (1,2%). Ни одно серьезное неблагоприятное явление не было зарегистрировано. 85,6% пациентов были удовлетворены или очень удовлетворены приемом этого препарата (Wang C. et al., 2014). В другом исследовании (по сравнению с группой плацебо) межменструальные кровотечения отмечены у 13% (против 3% при приеме плацебо), тошнота – у 5% (4%) и кожная сыпь – у 4% (2%) (Fu Y. et al., 2014).
Если сравнить с препаратом, содержащим натуральный 17β-эстрадиол (E2/НМГА), с тем же режимом дозирования (24/4), то у него частота прорывных межменструальных кровотечений составляет до 20% (Mansour D. et al., 2011).
В отечественных исследованиях среди пациенток, получавших 30ЕЕ/ДРСП и 20ЕЕ/ДРСП, отмечены ациклические кровянистые выделения (4% и 3,2% соответственно), прорывные кровотечения (0,3% и 4,5%), прибавка массы тела на 1-2 кг (9% и 2%), болезненность молочных желез (масталгия) (5,6% и 10%) (Прилепская В.Н. с соавт., 2012; Геворкян М.А. с соавт., 2012; Тихомиров А.Л., 2014).
Увеличение веса часто считается побочным эффектом КОК, и многие женщины и врачи считают, что такая связь существует. В обзоре, выполненном экспертами Кокрейновского сообщества (Gallo M.F. et al., 2014), указывается, что от 25% до 75% женщин связывали прием КОК с увеличением массы тела. Тем не менее, не было установлено причинно-следственной связи между ними. Отмечены некоторые механизмы, которые могут предположительно привести к увеличению веса за счет факторов задержки жидкости (минералокортикоидное действие), повышения объема подкожного жира, особенно в груди и на бедрах (эстрогены), увеличения потребления продуктов питания через эффект воздействия на центр сытости и аппетита (анаболические свойства) или увеличения мышечной массы (андрогенный эффект), хотя, как отмечают авторы, – это маловероятно.
В отличие от других прогестагенов, ДРСП имеет биохимические и фармакологические профили подобные эндогенному прогестерону, особенно в отношении антиминералокортикоидной и антиандрогенной активности. Он противодействует эстроген-индуцированной стимуляции ренин-ангиотензин-альдостероновой системы и блокирует тестостерон, препятствуя его взаимодействию с рецепторами андрогенов. Из-за этих характеристик, он имеет потенциал в отношении уменьшения веса тела, кровяного давления, уровней липопротеинов низкой плотности, а также повышения уровня липопротеинов высокой плотности. Кроме того, он снимает симптомы, связанные с менструальным циклом (например, задержка воды), которые обычно наблюдается с другими КОК (отечность, масталгия, головная боль) (Krattenmacher R. et al., 2000). При этом масса тела уменьшается в среднем на 0,78 кг, а 25% и 19% женщин снижают вес более чем на 2 кг в течение 13 и 26 циклов (Foidart J.M. et al., 2000; de Morais T.L. et al., 2014).
Кокрановский обзор (30 исследований с 13 923 участников; их них в 23-х – авторы фармацевтических компаний) (Lawrie T.A. et al., 2011) продемонстрировал, что женщины, использующие КОК, содержащие прогестагены третьего поколения, прекращали использовать их реже по сравнению с препаратами второго поколения (3 КИ, 1815 женщин, ОР=0,77; 95% ДИ: 0,60-0,98), в 2-х двойных слепых испытаниях – ОР=0,79 (95% ДИ: 0,50-1,26). КОК третьего поколения реже вызывали межменструальные кровотечения, чем в группе второго поколения (1 двойное слепое исследование, 456 женщин, ОР=0,71; 95% ДИ: 0,55-0,91). По сравнению с ДГС, женщины в группе ДРСП, реже жалуются на болезненность молочных железах (5 КИ, 4258 женщин, ОР=1,39; 95% ДИ: 1,04-1,86) и тошноту (6 КИ, 701 женщин, ОР=1,46; 95% ДИ: 0,96-2,21).
Имея аналогичные профили фармакокинетики и эффективности по сравнению с КОК с обычными и фиксированными расширенными режимами, 20ЕЕ/ДРСП имеет дополнительное преимущество, проявляющееся в меньшем количестве дней кровотечения/кровомазания. Так, многоцентровое клиническое исследование с участием более 600 женщин, принимавших препарат на протяжении 13 циклов, показало, что продолжительность цикла и среднее число кровотечений / кровомазания в первом цикле составило 26,3±12,4 дней и 15,4±5,5 дней соответственно у 94,2% участниц. К концу исследования 96,8% пациентов имели планируемые циклы кровотечения, при этом их продолжительность снизилась с 5,9±3,2 до 5,0±1,6 дней. Процент женщин с межменструальными кровотечениями снизился с 14,5% в 1-м цикле до 2,3% (в 6,3 раз) – в 12-м (Wang C. et al., 2011).
Препараты с формулой натуральных гормонов. Стремление ученых минимизировать побочные эффекты КОК и сохранить адекватный контроль цикла, реализовалось созданием новых препаратов на основе натуральных гормонов в двух составах: первый – в монофазном режиме с микронизированным эстрадиолом (E2) и номегестрола ацетатом (НМГА), второй – в четырехфазовом режиме c эстрадиола валератом (E2В) и диеногестом (ДНГ) (Fruzzetti F. et al., 2010; 2012).
Препарат Зоэли содержит НМГА 2,5 мг в сочетании с Е2 1,5 мг в монофазном режиме. Отличительная особенность данного препарата состоит в том, что в нем оба компонента максимально приближены к натуральным гормонам, вырабатывающимся в организме женщины. Новый прогестаген позволил осуществить длительные попытки применения в КОК эстрогенного компонента, близкого к натуральному эстрадиолу. Ранее все попытки заменить ЕЕ 17β-эстрадиолом и другими эстрогенами заканчивались неудачей из-за слабого контроля менструального цикла (Astedt B. с соавт., 1979; Serup J. с соавт., 1979).
Препарат обладает высокой эффективностью – указанный в литературе индекс Перля для E2/НМГА составил 0,38 у женщин в возрасте младше 35 лет и 0,31 в смешанной группе (18-50 лет) и был сопоставим, или даже превышал значения, полученные при использовании EE/ДРСП (индексы Перля 0,81 и 0,66, соответственно) (Mansour D. et al., 2011).
В отличие от предшественников, Зоэли отличается достаточно длительным периодом полувыведения (46 ч), что обеспечивает высокую надежность контрацепции (даже в случае, если женщина забыла принять таблетку вовремя). Это позволяет пациентке не сомневаться в его эффективности, даже при небольшом нарушении режима приема.
В исследовании D. Mansour, C. Verhoeven et al. (2001) при сравнении двух КОК в группе с E2/НМГА допускался пропуск одной активной таблетки в любое время или двух таблеток между 8 и 17-м днями цикла без необходимости дополнительного использования презервативов; в группе с EE/ДРСП допускался пропуск только одной активной таблетки на второй неделе (8–14-й дни цикла), все остальные пропуски активной таблетки требовали дополнительного использования презервативов (Mansour D. et al., 2011).
Высокая антигонадотропная активность, обеспеченная гестагенным компонентом, выраженное свойство подавлять овуляцию и увеличивать вязкость цервикальной слизи обеспечивают эффективность контрацепции.
По данным большого рандомизированного исследования, отмечено, что при приеме с целью контрацепции таблеток E2/НМГА (n=1591) в течение 13 циклов кровотечения отмены были более короткими, чем при использовании таблеток EE/ДРСП (3 мг/30 мкг) (n = 535) (3–4 дня против 4–5 дней соответственно). Коэффициент возникновения промежуточных кровотечений был сходным (около 15%), но при использовании E2/НМГА у большего числа женщин не возникали кровотечения отмены (около 10% против 0,5% соответственно), что отражает более выраженный гестагенный эффект НМГА (Agren U.M. et al., 2011). По этой причине женщин, принимающих E2/ НМГА, следует информировать о вероятности «немых менструаций» перед назначением курса контрацепции, что не является побочным эффектом, а скорее дополнительным преимуществом препарата.
Клинические результаты совпадают с подтверждениями эндометриальных эффектов E2/НМГА. Толщина эндометрия уменьшилась с 9,9 мм до 4,9 мм после 6 мес, не превышая 5,6 мм, тогда как при EE/ДРСП, несмотря на среднее значение 4,5 мм, максимальная толщина во время лечения достигла 7,1 мм (Duijkers I.J. et al., 2010).
Обеспокоенность повышенным риском тромбоэмболии в связи с содержанием эстрогена в КОК стала причиной постепенного уменьшения дозы этинилэстрадиола с 50 до 30, 20 и даже 15 мкг. Это снижение дозы также сопровождалось уменьшением побочных эффектов, таких как нагрубание молочных желез, тошнота и метеоризм. Но даже с такими малыми дозами гормонов КОК до сих пор обладают протромботическим эффектом.
В двойном слепом рандомизированном исследовании P. Gaussem, M. Alhenc-Gelas (2011) при применении Зоэли побочные эффекты в отношении маркеров гемокоагуляции (протромбин 1+2, антитромбин, протеин С, D-димер, плазминоген и ингибитор активатора плазминогена 1 и фибринолиза) регистрировались реже, чем при применении EE/ЛНГ в режиме 21+7. Ни один из препаратов не оказывал влияния на агрегацию тромбоцитов. Полученные данные свидетельствуют о том, что Зоэли может характеризоваться менее выраженным риском венозных тромбозов по сравнению с EE/ЛНГ; для подтверждения этого необходимо проведение дальнейших эпидемиологических исследований (Gaussem P. et al., 2011).
Важным критерием безопасности КОК является его влияние на метаболические показатели. А. Basdevant et al. сообщили, что НМГА в дозе 5 мг/сут не оказывает значимого влияния на уровень глюкозы крови натощак или уровень инсулина, а также на уровни общего холестерина, ЛПВП или ЛПНП, фибриногена или плазминогена у женщин после шести циклов применения (Basdevant A. et al., 1991). Кроме того, NOMAC не оказывает влияния на выработку оксида азота (NO), вазопротективного или антитромботического фактора, либо это влияние минимально (Mueck A.O. et al., 2011). Зоэли оказывает положительное действие E2 на образование NO (Zerr-Fouineau M. et al., 2007; Zerr-Fouineau M. et al., 2009).
Высокая селективность НМГА, обусловленная принадлежностью к классу производных прогестерона, обеспечивает его целенаправленным воздействием на рецепторы прогестерона, в связи с чем, Зоэли лишен эстрогенной, андрогенной, глюкокортикоидной или минералокортикоидной активности.
Ярко выраженный эндометриальный эффект диеногеста сделал его подходящим прогестином для использования в контрацептивных таблетках, содержащих эстрадиола валерат. Комбинация диеногеста с E2В в препарате Клайра в режиме четырехфазного дозирования с уменьшением («step down») эстрогенного компонента и одновременным увеличением («step up») прогестинового компонента, по всей видимости, способна придать стабильность эндометрию. Биологический эффект E2В в дозировке 2 мг/сут соответствует приблизительно 20 мкг EE в отношении эффектов на уровне гипотоламо-гипофизарной оси и эффектов на уровне периферийных целевых тканей.
Схема предусматривает постепенное уменьшение эстрогенного компонента в сочетании с повышением дозировки прогестина с последующим коротким интервалом без гормонов (2 дня). Основная причина такого режима заключается в начальном преобладании эстрогенов, предназначенном для подготовки эндометрия к прогестиновой активности в 1-ой половине цикла. Затем возрастающие дозы ДНГ обеспечивают стабильность эндометриальной стромы, особенно в промежуточной и финальной фазах цикла.
Несравнительное открытое исследование, опубликованное в 2011 году, не выявило изменений в гиперпластических или атипических процессах при биопсии эндометрия у женщин, принимавших E2В/ДНГ, напротив, в 80% случаев результатом таких биопсий был атрофированный эндометрий (Fraser I.S. et al., 2011).
В небольшом клиническом испытании высокие дозы диеногеста (10 мг/сутки в течение 24 недель) приводили к уменьшению размеров молочных желез и регрессии признаков мастопатии (Schindler A.E. et al., 2009).
При приеме 20 мг ДНГ в сутки в течение 24 недель не были отмечены клинически значимые эффекты на липидный метаболизм, печеночные энзимы, гемостатические параметры и щитовидные гормоны (Schindler A.E. et al., 2010).
Что касается клинической эффективности, обширное многоцентровое исследование оценило в совокупности 1377 женщин в возрасте от 18 до 50 лет в более чем 20 циклах. У всех исследованных пациенток зафиксировано 13 беременностей, 6 из которых объясняются неудачей метода (нескорректированный индекс Перля 0,73, скорректированный индекс Перля 0,34).
В подгруппе женщин в возрасте от 18 до 35 лет произошло 12 беременностей, 5 из которых объясняются неудачей метода (нескорректированный индекс Перля 0,94, скорректированный индекс Перля 0,40) (Endrikat J. et al., 2008). Последующие исследования в этом направлении подтвердили высокую контрацептивную эффективность данного состава с эффектами, подобными комбинации EE/ЛНГ (20 мкг/100 мкг) (Ahrendt H.J. et al., 2009).
Рандомизированное исследование сопоставило менструальный профиль четырехфазного E2В/ДНГ с классическим EE/ЛНГ (804 женщин, 7 циклов). Плановые кровотечения для каждого цикла лечения составили 77,7-83,2% в группе Е2В/ДНГ и 89,5-93,8% – в другой группе (р 25 лет и новый сексуальный партнер, или имеющих более чем одного партнера за последний год), рекомендуется дополнительно пользоваться презервативом (уровень С).
Ниже приводится краткая характеристика методов LARC, которая позволит повысить информированность врачей и улучшить процесс консультирования. Сведения о неконтрацептивных свойствах методов приводятся в следующем разделе.
Негормональные внутриматочные средства
К наиболее эффективным и современным медьсодержащим ВМС относится модель Copper Т-Cu 380 А.
Т-Cu 380 А – «золотой стандарт», с которым сравнивают все имеющиеся виды ВМС при оценке их эффективности и приемлемости (Прилепская В.Н. с соавт., 2006). Данное средство Т-образной формы с высоким содержанием меди изготовлено из полиэтилена с добавлением сульфата бария.
Длина спирали – 36 мм, ширина – 32 мм. Медная проволока толщиной 0,4 мм с площадью поверхности 314 мм² укреплена на вертикальном стержне, а две дополнительные медные оплетки площадью 33 мм² – на горизонтальных рукавах. Общая поверхность медной оплетки – 380 мм².
Т-Cu 380А обладает высокой контрацептивной эффективностью – 98,3%. Срок его использования составляет 10 лет.
Для повышения устойчивости медной проволоки к коррозии в нее добавляют драгоценные металлы – серебро или золото. Примером ВМС, содержащей сплав меди с серебром, является Нова-Т, сплав меди с золотом – Голдлили Эксклюзив.
Механизм действия ВМС известен – препятствие наступлению оплодотворения за счет следующих эффектов: уменьшения активности и выживаемости сперматозоидов (добавление меди усиливает сперматотоксический эффект); усиления спермицидного эффекта слизи эндометрия за счет увеличения количества лизоцима и продуктов его распада, обусловленного полиморфноядерной лейкоцитарной инфильтрацией эндометрия в ответ на инородное тело; уменьшения срока жизни яйцеклетки.
В случаях оплодотворения яйцеклетки наступлению беременности препятствуют следующие механизмы: усиление перистальтики маточных труб; асептическое воспаление в эндометрии, приводящее к активации фосфатаз, изменению концентрации гликогена, что также нарушает имплантацию яйцеклетки (международными экспертами не поддерживается).
Медьсодержащая ВМС относится к одним из самых надежных методов предохранения от беременности с индексом Перля 0,6 при прогнозируемом и 0,8 – при фактическом применении.
При наступлении беременности у женщин с ВМС осложнения включают повышенный риск самопроизвольного и септического аборта.
Трудности с введением ВМС встречаются редко и могут сопровождаться вазо-вагальной реакцией, необходимостью раскрытия шейки матки, сильными болями, невозможностью вставить ВМС и перфорацией матки.
Профилактический курс антибиотиков для предотвращения инфекции органов малого таза перед введением ВМС не рекомендуется (уровень А).
Прогестиновые гормональные рилизинг-системы
Имплантат (Импланон, Импланон НКСТ)
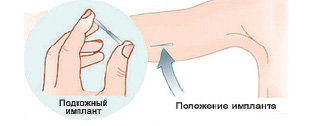
В начале 1990-х гг. предложен однокапсульный имплантационный контрацептив Импланон (позднее – рентгеноконтрастный Импланон НКСТ®, содержащий 15 мг сульфата бария, который визуализируется с помощью УЗИ или МРТ). Он представляет собой капсулу из этиленвинилацетата длиной 4 см и диаметром 2 мм (рис. 8.3), содержащий этоногестрел (68 мг) – биологически активный метаболит ДЗГ, который активно подавляет овуляцию, повышает вязкость шеечной слизи, воздействует на эндометрий. Этоногестрел обладает выраженным антигонадотропным эффектом и не имеет клинически выраженного взаимодействия с другими стероидными рецепторами.
Рис. 8.3. Капсула Импланона
и ее положение под кожей плеча после введения
В системный кровоток выделяется ежедневно около 70 мкг этоногестрела, что является достаточным для подавления овуляции. Кроме того, контрацептивный эффект дополняется воздействием этоногестрела на цервикальную слизь, повышая ее вязкость, что препятствует проникновению сперматозоидов в матку.
Импланон обеспечивает длительную контрацепцию в течение 3 лет. Эффективность его самая высокая и сопоставима со стерилизацией (индекс Перля равен 0,05).
Более высокая степень защиты от беременности по сравнению с оральными контрацептивами обусловлена независимостью от субъективных факторов. Очевидные преимущества Импланона делают его одним из наиболее приемлемых препаратов, приверженность к которому является максимальной по сравнению со всеми другими ГК, несмотря на возможность ациклических кровянистых выделений и аменореи, которые могут возникать при его применении.
Импланон вводится под кожу на l-5-й день менструального цикла или сразу после аборта или на 21-28-й день после родов. Капсулу вводят с помощью специального аппликатора подкожно на внутренней поверхности плеча недоминирующей руки после предварительной анестезии места введения. Капсула из этинилвинилацетата при правильном введении находится под кожей в строго определенном месте, не мигрирует и не вызывает выраженного фиброзирования окружающей ткани, что характерно для силиконовых имплантатов с левонргестрелом (Жадель, Норплант).
Технология введения представлена в инструкции к препарату.
Через 3 года использования имплантат необходимо удалить или заменить на новый. Его также можно удалить в любое время по желанию женщины. Удаление выполняется под местным обезболиванием, сделав небольшой разрез кожи над дистальным концом капсулы и используя москитный зажим, которым захватывают капсулу. При необходимости продолжения контрацепции этим же методом новую капсулу устанавливают на место удаленного сразу же.
После прекращения действия Импланона через неделю этоногестрел в крови практически не определяется и происходит быстрое восстановление фертильности – у 90% женщин в течение первых 3-х недель, что отличает его от других гормональных рилизинг-систем, после прекращения действия которых овуляторный менструальный цикл восстанавливается на протяжении от 6 недель до 18 месяцев.
Обладает всеми лечебными эффектами, присущими гестагенам и имеет низкую частоту побочных реакций. Послеустановки имплантата 20 % пользователей не имеют изменений менструального цикла, в то время как у 50 % имеют место редкие, частые или длительные кровотечения.
Клиническими преимуществами имплантата являются:
Осложнения, связанные с введением имплантата и его удалением возникают редко (1,0 и 1,7 % соответственно).
гормональная рилизинг-система (Мирена)
Относится к числу наиболее эффективных контрацептивных средств и специфическим влиянием на эндометрий.
Она представляет собой Т-образное полиэтиленовое устройство длиной 32 мм, содержащее 52 мг левоноргестрела. Ежедневно она выделяет около 20 мкг левоноргестрела, постепенно уменьшая это количество до 10 мкг к концу 5-го года использования. Длительность контрацептивного действия внутриматочной системы составляет 5 лет. Высокая надежность метода обеспечивается механизмом действия системы – индекс Перля составляет 0,2 как при прогнозируемом, так и при фактическом использовании.
Количество гестагена, поступающего в системный кровоток, в 5 раз меньше, чем при использовании КОК. Этим обусловлено его слабое влияние на гипоталамо-гипофизарную систему (подавление овуляции происходит только у 25-50% женщин), а основное контрацептивное действие в основном обеспечивает выраженное местное влияние левоноргестрела на эндометрий (атрофические изменения желез и истончение эндометрия).
Низкая концентрация гестагена в крови обеспечивает незначительное количество побочных эффектов.
При применении Мирены происходит прогрессирующее уменьшение менструальной кровопотери, которое через год составляет примерно 10% от исходной. У 50% женщин к этому времени развивается аменорея.
Подавление функции эндометрия оказывает лечебный эффект при ряде гинекологических заболеваний. Регресс эндометрия не только происходит в местах соприкосновения с ВМС и поверхностных слоях, но и тотально захватывает всю толщу слизистой оболочки матки. Это действие используется для уменьшения кровопотери у женщин с меноррагией, в том числе при миоме матки.
Мирена безопасна, как и все гестагенные контрацептивы, после родов в период грудного вскармливания.
Инъекционные методы (Депо-Провера)
Для инъекционной контрацепции используется препарат Депо-Провера, содержащий производное 17а-гидроксипрогестерона – депо-медрокси-прогестерона ацетат (ДМПА), в двух формах – для внутримышечных инъекций (в дозе 150 мг) и для подкожных (104 мг). Обе формы вводятся 1 раз в 3 месяца.
Стойкое подавление овуляции, повышение вязкости цервикальной слизи и атрофические изменения в эндометрии лежат в основе механизма действия препарата. Необходимая концентрация действующего вещества поступает в организм сразу, что обеспечивает немедленное контрацептивное действие и дополнительных средств контрацепции в первые дни после инъекции не требуется.
При этом концентрация ДМПА, поступающего из сформированного мышечного депо в кровеносную систему в 10 раз выше, чем у других рилизинг-систем. С одной стороны, это обеспечивает высокий контрацептивный эффект (индекс Перля 0,3), с другой, – вызывает ряд побочных эффектов, среди которых наиболее значимыми являются ациклические кровянистые выделения и влияние на минеральную плотность костной ткани.
Особенностью метода является длительное восстановление фертильности после его отмены – нормальный менструальный цикл восстанавливается спустя 6-9 месяцев, в некоторых случаях период восстановления может продолжаться до 1,5 лет в связи с длительно сохраняющейся высокой концентрацией ДМПА в крови, что обусловливает и сохранение побочных эффектов в этот период.
Этот метод занимает совершенно обособленное место в ряду современных контрацептивов, поскольку его использование связано с определенной степенью неудобства. Помимо самого способа их введения (необходимость посещения лечебного учреждения каждые 3 мес для выполнения инъекции), отрицательные эмоции у женщины вызывают часто наблюдающиеся мажущие кровянистые выделения, которые испытывают 70% из них. К концу первого года использования у большинства женщин наступает аменорея, что, с другой стороны, можно расценивать как дополнительное преимущество у женщин с гиперполименореей и дисменореей.
Средство обладает и рядом лечебных эффектов. Однако более четверти женщин отказываются от приема Депо-Провера в течение первого года использования. В целом, трудно точно определить группу женщин, которым в наибольшей степени подходил бы этот метод контрацепции (метод не нашел широкого применения в клинической практике).
Комбинированные гормональные рилизинг-системы (КГРС)
КГРС обладают высокой контрацептивной надежностью и приемлемостью (Назарова Н.М., 2010), широким спектром неконтрацептивных лечебных эффектов на патологические состояния репродуктивной системы, ассоциированные с менструальным циклом (меноррагия, ПМС, дисменорея), выражающиеся в устранении или снижении тяжести симптомов.
Не выявлено патологического влияния различных видов КГРС на молочные железы и цервикальный эпителий при наблюдении в течение от 2 до 5 лет (Назарова Н.М., 2010; Минкина Г.Н., 2013).
Влагалищное кольцо (НоваРинг)
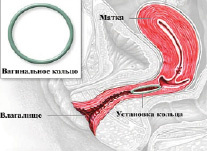
Представляет собой эластичное прозрачное кольцо, выполненное из этиленвинилацетата, диаметром 54 мм и толщиной 4 мм и содержит внутри кристаллы этоногестрела 11,7 мг и этинилэстрадиола 2,7 мг (на одно кольцо) (рис. 8.4). В сутки через мембрану этиленвинилацетата выделяется 15 мкг ЕЕ2 и 120 мкг этоногестрела, которые поступают в слизистую влагалища, а оттуда – в системный кровоток, что достаточно для подавления овуляции.
Рис. 8.4. Внешний вид вагинального кольца и его установка
Влагалищный путь введения контрацептивных гормонов обладает определенными преимуществами перед пероральным путем. Во многом это зависит от анатомии и функциональных особенностей влагалища. Оно очень хорошо снабжается кровью за счет развитой и разветвленной артериальной и венозной системы; артерии и вены образуют вокруг него сплетение. Венозная кровь из влагалища не попадает сразу в печеночный кровоток, т. е. отсутствует т. н. эффект первичного метаболизма. Ввиду автономной иннервации верхней части влагалища, тактильная и температурная чувствительность в нем значительно снижена, в т. ч. и при нахождении там какого-либо инородного тела.
Благодаря обильному кровоснабжению влагалища, всасывание активных метаболитов при вагинальном использовании гормонального контрацептива происходит быстро и постоянно, что позволяет обеспечить равномерное поступление гормонов в кровь в течение суток без ежедневных колебаний и эффекта первичного прохождения через печень, как при использовании КОК, что обеспечивает достаточную супрессию гипоталамо–гипофизарно–яичниковой системы и, соответственно, надежный контрацептивный эффект и контроль цикла, сопоставимый с КОК, содержащими 30 мкг ЕЕ, несмотря на самую низкую ежесуточную концентрацию Е2. Индекс Перля при использовании вагинального кольца – 0,25-0,4 (95% ДИ: 0,08-1,16) (Roumen F.J.M.E. et al., 2001; Ahrendt H.J. et al., 2006).
В то же время системное воздействие Е2 (за цикл) в 2,1 раза меньше, чем при приеме КОК и в 3,4 раза меньше, чем при использовании пластыря (Timmer C.J. et al., 2000; van den Heuvel M.W. et al., 2005). Данное свойство обеспечивает минимальное количество побочных эффектов и повышает приверженность пользователей. Среднее число женщин, отмечающих нерегулярные кровянистые выделения при использовании НоваРинга, составляет менее 4,4% (Dogterom P. et al., 2005).
По результатам проведенного в 2004 году Всероссийского исследовательского проекта НоваРинг оказывает положительное влияние на сексуальную жизнь женщин:
Контрацептивный эффект достигается через 7 дней от начала первого использования (в течение этого периода необходим дополнительный метод контрацепции) и продолжается 3 недели, затем кольцо удаляется и после недельного перерыва вводится новое. Возможно применение кольца и в непрерывном режиме (при этом его установку и удаление необходимо выполнять в один и тот же день).
Введение и удаление кольца выполняется женщиной самостоятельно. Большинство из них не испытывают трудностей при использовании НоваРинга, а более 85% – отмечают легкость введения и удаления.
Особенности положения кольца внутри влагалища, а также одновременное использование спермицидов, антисептиков, противогрибковых и антибактериальных средств и тампонов не влияют на его контрацептивное действие и эффективность.
При применении НоваРинга отмечено некоторое увеличение количества вагинальных выделений, что обусловлено влиянием эстрогена на эпителий слизистой влагалища и шейки матки и не приводит к изменениям в цитологической картине мазков или нарушениям микробиоценоза. Имеются сведения о повышении количества лактобактерий и уровня провоспалительных цитокинов в вагинальном отделяемом.
Клиническими преимуществами НоваРинга являются:
Накожный пластырь (Евра)
Представляет собой пластырь телесного цвета размерами 4,5х4,5 см и состоит из трех слоев: двух защитных, сделанных из полиэстера, и одного среднего, содержащего активные компоненты (норэлгестромин и этинилэстрадиол). Площадь его контактной поверхности – 20 см2. Наружный слой образует защитную пленку, а нижний снимается перед использованием.
Пластырь ежедневно доставляет в кровоток 150 мкг норэлгестромина и 20 мкг этинилэстрадиола. В клинических исследованиях пластырь продемонстрировал подавление овуляции, эффективность которого сравнима с оральными контрацептивами, содержащими 35 мкг этинилэстрадиола и 250 мкг норгестимата, метаболитом которого он является. Ежедневного колебания уровня сывороточных гормонов не происходит, хотя сывороточные концентрации гормонов при использовании Евра значительно выше, чем при использовании НоваРинга.
По механизму действия и эффективности пластырь аналогичен действию КОК, индекс Перля – менее 1 (однако при типичном использовании достигает 9). Восстановление фертильности после прекращения использования происходит через 6 недель.
Пластырь прикрепляется один раз в неделю в течение 3 недель (21 день) с недельным перерывом. Возможно непрерывное использование пластыря для предотвращения менструальных выделений.
Удаление и наложение пластыря необходимо проводить в одни и те же дни недели, но на различные участки тела (нижняя часть живота, ягодицы, наружная сторона плеча, верхняя часть спины; противопоказано наложение пластыря на грудную область).
При трансдермальном всасывании синтетические стероиды также подвергаются метаболизму в печени, как и при оральном пути введения, хотя и в меньшей степени, поэтому он оказывает влияние на липидный, углеводный обмен, систему свертывания крови, как и КОК. У пластыря – самый высокий риск развития тромбоэмболических осложнений по сравнению с другими ГК. Поэтому его не следует назначать женщинам с сахарным диабетом, артериальной гипертензией, заболеваниями печени, высоким уровнем триглицеридов в крови, курящим женщинам и имеющим другие факторы риска.
В первые месяцы применения отмечаются межменструальные кровянистые выделения и нагрубание молочных желез, причем несколько чаще, чем при использовании КОК. В дальнейшем цикл нормализуется, объем менструальной кровопотери снижается.
LARC отнесены к «топ-уровню» наиболее значимых обратимых методов, в общей характеристике которых отмечаются мотивация для долгосрочного использования контрацепции, отсутствие необходимости в соблюдении правил использования со стороны пациентки и высокий уровень клинической и экономической эффективности
_575.gif)