макролиды антибиотики против пневмонии список лучших
Антибиотики-макролиды при лечении пневмоний в поликлинике
В.Е.Ноников
ФГУ Центральная клиническая больница с поликлиникой УД Президента России, Москва
Проблемы диагностики и рациональной терапии пневмоний не теряют своей актуальности многие годы. Это обусловлено их широкой распространенностью, ошибками в диагностике и терапии, высокими показателями летальности. Частота случаев пневмонии составляет 5-20 на 1000 населения, причем наиболее высокая заболеваемость приходится на лиц пожилого и старческого возраста. Летальность составляет 5%, а у пожилых пациентов и при тяжелом течении пневмонии достигает 20%. Основу эффективного лечения пневмоний составляет антибактериальная химиотерапия, и правильное суждение о природе заболевания является решающим при выборе препарата.
Эпидемиологическая ситуация на рубеже XX-XXI вв. характеризуется возросшей значимостью внутриклеточных возбудителей бронхолегочных инфекций, возрастающей резистентностью микроорганизмов к широко применяемым антибактериальным средствам, распространенной сенсибилизацией населения к производным пенициллина и сульфаниламидам.
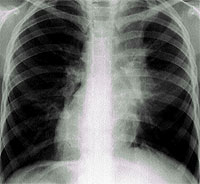
Для установления диагноза пневмонии доказательным является рентгенологическое исследование. Рентгенография легких также выявляет такие осложнения, как абсцедирование, экссудативный плеврит. Рентгенологические изменения могут отсутствовать. Это бывает в самом начале болезни, при дегидратации, тяжелой нейтропении, а также при пневмоцистной этиологии заболевания.
Компьютерная томография (КТ) легких оправдана лишь при проведении дифференциальной диагностики, если обычная рентгенограмма малоинформативна, и для более точной оценки возможных осложнений. КТ позволяет выявлять ранние инфильтративные и интерстициальные изменения, когда стандартная рентгенография еще не демонстративна. Четко определяются полости, лимфаденопатии, плевральный выпот и многоочаговые изменения.
Типичны данные исследования лейкоцитарной формулы, обнаруживающие лейкоцитоз более 10х1000/мкл, сдвиг лейкоцитарной формулы влево, токсическую зернистость нейтрофилов.
Cовременные макролиды в лечении внебольничной пневмонии
Приведена классификация различных видов пневмоний, факторы риска. Показано, что кларитромицин, наряду с высокой антибактериальной активностью, оказывает модулирующее влияние на фагоцитоз, хемотаксис, киллинг и апоптоз нейтрофилов, что обеспечивает регресс
Classification of different forms of pneumonia, factors of risk were given. It is shown that claritromicin, together with the high antibacterial activity, has a modulating influence on the phagocytosis, chemotaxis, killing and apoptosis of neutrophils, which ensures the reduction of symptoms and improvement in the state of patients.
Пневмония — группа различных по этиологии, патогенезу и морфологии острых инфекционных (преимущественно бактериальных) заболеваний, характеризующихся очаговым поражением респираторных отделов легких с внутриальвеолярной экссудацией, выявляемых при физическом и рентгенологическом исследованиях, а также выраженными в различной степени лихорадочной реакцией и интоксикацией (Российское респираторное общество, 2010 г.). По данным ЦНИИ организации и информатизации здравоохранения МЗ РФ в 2008 году пневмонией переболели 424 457 человек, а в 2009 году — 449 673 пациента [1, 2]. Показатель заболеваемости пневмонией значительно выше у пожилых больных и составляет от 25 до 114 на 1000 человек в год [3].
Пневмонии занимают первое место среди причин летальности от инфекционных болезней и шестое место — среди всех причин летальности [4]. Наиболее часто смертельные исходы наблюдаются при пневмониях тяжелого течения, особенно у социально неблагополучных лиц или у пациентов, имеющих тяжелую сопутствующую патологию [5, 6].
Различают следующие виды пневмонии:
Внебольничные пневмонии являются самой многочисленной группой, характеризуются тяжелым течением и высоким риском осложнений, среди которых плеврит, абсцессы и другие гнойно-деструктивные процессы [10].
Все внебольничные пневмонии делятся на следующие группы:
Факторами риска неблагоприятного течения внебольничных пневмоний являются:
1. Возраст старше 60 лет.
2. Сопутствующие заболевания:
3. Неэффективность стартовой антибактериальной терапии.
Неотложная госпитализация в отделения реанимации и интенсивной терапии требуется в тех случаях, когда у пациента имеют место признаки тяжелого течения внебольничной пневмонии, к которым относятся:
Известно, что при внебольничной пневмонии основным возбудителем является пневмококк (Streptococcus pneumoniae) [12], вторым по значимости возбудителем является гемофильная палочка (Haemophilus influenzae) [13].
Кроме обязательных лабораторно-инструментальных исследований в диагностике внебольничных пневмоний в настоящее время применяются различные шкалы PSI и CURB-65/CRB-65 [14].
С целью определения факторов риска, распространенности, структуры и частоты летальных исходов при пневмонии в многопрофильном стационаре скорой медицинской помощи авторами было проведено ретроспективное исследование, в ходе которого было проанализировано 180 727 карт стационарных больных. Из них 172 420 больных (95,5%) были пролечены и выписаны, 1677 (0,9%) пациентов были переведены в другие ЛПУ, а 6630 больных (3,6%) умерли.
Из числа умерших в исследование было включено 1497 случаев подтвержденной на секции внебольничной пневмонии, которые были разделены авторами на две подгруппы: «Внебольничная пневмония как основное заболевание» (I) включала 97 больных (6,4%) и «Внебольничная пневмония как осложнение основного заболевания» (II) включала 1400 (93,6%) пациентов (рис. 1).
Среди 1497 умерших пациентов с внебольничной пневмонией было 768 мужчин (51,4%) и 729 женщин (48,6%) (рис. 2).
Возрастная структура 1497 пациентов с внебольничной пневмонией представлена на рис. 3. Как видно из данной иллюстрации, большинство больных (43%) были старше 75 лет.
Из 1497 случаев внебольничной пневмонии, закончившейся летальным исходом, в 136 наблюдениях (9%) имело место расхождение клинического и патологоанатомического диагнозов (рис. 4).
По характеру поражения плевропневмония встречалась в 49,4% случаев, очагово-сливная пневмония — в 22,6%, абсцедирующая — в 19,5%, а очаговая — в 8,5% наблюдений.
По локализации чаще встречались двусторонние внебольничные пневмонии — 41 (42,2%). Сводная таблица локализаций поражения легочной ткани при внебольничной пневмонии представлена ниже (табл. 1).
Внебольничная пневмония в 71,1% случаев сочеталась с ХАИ, в 56% случаев — с перенесенными ОНМК, в 24,7% случаев — с ХОБЛ, в 32% наблюдений — с мультифокальным атеросклерозом, в 25,7% случаев — с ишемической болезнью сердца (ИБС), в 20,6% событий — с СД 2-го типа (рис. 5).
Таким образом, в подавляющем большинстве наблюдений внебольничная пневмония вторична, т. е. является осложнением основного или фонового заболевания, отягощает его течение и ухудшает прогноз больных. Полученные авторами данные в случае подозрения на пневмонию диктуют необходимость проведения диагностического поиска, направленного на выявление субстрата для развития воспалительного процесса в легочной ткани. В связи с этим диагностика, а зачастую и лечение внебольничной пневмонии остаются одной из актуальных проблем современной терапии. Выбор антибиотика для лечения пневмонии осуществляется обычно эмпирически. При этом ориентирами для его выбора становятся эпидемиологическая ситуация, предполагаемая чувствительность флоры (табл. 2) и некоторые другие отягощающие факторы [15].
Полусинтетический макролид кларитромицин наряду с аминопенициллинами и респираторными фторхинолонами занимает одно из ведущих мест в терапии внебольничной пневмонии и других инфекционных заболеваний нижних отделов дыхательных путей. Многогранное этиопатогенетическое действие кларитромицина на процесс бактериального воспаления обеспечивает его высокую эффективность, подтвержденную в ряде сравнительных исследований. Антимикробный спектр кларитромицина, включающий S. pneumonia, H. influenza, а также новые пролонгированные формы препарата, определяет его востребованность в терапии данной категории пациентов. При наличии атипичных микобактерий и Pseudomonas aeruginosa кларитромицин применяется в комбинации с другими антимикробными препаратами, значительно повышая эффективность проводимой терапии.
Механизм антимикробного действия кларитромицина обусловлен нарушением синтеза белка в микробной клетке. В результате обратимого связывания с 50 S-субъединицей рибосом и ингибирования реакций транслокации и транспептидации происходит торможение формирования и наращивания пептидной цепи [16]. Основной эффект кларитромицина — бактериостатический, но при высоких концентрациях и низкой микробной плотности в отношении S. pyogenes и S. pneumoniae препарат оказывает бактерицидное действие. При этом антимикробная активность в отношении данных возбудителей и метициллиночувствительных штаммов Staphylococcus aureus в 2–4 раза выше, чем у эритромицина [17].
Во многих клинических исследованиях и в результате многолетнего опыта применения выявлена высокая эффективность кларитромицина в терапии инфекций нижних отделов дыхательных путей. Согласно результатам исследования, включавшего 252 пациента с внебольничной пневмонией, 7-дневный курс лечения пролонгированным кларитромицином (1000 мг 1 раз в сутки) оказался столь же клинически эффективным, как и аналогичное по продолжительности назначение левофлоксацина (500 мг 1 раз в сутки). Общая частота эрадикации патогенов (87% и 88% соответственно) и рентгенологического улучшения (95% и 88% соответственно) также не различалась. Оба препарата оказались одинаково эффективными как при типичных, так и при атипичных возбудителях [18].
При тяжелом течении внебольничной пневмонии в условиях стационара более эффективна комбинированная терапия. Это подтверждено многими клиническими наблюдениями. В когортном исследовании с участием 1391 пациента с внебольничной пневмонией установлено, что смертность при лечении комбинацией цефалоспорина III поколения с макролидом в 2 раза ниже, чем при монотерапии бета-лактамом [19]. В другом исследовании показано: комбинация бета-лактама с макролидом эффективнее таковой бета-лактама с фторхинолоном (смертность — 4,9% и 15,0% соответственно) [20].
Независимо от антимикробного эффекта кларитромицин, как и ряд других макролидов, проявляет противовоспалительное, иммуномодулирующее и мукорегулирующее действия на уровне респираторной системы. Кларитромицин оказывает модулирующее влияние на фагоцитоз, хемотаксис, киллинг и апоптоз нейтрофилов. Происходит ингибирование окислительного «взрыва», в результате уменьшается образование высокоактивных соединений, способных повреждать собственные ткани. Ингибируется синтез и/или секреция провоспалительных (интерлейкинов-1, 6, 8, фактора некроза опухоли альфа) и усиливается секреция противовоспалительных цитокинов (интерлейкинов-2, 4, 10) [21].
Таким образом, наличие дополнительных свойств наряду с высокой антибактериальной активностью обеспечивает быстрый регресс симптомов и улучшение состояния пациентов при терапии кларитромицином инфекций дыхательных путей.
Кларитромицин обоснованно занял свою нишу в терапии острых и хронических инфекций респираторного тракта. Он сохраняет одно из лидирующих мест в амбулаторной практике и на фармацевтическом рынке РФ, что обусловлено широким спектром активности, быстрым достижением высоких пиковых концентраций в очаге инфекции и благоприятным профилем безопасности. Лекарственная форма с замедленным высвобождением действующего вещества за счет специального поверхностного слоя и матриксной основы (Клацид СР) идентична по эффективности стандартной, лучше переносится, способствует повышению комплаенса и может рекомендоваться для активного применения. Имеющиеся на сегодня доказательные данные о неантибактериальном действии в совокупности с благоприятными клинико-фармакологическими характеристиками кларитромицина позволяют рассматривать его в качестве адъювантного препарата в терапии многих заболеваний органов дыхания.
Литература
А. Л. Верткин, доктор медицинских наук, профессор
Ж. М. Оралбекова
А. С. Скотников, кандидат медицинских наук
ГБОУ ВПО МГМСУ Минздравсоцразвития России, Москва
Антибиотики XXI века
Поделиться:
В первой части статьи мы рассказали про основные мифы связанные с антибиотиками и подробно описали пенициллиновую группу, а сейчас перейдем к антибиотикам следующего поколения.
ЦЕФАЛОСПОРИНЫ
Микробы часто поступают если не разумно, то вполне логично.
Если им угрожают антибиотики пенициллинового ряда, микробы начинают разрушать пенициллины (вот бы нам так — нам что-то мешает, а мы это раз! — и стерли с лица земли).
Слабое звено пенициллинов — это так называемое бета-лактамное кольцо (вы не раз встретите в описании препаратов этот термин, поэтому его лучше запомнить). Вот это бета-лактамное кольцо микробы и научились разрывать. А инструментом для разрыва служат специальные ферменты, бета-лактамазы.
Так что, если говорить коротко, то антибиотики цефалоспориновой группы — все те же пенициллины, которые работают точно так же, но вот бета-лактамаз они не боятся. И значит, могут расправиться с микробами, с которыми не справляется все тот же ампициллин или даже амоксициллин с клавулановой кислотой.
«Гонка вооружений» между микробами и фармацевтами со временем породила второе, третье, а потом и четвертое поколение цефалоспориновых антибиотиков (при произнесении некоторых названий этих лекарств пугаются даже врачи, сразу представляющие, против какой флоры эти антибиотики предназначены).
КОГДА ВРАЧИ НАЗНАЧАЮТ ЦЕФАЛОСПОРИНЫ
При аллергии на обычные пенициллины.
Конечно, химическая структура пенициллинов и цефалоспоринов похожа, но шанс, что пациент не выдаст аллергической реакции на цефалоспорины, все же очень высок; Если пенициллиновые антибиотики не справляются с инфекцией. Такое часто бывает, если пациент заражается каким-нибудь стафилококком или стрептококком уже в больнице: микробы там травлены уже чем угодно, а потому особенно стойкие к таблеткам из обычной аптеки.
Микробы, к сожалению, быстро учатся и быстро эволюционируют. Оно и понятно: для смены поколений им нужно всего-то 20 минут.
И все же врачам всегда рекомендуют начинать лечение с антибиотиков из группы пенициллинов, чтобы не плодить антибиотикоустойчивую флору.
АНТИБИОТИКИ ГРУППЫ МАКРОЛИДОВ
Что оставалось делать ученым? Только разрабатывать новые антибиотики.
Пенициллин начал массово применяться в 1943 году (в США и СССР, и почти одновременно). А уже в 1949 году Альберто Агилар на Филиппинах нашел новый (после зеленой плесени, из которой был выделен пенициллин) особый грибок, подавляющий рост бактерий.
В США год спустя другой ученый, МакГуир, выделил из него новый антибиотик — эритромицин (в Википедии почему-то упорно пишут, что его выделил Элай Лилли, но это не так — просто МакГуир на него работал).
Эритромицин работает до сих пор: оказалось, что к нему бактерии умеют приспосабливаться намного хуже, чем к пенициллину.
ЧТО УМЕЮТ МАКРОЛИДЫ?
Во-первых, бактерии действительно приспосабливаются к макролидам намного медленнее, чем к пенициллинам.
Но тоже приспосабливаются. Именно поэтому эритромицин сейчас оброс огромным семейством из «младших братьев» — полусинтетических макролидов и азалидов, которые некоторые фармацевты выделяют еще в одну отдельную группу — четвертую и последнюю группу антибиотиков, применяющихся в педиатрии.
Во-вторых, макролиды не убивают бактерий — они лишают их способности размножаться, в результате чего бактериальные клетки, не принося вреда человеку, очень быстро помирают своей смертью или становятся жертвами иммунной системы.
В-третьих, макролиды могут проникать внутрь клеток и настигать бактерий, которые так любят там селиться, — хламидий и микоплазм.
КОГДА ВРАЧИ НАЗНАЧАЮТ МАКРОЛИДЫ?
— у пациента есть аллергия на пенициллины;
Читайте также:
Русская рулетка, или Самолечение антибиотиками
— имеются веские основания полагать, что мы имеем дело с хламидийной инфекцией или микоплазменной пневмонией — пенициллины тут будут бессильны.
ВАЖНО! Пенициллины убивают микробов в момент их размножения. Макролиды лишают микробов способности размножаться. Значит, если врач одновременно назначит, скажем, пенициллин и эритромицин (а пусть, мол, они всю флору одновременно и накроют), эти два антибиотика на самом деле будут… защищать микробов друг от друга.
КОГДА МОЖНО И НУЖНО ПРИНИМАТЬ АНТИБИОТИКИ
— при высокой температуре, длящейся более 3 дней;
— при начале «второй волны» инфекции: лечили-лечили ребенка от вируса, он вроде бы уже и поправляться стал, а тут вдруг снова высокая температура, вялый, да еще вдобавок какой-нибудь кашель присоединился;
— если присутствует четко локализованное инфекционное поражение, например при остром среднем отите, гайморите с гнойными выделениями, бронхите;
— при изменениях в общем анализе крови, характерных для бактериальной инфекции и активного воспаления: высокая СОЭ и большое общее количество лейкоцитов на фоне преобладания в лейкоцитарной формуле нейтрофилов над лимфоцитами.
И конечно, антибиотики нужно принимать только по назначению врача.
Мнение автора может не совпадать с мнением редакции
Рациональная антибактериальная терапия пневмоний
Как быстро следует начинать проведение антибактериальной терапии при пневмонии? Какова продолжительность антибактериальной терапии и от чего она зависит? Есть ли смысл применять сочетание двух антибиотиков и при каких обстоятельствах используется подобна
Как быстро следует начинать проведение антибактериальной терапии при пневмонии? Какова продолжительность антибактериальной терапии и от чего она зависит? Есть ли смысл применять сочетание двух антибиотиков и при каких обстоятельствах используется подобная терапия?
Назначение и проведение АТ при пневмонии требует от врача принятия целого комплекса мер, причем каждое из его решений определяет эффективность назначенного лечения. При назначении АТ врач должен руководствоваться следующими ключевыми параметрами:
Выбор первоначального АП
АТ должна начинаться как можно раньше, с момента диагностирования пневмонии. По некоторым данным, при задержке введения первой дозы АП более чем на 8 часов с момента госпитализации достоверно увеличение летальности среди больных пожилого и старческого возраста. Необходимость как можно более раннего назначения антибиотиков (до получения результатов микробиологического исследования) обусловлена:
Основными ориентирами при выборе первоначального АП для лечения пневмонии являются:
«Ситуационный подход» при выборе первоначального антибиотика для лечения пневмонии оправдан «привязанностью» некоторых возбудителей пневмонии к определенным клинико-эпидемиологическим ситуациям. Кроме того, назначение АТ осуществляется сразу после постановки диагноза при отсутствии данных микробиологического исследования мокроты, а нередко и без перспектив этиологической верификации этиологического варианта пневмонии.
Пожалуй, наибольшее число ошибок возникает в самом начале АТ, на этапе эмпирической терапии, при выборе АП. Чаще всего ошибки оказываются связаны с недооценкой или неправильной оценкой клинической и эпидемиологической ситуаций, данных рентгенологического и лабораторного исследования, позволяющих предположить ориентировочный этиологический вариант пневмонии. Необходимо помнить о различной этиологии пневмонии у молодых и пожилых людей, у ранее здоровых пациентов и больных с различной фоновой патологией, у заболевших пневмонией дома или в стационаре, у пациентов, находящихся в хирургическом или реанимационном отделении и т. д. Отсутствие четких критериев выбора первоначального АП приводит к тому, что врач руководствуется совершенно другими субъективными критериями, например отдает предпочтение наиболее знакомому, хорошо известному и часто назначаемому АП, или, наоборот, назначает новый, более эффективный, по его мнению, АП, или останавливает свой выбор на более дешевом и доступном АП и т. д. Так, например, ошибочно назначаются цефалоспорины, обладающие антисинегнойной активностью (цефтазидим, цефпиром), или антисинегнойные пенициллины (мезлоциллин, карбенициллин) при внебольничной пневмонии нетяжелого течения у молодых пациентов, не отягощенных никакой сопутствующей патологией. В этом случае наиболее вероятными этиологическими агентами наряду с пневмококком могут быть так называемые атипичные возбудители (легионелла, микоплазма, хламидия). Неоправданно назначение больному с нетяжелой внебольничной пневмонией таких антибиотиков, как, например, ванкомицин или меропенем, считающихся «резервными». Такой подход не только противоречит принципам выбора первоначального АП, но и экономически нерационален. К тому же врачебная ошибка в этом случае чревата формированием микробной резистентности к указанным АП. Более оправданно в вышеприведенной ситуации внебольничной пневмонии у молодого, не отягощенного сопутствующей патологией больного назначение аминопенициллинов (амоксициллин, ампициллин) или макролидов (эритромицин, азитромицин, кларитромицин, спирамицин), активных также и против вероятных атипичных возбудителей (Legionella, Chlamydia, Mycoplasma). Это позволяет максимально полно охватить всех этиологически значимых возбудителей (цефалоспорины третьего поколения, ванкомицин и меропенем не активны против атипичных возбудителей). В табл. 2 приводятся возможные причины неэффективности АТ и способы их коррекции.
Среди фторхинолоновых АП при внебольничной пневмонии оправданно назначение новых фторхинолонов (левофлоксацин, моксифлоксацин), обладающих высокой активностью по отношению к S. pneumoniae, H. influenzae и атипичным возбудителям. В то же время назначение грамотрицательных фторхинолонов (ципрофлоксацин, офлоксацин) нерационально, поскольку эти АП обладают невысокой антипневмококковой активностью.
С другой стороны, при выборе АП для лечения госпитальных пневмоний следует ориентироваться на высокую вероятность этиологической роли грамнегативных микроорганизмов, и в том числе P. aeruginosa (поздние пневмонии в отделениях интенсивной терапии, длительное лечение глюкокортикоидами и др.). В таких ситуациях более оправданно назначение цефалоспоринов третьего поколения с антисинегнойной активностью (цефтазидим), либо антисинегнойных пенициллинов (пиперациллин), либо фторхинолонов (ципрофлоксацин)
Фармакокинетические свойства препаратов могут служить еще одним ориентиром при выборе первоначального АП. Основные фармакокинетические свойства, которые необходимо учитывать при выборе АГ:
Хорошо проникают в ткани макролиды, тетрациклины и фторхинолоны. При проникновении внутрь клетки препарат не должен вызывать повреждений, что в наибольшей степени свойственно тетрациклинам. Проникновение макролидов внутрь клетки настолько выражено, что их внеклеточные концентрации могут оказываться недостаточными для подавления пневмококков при пневмококковой бактериемии. С учетом этого при тяжелых пневмониях с высокой вероятностью бактериемии монотерапия макролидами неоправданна.
Фармакокинетические свойства некоторых АП (ципрофлоксацин, цефалоспорины третьего и четвертого поколения и др.) позволяют применять их не более 2 раз в сутки. Оптимальные фармакокинетические параметры новых (респираторных) фторхинолонов (левофлоксацин, моксифлоксацин), их высокая, практически полная биодоступность при приеме внутрь дают возможность назначать их однократно в сутки как парентерально, так и перорально.
Антибиотикорезистентность. При выборе АП для эмпирической АТ пневмоний следует учитывать тенденцию ряда микроорганизмов к антибиотикорезистентности (АР) и региональную «микробную экологическую ситуацию», то есть преобладающий спектр микроорганизмов и их чувствительность к антибиотикам в различных регионах, стационарах, отделениях и т. д.
Одной из основных проблем, имеющих важное клинические значение, является резистентность S. pneumoniae к пенициллину. Риск пенициллинорезистентности S. pneumoniae возрастает при наличии следующих факторов: возраст больных менее 7 лет и старше 60 лет, наличие тяжелых соматических заболеваний, частое и длительное лечение антибиотиками, проживание в домах престарелых. Возможна перекрестная резистентность к макролидам. В то же время резистентность S. pneumoniae к пенициллину и макролидам не коррелирует с резистентностью к респираторным фторхинолонам, что делает рациональным и обоснованным выбор в подобных ситуациях респираторных фторхинолонов (левофлоксацин, моксифлоксацин). Резистентность S. pneumoniae к левофлоксацину по-прежнему остается низкой и не превышает 0,8%. Согласно рекомендации Американского торакального общества, именно левофлоксацин и моксифлоксацин разрешены к применению при внебольничной пневмонии, вызванной резистентным S. pneumoniae.
Другой проблемой, которая встает в связи с антибиотикорезистентностью, является продукция H. influenzae b-лактамазы, что обычно наблюдается у больных ХОБЛ, часто получающих АП в связи с обострениями заболевания. С учетом этого фактора при развитии пневмонии на фоне ХОБЛ оправданно назначение защищенных пенициллинов (амоксициллин/клавуланат, ампициллин/сульбактам). Поскольку механизмы резистентности к пенициллину у S. pneumoniae и H. influenzae различны (изменения мембраны и выработка b-лактамазы соответственно), то защищенные пенициллины активны против H. influenzae, продуцирующей b-лактамазу, и неэффективны в отношении пенициллинорезистентного S. pneumoniae. В то же время «защищенные» пенициллины могут сохранять активность по отношению к пенициллинорезистентным стафилококкам (стафилококки вырабатывают b-лактамазу). Поэтому в ситуациях, когда высока вероятность стафилококковой внебольничной пневмонии (после перенесенного гриппа, хроническая алкогольная интоксикация), обоснованно назначение ингибитор-защищенных пенициллинов.
Важное клиническое значение имеет выявление резистентности у больных внутрибольничной пневмонией (метициллинорезистентный S. aureus), что определяет тактику АТ и служит обоснованием для назначения ванкомицина. В то же время выбор последнего в качестве эмпирической АТ при пневмониях даже тяжелого течения, как упоминалось выше, следует считать ошибочным, и его назначение должно быть обосновано выделением резистентного S. aureus.
Нерационально назначение в качестве первоначального АП при внебольничной пневмонии ко-тримоксазола или тетрациклина в связи с высоким уровнем резистентности к этим АП основных возбудителей пневмонии.
Окраска мокроты по Граму является важным ориентиром для выбора первоначального антибиотика с учетом грампринадлежности микроорганизмов. Целесообразно проведение бактериоскопии и посева мокроты, содержащей достаточное количество нейтрофилов. Отрицательный результат при окраске мокроты по Граму не всегда свидетельствует об отсутствии микроорганизмов в мокроте, а может быть обусловлен недостаточным их количеством (менее 104). Если в одном поле зрения обнаруживается около 10 микроорганизмов, это означает, что их количество составляет не менее 105 и приближается к диагностическому титру.
Стоимость АП. При первоначальном выборе антибиотика его стоимость должна рассматриваться с учетом адекватности АП в данной ситуации, а также дополнительных затрат на лечение в случае неэффективности, развития осложнений, нежелательных эффектов и т. д. Следует иметь в виду, что важна не только стоимость самого АП, но и общие затраты на лечение, которые в случае назначения более дешевого, но неэффективного в данной ситуации АП могут оказаться выше.
Увеличение затрат на лечение обычно связано с неправильным первоначальным выбором АП, комбинированной АТ без должных показаний, неадекватной длительностью АТ, недоучетом риска возникновения нежелательных токсических эффектов АП.
Доза АП и пути введения
Нередко для лечения пневмонии используются неадекватные дозы АП, причем могут назначаться как недостаточные, так и избыточные дозы препарата. Если доза АП недостаточна и в крови не создается концентрации препарата, необходимой для эрадикации соответствующего возбудителя, то это не только является одной из причин неэффективности АП, но и создает реальные предпосылки для формирования резистентности микроорганизма. Ошибки в выборе оптимальной дозы могут быть связаны как с назначением недостаточной разовой дозы, так и с неправильным режимом дозирования (недостаточная кратность введения).
Неправильный выбор интервалов между введениями АП обычно обусловлен не столько сложностями парентерального введения препаратов в амбулаторных условиях или негативным настроем больных, сколько неосведомленностью врачей о фармакодинамических и фармакокинетических особенностях АП, которые должны определять режим их дозирования. Так, ряд АП обладает так называемым постантибиотическим эффектом, то есть способностью подавлять рост микроорганизмов даже при снижении уровня АП в крови ниже МПК. Таким постантибиотическим эффектом в отношении грамотрицательных микроорганизмов обладают аминогликозиды, фторхинолоны, тетрациклины. Выраженность бактерицидного эффекта указанных групп АП зависит главным образом от пиковой концентрации в крови, в связи с чем при назначении данных препаратов важно, чтобы больной получил достаточную разовую дозу, а интервалы между введениями могут быть более длительными. С другой стороны, b-лактамные АП, за исключением карбапенемов, практически лишены постантибиотического эффекта. Их бактерицидный эффект не усиливается при повышении уровня препаратов в крови. Поэтому при выборе b-лактамных АП (пенициллины, цефалоспорины) для их оптимального действия гораздо важнее длительное поддержание в крови МПК, то есть более частые (без пропусков) введения препарата. С учетом вышесказанного дву- или трехкратное введение пенициллинов или цефалоспоринов первого и второго поколения даже в адекватной разовой дозе следует считать ошибочным. С другой стороны, при назначении аминогликозидов необходима достаточная разовая доза, которая может вводиться даже однократно. Назначение АП в дозах, превышающих оптимальные, может вызывать развитие суперинфекции в связи с активизацией собственной микрофлоры больного. Суперинфекция возникает обычно при назначении АП, снижающих уровень бесспоровой анаэробной флоры в кишечнике (пенициллины, линкомицин, тетрациклины). При этом обычно после кратковременного эффекта на фоне АТ отмечается повышение температуры, ухудшение состояния больного, что ошибочно трактуется как неэффективность АТ и влечет за собой неоправданную замену АП, который в свою очередь также не оказывает ожидаемого эффекта.
Следует помнить, что применение больших доз АП повышает риск возникновения токсических эффектов. Это относится прежде всего к таким потенциально токсичным препаратам, как аминогликозиды, для которых установлены строгие суточные дозы. Превышение таких «пороговых» доз недопустимо, особенно у больных с высоким фактором риска осложнений (пожилой и старческий возраст, нарушения функции почек, прием других потенциально нефротоксичных препаратов и др.)
Назначение больших доз АП может, однако, быть оправданным при высоком риске резистентных штаммов или при выделении возбудителя с умеренной резистентностью к соответствующим АП. Так, возможно назначение больших доз амоксициллина (до 3 г/сутки) при пневмониях, вызванных пенициллинорезистентным пневмококком, поскольку пеницилллины и цефалоспорины могут сохранять при этом свою эффективность.
Путь введения АП определяется многими факторами, в том числе тяжестью пневмонии, состоянием больного, фармакокинетической характеристикой АП и др. Если в целом ряде ситуаций при инфекциях нижних дыхательных путей парентеральный путь введения не имеет альтернативы (нарушение сознания, стволовые расстройства с нарушением глотания, патология кишечника и др.), то в остальных случаях парентеральная АТ требует определенных показаний и должна быть обоснованной, а не произвольной. Стремление врача «облегчить и упростить» лечение (как для больного, так и для среднего медперсонала), назначая АП внутрь без учета конкретной клинической ситуации и фармакокинетики АП, может стать одной из причин недостаточного эффекта или вообще неэффективности лечения пневмонии. Не следует назначать АП внутрь при тяжелых пневмониях, особенно это касается препаратов с низкой биодоступностью (ампициллин, цефуроксим аксетил), не позволяющих достигать оптимальной концентрации АП в крови. В то же время у пациентов с внебольничной пневмонией легкого течения при отсутствии осложнений и тяжелой фоновой патологии допустима оральная АТ. В подобных ситуациях парентеральный путь введения АП оказывается не только необоснованным, но и более дорогостоящим. Между тем оральные формы некоторых АП в лечении внебольничных пневмоний используются недостаточно широко. Так, например, частота парентерального и перорального применения цефалоспориновых антибиотиков в России составляет 94,2 и 5,8% соответственно.
Оценка эффективности первоначального АП
Критическим сроком оценки эффективности АП считается 48—72 ч с момента его назначения. Обычно критерием эффективности АП является снижение или нормализация температуры тела больного, уменьшение признаков интоксикации. В тех случаях, когда лихорадка с самого начала заболевания не выражена или вообще отсутствует, приходится ориентироваться на другие признаки интоксикации (головная боль, анорексия, общемозговая симптоматика и т. д.), а также на отсутствие прогрессирования заболевания за период проводимого лечения.
К сожалению, нередко приходится сталкиваться с тем, что больной продолжает получать назначенный АП в течение недели и более, несмотря на отсутствие очевидного клинического эффекта. Продолжение АТ, несмотря на ее неэффективность, чревато множеством негативных последствий. При этом затягивается назначение другого, более адекватного АП, что способствует прогрессированию легочного воспаления (что особенно актуально при тяжелых пневмониях и у больных с сопутствующей патологией), развитию осложнений, удлинению сроков лечения. Кроме того, повышается риск возникновения побочных (токсических) эффектов АТ, развития антибиотикорезистентности. Не следует игнорировать и тот факт, что неэффективность, проводимой терапии влечет за собой утрату доверия к врачу больного, а также его родственников. Нельзя также сбрасывать со счетов и экономические затраты, связанные с неадекватным назначением АП (напрасный расход неэффективного АП, чересчур длительное пребывание больного в стационаре, дополнительные затраты на лечение токсических эффектов АП и др.).
Встречаются также ошибки, связанные не только с оценкой эффективности АТ, но и с заменой неэффективного АП на другой, то есть со сменой АП. При отсутствии данных микробиологического исследования принцип выбора АП остается прежним, то есть ориентироваться приходится на клиническую ситуацию с учетом неэффективности первоначального АП и других дополнительных признаков. Отсутствие эффекта от первоначального АП в известной степени должно служить дополнительным ориентиром для выбора второго АП. Так, например, отсутствие эффекта от b-лактамных АП (пенициллины, цефалоспорины) у пациента с внебольничной пневмонией позволяет предполагать наличие у него легионеллезной или микоплазменной пневмонии (с учетом, разумеется, других признаков). В свою очередь, это может рассматриваться как обоснование для назначения АП из группы макролидов (эритромицин, азитромицин, спирамицин, кларитромицин и др.) или фторхинолонов нового поколения (левофлоксацин, моксифлоксацин).
Комбинированная АТ
Сегодня, когда в распоряжении врачей имеется широкий арсенал АП, показания к комбинированной АТ значительно сужены и приоритет в АТ пневмоний остается за монотерапией. Основными показаниями к назначению комбинированной АТ являются тяжелое течение пневмонии, высокая вероятность смешанной флоры, наличие пневмонии на фоне выраженного иммунодефицита (злокачественные опухоли, лечение цитостатиками и иммунодепрессантами и др.). К сожалению, приходится сталкиваться с ситуациями, при которых больным с нетяжелым течением пневмонии, при отсутствии осложнений, тяжелой фоновой патологии назначается два АП. Назначение двух АП обычно аргументируется доводами, что каждый из АП имеет различных спектр действия и при этом имеется больше шансов быстрого достижения терапевтического эффекта в условиях эмпирической АТ.
Целесообразность комбинации макролидов с цефалоспоринами при лечении тяжелой пневмонии обусловлена вероятностью легионеллезной пневмонии и трудностями ее этиологической верификации. Показано, что летальность при внебольничных пневмониях, особенно среди больных пожилого возраста, ниже при назначении комбинированной терапии цефалоспоринами второго–третьего поколения в сочетании с макролидами по сравнению с монотерапией цефалоспоринами третьего поколения. Однако летальность при монотерапии современными респираторными фторхинолонами (левофлоксацин) оказывается также более низкой, чем при монотерапии цефалоспоринами третьего поколения.
Негативные стороны необоснованной комбинированной АТ заключаются в селекции множественных устойчивых штаммов микроорганизмов и возникновении суперинфекции, увеличении риска развития токсических эффектов вследствие того, что неблагоприятные воздействия препаратов суммируются, а также в повышении стоимости лечения. Особенно нежелательно комбинированное назначение АП, которые выводятся почечным путем, так как подобная терапия создает реальный риск нефротоксических эффектов. Более того, при нерациональных комбинациях возможно снижение эффективности терапии вследствие антагонизма АП. Примером нерациональных комбинаций могут служить такие фиксированные сочетания АП, как олететрин и тетраолеан (препараты в настоящее время практически не применяются), в которых макролид олеандомицин содержится в недостаточной дозе, а тетрациклин не может быть использован в большинстве случаев в качестве первоначального АП для лечения пневмоний. Недостаточная доза оксациллина и ампициллина, содержащаяся в комбинированном препарате ампиокс, не позволяет рекомендовать данный препарат при внебольничной пневмонии, в том числе и при подозрении на стафилококковую этиологию пневмонии.
Продолжительность АТ пневмонии
Основная цель АТ сводится прежде всего к эрадикации возбудителя или угнетению его дальнейшего роста, то есть к подавлению микробной агрессии. Длительность АТ может определяться многими факторами, в том числе этиологическим вариантом пневмонии, наличием осложнений и т. д.
В случаях неосложненного течения внебольничной пневмококковой пневмонии длительность АТ составляет 7—10 дней. Легионеллезная и микоплазменная пневмония требуют длительной АТ — до 3 недель, поскольку указанные этиологические агенты имеют внутриклеточную локализацию. При осложненных пневмониях, часто вызываемых стафилококком (легочная деструкция, эмпиема, абсцессы) длительность АТ также не должна составлять менее 3 недель.
Собственно воспалительная реакция легочной ткани, которая проявляется различными клинико-рентгенологическими признаками (аускультативная картина, сохраняющаяся рентгенологическая инфильтрация, ускорение величины СОЭ), регрессирует медленнее и не требует продолжения АТ. В связи с этим следует считать ошибочной тактику, в соответствии с которой больному с сохраняющимися рентгенологическими признаками легочной инфильтрации, крепитирующими хрипами (crepitacio redux), увеличением СОЭ при нормализации температуры тела и исчезновении (или уменьшении) признаков интоксикации продолжают проводить АТ. Еще более грубая ошибка — замена одного АП на другой в подобных ситуациях, которые врач квалифицирует как неэффективность первоначально назначенной АТ. У некоторых больных после исчезновения признаков интоксикации и даже регрессии воспалительных изменений в легких в течение длительного времени может сохраняться слабость, потливость, субфебрильная температура. Последняя нередко ошибочно расценивается врачом как проявление не полностью купированной бронхолегочной инфекции, что к тому же «подтверждается» рентгенологическими данными в виде изменения легочного рисунка или «остаточными явлениями пневмонии» и обычно влечет за собой продолжение АТ или дополнительное назначение АП, несмотря на отсутствие изменений со стороны крови. Между тем подобная клиническая ситуация часто обусловлена вегетативной дисфункцией после легочной инфекции (постинфекционная астения) и не требует АТ, хотя, разумеется, в каждом конкретном случае необходимы тщательное обследование больного и расшифровка всей имеющейся симптоматики. Необоснованно длительная АТ пневмоний повышает риск развития суперинфекции, микробной резистентности, побочных и токсических эффектов АП, а также увеличивает затраты на лечение. Ситуации с замедленным рентгенологическим разрешением пневмонии требуют особого рассмотрения.
Ступенчатая терапия
Неоправданно редко используется так называемая ступенчатая терапия, предусматривающая в качестве первого этапа парентеральное назначение АП, а в дальнейшем, после достижения клинического эффекта, переход на оральный путь введения того же АП. Такая возможность имеется при выборе АП, имеющих как парентеральную, так и оральную лекарственную форму. Исследования показали, что ступенчатая терапия не ухудшает результаты лечения пневмонии и прогноз заболевания. Очевидными преимуществами ступенчатой АТ являются обеспечение большей комфортности лечения, сокращение сроков госпитализации и возможность продолжения лечения в амбулаторных условиях, а также снижение затрат на лечение
Среди факторов, влияющих на эффективность ступенчатой АТ, можно назвать низкую биодоступность препарата, нарушение кишечного всасывания, риск невыполнения больным режима дозирования. Однако указанных недостатков в большинстве случаев можно избежать.
Основными требованиями к переходу с парентерального на оральный путь введения АП являются следующие:
Этим требованиям соответствуют многие имеющиеся в арсенале врача современные АП, в том числе макролиды (эритромицин, азитромицин), респираторные фторхинолоны (левофлоксацин, моксифлоксацин), что наряду с другими свойствами (спектр антимикробной активности, фармакокинетика, безопасность) позволяет считать рациональным их назначение при внебольничной пневмонии.
Предупреждение и контроль побочных и токсических эффектов
При назначении и проведении АТ пневмоний повышенное внимание следует уделять безопасности АП, в связи с чем следует учитывать многочисленные факторы (возраст, сопутствующая патология, прием других медикаментов и т. д.), определяющие тактику АТ. Неадекватная оценка особенностей данного больного влечет за собой развитие побочных токсических эффектов. Чаще всего ошибки могут встречаться в следующих ситуациях:
Беременным женщинам не следует назначать фторхинолоны, клиндамицин, метронидазол. Кроме того, с осторожностью должны применяться аминогликозиды, ванкомицин, имипенем.
Наличие сопутствующей патологии в ряде случаев создает сложности в проведении АТ, что может приводить и к ошибкам в выборе АП, его дозировки, путей введения, длительности АТ и т. д. В основе ошибок могут лежать либо невыявление сопутствующей патологии, либо ее недооценка в отношении токсического влияния АП, либо, наконец, недостаточное знание фармакокинетических особенностей выбранного АП. При наличии у больного почечной недостаточности следует отдавать предпочтение выбору АП с преимущественно внепочечным выведением (цефоперазон) или с двойным путем элиминации (ципрофлоксацин). Ошибочно назначение потенциально нефротоксичных АП (аминогликозиды, карбапенемы) без корректировки дозы у больных с сопутствующей почечной недостаточностью. Опасно также в подобных ситуациях применять сочетание АП, обладающих нефротоксическими свойствами (аминогликозиды и цефалоспорины, за исключением цефоперазона).
Особенно следует учитывать наличие сопутствующей, нередко множественной патологии с функциональными нарушениями органов и систем у больных пожилого и старческого возраста. Возрастное снижение показателей клубочковой фильтрации наряду с высокой частотой нефроангиосклероза у пожилых должно рассматриваться в качестве одного из факторов, влияющих на выбор АП, что, к сожалению, не всегда учитывается в клинической практике.
При наличии достоверно установленной гиперчувствительности к пенициллину ошибкой следует считать назначение других b-лактамных АП (цефалоспорины, карбапенемы). В качестве альтернативы АП могут назначаться фторхинолоны, макролиды. Однако следует иметь в виду, что нередко за аллергию на антибиотики принимают реакции другого происхождения (сосудистые, вегетативные и др.), в связи с чем следует критически оценивать указания больных на такую «непереносимость» и более тщательно анализировать имеющуюся ситуацию. Вместе с тем внутрикожные пробы на АП опасны, поскольку при этом существует такой же риск тяжелых анафилактических реакций.
Таким образом, ведение больного пневмонией требует от врача принятия ключевых решений с учетом имеющихся на сегодняшний день стандартов лечения и соответствующей коррекции назначенной АТ, в зависимости от клинической ситуации. Алгоритм ведения пациента с внебольничной пневмонией представлен на рисунке.
.gif)
.gif)
.gif)
.gif)
_575.gif)

 Читайте также:
Читайте также: