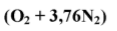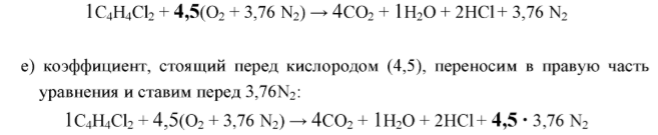Реакция горения как решать
Что такое горение: определение термина, реакция горения в химии
Содержание:
Горение – это физико-химический процесс, при котором превращение вещества сопровождается интенсивным выделением энергии и теплообменом с окружающей средой. Это древнейший процесс, которым человек пользуется каждый день.
Освоение огня сыграло огромную роль в развитии человеческой цивилизации. Огонь открыл людям возможность термической обработки пищи и обогрева жилищ, а впоследствии — развития металлургии, энергетики и создания новых, более совершенных инструментов и технологий. Управление процессами горения лежит в основе создания двигателей для автомобилей, самолетов, судов, ракет и т. д.
Примеры реакций горения простых веществ
простое вещество + О2 = оксид вещества.
Оксиды – это сложные вещества, в которых на втором месте всегда стоит кислород. Примерами оксидов служат углекислый газ СО2, угарный газ СО, оксид кальция СаО и т. д.
Не все простые вещества горят одинаково. Например, при горении магния образуются искры. Эту реакцию видел каждый, ведь она заложена в основе горения бенгальских огней.
Если поджечь железо, то никаких искр не будет. Для проведения данной реакции необходимо сильное нагревание металла.
Горение серы сопровождается синим пламенем и неприятным запахом. Раньше считалось, что пламя отпугивает различных духов.
Горение фосфора используется в военной промышленности для создания дымовой завесы. При съемках фильмов данная реакция используется для создания искусственного дыма.
Примеры реакций горения сложных веществ
Условия горения
Для осуществления реакции горения необходимо создать «треугольник огня».
Для предотвращения реакции горения этот треугольник необходимо нарушить. Например, чтобы кислород из воздуха не поступал в систему, ее необходимо накрыть покрывалом.
В зависимости от вещества применяют различные способы тушения. Иногда систему заливают водой или засыпают песком. Например, горящий бензин нельзя заливать водой, т.к. у бензина плотность меньше, чем у воды. Т.о., бензин находится на поверхности воды.
8.1. Реакции горения
Реакции горения описываются т.н. стехиометрическими уравнениями, характеризующими качественно и количественно вступающие в реакцию и образующиеся в результате ее вещества. Общее уравнение реакции горения любого углеводорода
Q — тепловой эффект реакции, или теплота сгорания.
Реакции горения некоторых газов приведены в табл. 8.1. Эти уравнения являются балансовыми, и по ним нельзя судить ни о скорости реакций, ни о механизме химических превращений.
Тепловой эффект (теплотой сгорания) Q — количество теплоты, выделяющееся при полном сгорании 1 кмоля, 1 кг или 1 м3 газа при нормальных физических условиях. Различают высшую Qв и низшую Qн теплоту сгорания: высшая теплота сгорания включает в себя теплоту конденсации водяных паров в процессе горения (в реальности при сжигании газа водяные пары не конденсируются, а удаляются вместе с другими продуктами сгорания). Обычно технические расчеты обычно ведут по низшей теплоте сгорания, без учета теплоты конденсации водяных паров (около 2400 кДж/кг).
КПД, рассчитанный по низшей теплоте сгорания, формально выше, но теплота конденсации водяных паров достаточно велика, и ее использование более чем целесообразно. Подтверждение этому — активное применение в отопительной технике контактных теплообменников, весьма разнообразных по конструкции.
Для смеси горючих газов высшая (и низшая) теплота сгорания газов определяется по соотношению
где r1, r2, …, rn — объемные (молярные, массовые) доли компонентов, входящих в смесь;
Q1, Q2, …, Qn — теплота сгорания компонентов
Воспользовавшись табл. 8.1, высшую и низшую теплоту сгорания, кДж/м3, сложного газа можно определять по следующим формулам:
где H2, CO, CH4 и т. д. — содержание отдельных составляющих в газовом топливе, об. %.
Интенсивность тепловыделения и рост температуры приводят к увеличению в реагирующей системе активных частиц. Такая взаимосвязь цепного реагирования и температуры, свойственная практически всем процессам горения, привела к введению понятия цепочечно-теплового взрыва — сами химические реакции горения имеют цепной характер, а их ускорение происходит за счет выделения теплоты и роста температуры в реагирующей системе.
Скорость химической реакции в однородной смеси пропорциональна произведению концентраций реагирующих веществ:
где С1 и С2 — концентрации реагирующих компонентов, кмоль/м3;
k —константа скорости реакции, зависящая от природы реагирующих веществ и температуры.
При сжигании газа концентрации реагирующих веществ можно условно считать неизменными, так как в зоне горения происходит непрерывный приток свежих компонентов однозначного состава.
Константа скорости реакции (по уравнению Аррениуса):
где К0 — предэкспоненциальный множитель, принимаемый для биометрических гомогенных смесей, ≈1,0;
Е — энергия активации, кДж/кмоль;
R— универсальная газовая постоянная, Дж/(кг•К);
Т — абсолютная температура, К (°С);
е — основание натуральных логарифмов.
Уравнение (8.6) показывает, что скорость химических реакций резко возрастает с увеличением температуры: например, повышение температуры с 500 до 1000 К влечет повышение скорости реакции горения в 2•104÷5•108 раз (в зависимости от энергии активации).
На скорость реакций горения влияет их цепной характер. Первоначально генерируемый реакцией атомы и радикалы вступают в соединения с исходными веществами и между собой, образуя конечные продукты и новые частицы, повторяющие ту же цепь реакций. Нарастающее генерирование таких частиц приводит к «разгону» химических реакций — фактически взрыву всей смеси.
Высокотемпературное горение углеводородов имеет весьма сложный характер и связано с образованием активных частиц в виде атомов и радикалов, а также промежуточных молекулярных соединений. В качестве примера приводятся реакции горения простейшего углеводорода — метана:
Правила составления уравнения реакции горения
Правило № 1.
В левой части уравнения записываем горючее вещество и воздух в виде:
Правило № 2.
В правой части уравнения записываем продукты реакции горения, учитывая, что:
Правило № 3.
Уравниваем реакцию горения для того, чтобы в исходных веществах и получившихся из них продуктах реакции содержалось одинаковое количество одинаковых атомов. При этом коэффициенты и индексы перемножаются:

Правило № 4.
Кислород, входящий в состав горючего вещества, например,
участвует в реакции горения, как и кислород воздуха, в качестве окислителя.




Добавить комментарий Отменить ответ
Для отправки комментария вам необходимо авторизоваться.
Реакции горения
Горение — быстропротекающая химическая реакция соединения горючих компонентов с кислородом, сопровождающаяся интенсивным выделением теплоты и резким повышением температуры продуктов сгорания. Реакции горения описываются т.н. стехиометрическими уравнениями, характеризующими качественно и количественно вступающие в реакцию и образующиеся в результате ее вещества. Общее уравнение реакции горения любого углеводорода
где m, n — число атомов углерода и водорода в молекуле; Q — тепловой эффект реакции, или теплота сгорания.
Реакции горения некоторых газов приведены в табл. 8.1. Эти уравнения являются балансовыми, и по ним нельзя судить ни о скорости реакций, ни о механизме химических превращений.
Тепловой эффект (теплотой сгорания) Q — количество теплоты, выделяющееся при полном сгорании 1 кмоля, 1 кг или 1 м3 газа при нормальных физических условиях. Различают высшую Qe и низшую Qн теплоту сгорания: высшая теплота сгорания включает в себя теплоту конденсации водяных паров в процессе горения (в реальности при сжигании газа водяные пары не конденсируются, а удаляются вместе с другими продуктами сгорания). Обычно технические расчеты обычно ведут по низшей теплоте сгорания, без учета теплоты конденсации водяных паров (около 2400 кДж/кг).
КПД, рассчитанный по низшей теплоте сгорания, формально выше, но теплота конденсации водяных паров достаточно велика, и ее использование более чем целесообразно. Подтверждение этому — активное применение в отопительной технике контактных теплообменников, весьма разнообразных по конструкции.
Таблица 8.1. Реакции горения и теплота сгорания сухих газов (при 0°С и 101,3 кПа)
CH4 + 2O2 = CO2 + 2H2O
C2H6 + 0,5O2 = 2CO2 + 3H2O
C3H + 5H2O = 3CO2 +4H2O
C4H,0 + 6,5O2 = 4CO2 + 5H2O
C4H,0 + 6,5O2 = 4CO2 + 5H2O
C5H,2 + 8O2 = 5CO2 + 6H2O
C3H6 + 4,5O2 = 3CO2 + 3H2O
C4H + 6O2 = 4CO2 + 4H2O
Для смеси горючих газов высшая (и низшая) теплота сгорания газов определяется по соотношению
Воспользовавшись табл. 8.1, высшую и низшую теплоту сгорания, кДж/м3, сложного газа можно определять по следующим формулам:
где H2, CO, CH4 и т. д. — содержание отдельных составляющих в газовом топливе, об. %.
Интенсивность тепловыделения и рост температуры приводят к увеличению в реагирующей системе активных частиц. Такая взаимосвязь цепного реагирования и температуры, свойственная практически всем процессам горения, привела к введению понятия цепочечно-теплового взрыва — сами химические реакции горения имеют цепной характер, а их ускорение происходит за счет выделения теплоты и роста температуры в реагирующей системе.
Скорость химической реакции в однородной смеси пропорциональна произведению концентраций реагирующих веществ:
где С1 и С2 — концентрации реагирующих компонентов, кмоль/м 3 ; к — константа скорости реакции, зависящая от природы реагирующих веществ и температуры.
При сжигании газа концентрации реагирующих веществ можно условно считать неизменными, так как в зоне горения происходит непрерывный приток свежих компонентов однозначного состава.
Константа скорости реакции (по уравнению Аррениуса):
где К0 — предэкспоненциальный множитель, принимаемый для биометрических гомогенных смесей, =1,0; Е — энергия активации, кДж/кмоль; R — универсальная газовая постоянная, Дж/ (кг*К); Т — абсолютная температура, К (°С); е — основание натуральных логарифмов.
Предэкспоненциальный множитель К0 можно истолковать как константу, отражающую полноту столкновения молекул, а Е — как минимальную энергию разрыва связей молекул и образования активных частиц, обеспечивающих эффективность столкновений. Для распространенных горючих смесей она укладывается в пределах (80÷150)•10 3 кДж/кмоль.
Уравнение (8.6) показывает, что скорость химических реакций резко возрастает с увеличением температуры: например, повышение температуры с 500 до 1000 К влечет повышение скорости реакции горения в 2·10 4 ÷5•10 8 раз (в зависимости от энергии активации).
На скорость реакций горения влияет их цепной характер. Первоначалаьно генерируемый реакцией атомы и радикалы вступают в соединения с исходными веществами и между собой, образуя конечные продукты и новые частицы, повторяющие ту же цепь реакций. Нарастающее генерирование таких частиц приводит к «разгону» химических реакций — фактически взрыву всей смеси.
Высокотемпературное горение углеводородов имеет весьма сложный характер и связано с образованием активных частиц в виде атомов и радикалов, а также промежуточных молекулярных соединений. В качестве примера приводятся реакции горения простейшего углеводорода — метана:
Горение и медленное окисление
I. Горение и медленное окисление
Горение – это первая химическая реакция, с которой познакомился человек. Огонь… Можно ли представить наше существование без огня? Он вошел в нашу жизнь, стал неотделим от нее. Без огня человек не сварит пищу, сталь, без него невозможно движение транспорта. Огонь стал нашим другом и союзником, символом славных дел, добрых свершений, памятью о минувшем.
Мемориал славы в г. Сыктывкаре
Пламя, огонь, как одно из проявлений реакции горения, имеет и свое монументальное отражение. Яркий пример – мемориал славы в г. Сыктывкаре.
Раз в четыре года в мире происходит событие, сопровождающееся переносом «живого» огня. В знак уважения к основателям олимпиад огонь доставляют из Греции. По традиции один из выдающихся спортсменов доставляет этот факел на главную арену олимпиады.
Об огне сложены сказки, легенды. В старину люди думали, что в огне живут маленькие ящерицы – духи огня. А были и такие, которые считали огонь божеством и строили в его честь храмы. Сотни лет горели в этих храмах, не угасая, светильники, посвященные богу огня. Поклонение огню было следствием незнания людьми процесса горения.
М.В.Ломоносов говорил: «Изучение природы огня и без химии предпринимать отнюдь невозможно».
Схематически этот процесс окисления можно выразить следующим образом:
Для возникновения горения необходимы:
нагревание горючего вещества до температуры воспламенения
Температура воспламенения у каждого вещества различна.
В то время как эфир может воспламениться от горячей проволоки, для того чтобы поджечь дрова, нужно нагреть их до нескольких сот градусов. Температура воспламенения веществ различна. Сера и дерево воспламеняются при температуре около 270 °С, уголь – около 350 °С, а белый фосфор – около 40 °С.
Однако не всякое окисление непременно должно сопровождаться появлением света.
Существует значительное число случаев окисления, которые мы не можем назвать процессами горения, ибо они протекают столь медленно, что остаются незаметными для наших органов чувств. Лишь по прошествии определенного, часто весьма продолжительного времени мы можем уловить продукты окисления. Так, например, обстоит дело при весьма медленном окислении ( ржавлении ) металлов
или при процессах гниения.
Разумеется, при медленном окислении выделяется теплота, но это выделение вследствие продолжительности процесса протекает медленно. Однако сгорит ли кусок дерева быстро или подвергнется медленному окислению на воздухе в течение многих лет, все равно – в обоих случаях при этом выделится одинаковое количество теплоты.
Медленное окисление – это процесс медленного взаимодействия веществ с кислородом с медленным выделением теплоты (энергии).
Примеры взаимодействия веществ с кислородом без выделения света : гниение навоза, листьев, прогоркание масла, окисление металлов (железные форсунки при длительном употреблении становятся тоньше и меньше), дыхание аэробных существ, т. е. дышащих кислородом, сопровождается выделением теплоты, образованием углекислого газа и воды.
Познакомимся с характеристикой процессов горения и медленного окисления приведённой в таблице.
Характеристика процессов горения и медленного окисления