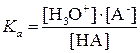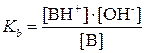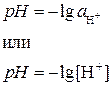Тип протолита как определить
Типы протолитов по Бренстеду и Лоури
| Тип протолита, определение | Примеры протолитов: | ||
| молекулярных | катионных | анионных | |
| Кислота – донор Н + | HCl | NH4 + | HSO4 – |
| Основание – акцептор Н + | NH3 | [Al(OH)(H2O)5] 2+ | HPO4 2– |
| Амфолит – вещество, которое может быть и донором, и акцептором Н + | H2O | [Al(OH)(H2O)5] 2+ | H2PO4 – |
Протолитическое равновесие – это взаимодействие кислоты и основания с образованием новой кислоты и нового основания. В нем может принимать участие растворитель-амфолит, например вода.
Сущность протолитического равновесия заключается в обратимом переносе протона Н + от кислоты к основанию:
В протолитическом равновесии всегда участвуют две сопряженные кислотно-оснóвные пары. В приведенном примере пара 1 состоит из кислоты НА и сопряженного с ней основания А, пара 2 – из кислоты НВ и основания В.
Силу кислотных и оснóвных свойств отдельных компонентов сопряженной пары оценивают с помощью константы кислотности Kа и константы основности Kb.
Константа кислотности – это константа равновесия:
Константа основности – это константа равновесия:
B + H2O « BH + + OH – Þ
В водном растворе константы кислотности и основности сопряженной кислотно-оснóвной пары связаны между собой через константу автопротолиза воды KW:
Если прологарифмировать формулу (3.1) с обратным знаком, то получим удобное для использования выражение:
Таким образом, чем сильнее кислота, тем слабее сопряженное с ней основание и наоборот. Например, НCl – сильная кислота, значит, ион Cl – является чрезвычайно слабым основанием.
Для водных растворов численные значения констант кислотности и основности (теория Бренстеда и Лоури) совпадают со значениями констант диссоциации (ионизации) (теория Аррениуса), поэтому можно пользоваться справочной литературой, составленной на основе классической теории. Для молекулярных кислот и оснований константы Kа и Kb, а также их отрицательные логарифмы рKa и рKb приведены в таблицах, для катионных и анионных протолитов эти значения рассчитываются по формулам (3.1) или (3.2).
Равновесия в водных растворах кислот, оснований и амфолитов. Расчет рН протолитических систем
Водородный показатель рН – это отрицательный логарифм активности или концентрации ионов Н + (ионов гидроксония Н3О + ):
Расчет численного значения рН проводят с точностью до сотых долей единицы рН, например рН = 6,15.
Рассмотрим наиболее распространенные случаи расчета рН.
Аналитическая химия OLD
4.1. Важнейшие теории кислот и оснований
Первая научная теория кислотности была предложена в 1780-х годах А. Лавуазье. Согласно данной теории все кислоты должны были обязательно содержать атом кислорода, что и было отражено в названии этого элемента.
В 1880-х годах С. Аррениус и В. Оствальд предложили ионную теорию кислот и оснований, согласно которой
Кислоты, основания и амфолиты могут быть как электронейтральными, так и иметь заряд.
Кислотно-основное взаимодействие заключается в обратимом переносе протона от кислоты к основанию. Кислоты и основания существуют как сопряжённые пары. В процессе взаимодействия друг с другом кислота и основание не исчезают, например, образуя соль, а превращаются в новое основание и новую кислоту.
Понятие «соль» в протолитической теории вообще не используется и, тем более, отсутствует понятие «гидролиз соли». Так, например, тот факт, что раствор NH4Cl имеет слабокислую среду, объясняется не гидролизом данной соли с образованием слабого электролита NH4OH и сильного электролита HCl, а тем, что катион аммония является слабой кислотой. Более того, никакого «слабого электролита » NH4OH на самом деле не существует (связь между атомами кислорода и азота не может быть ковалентной, так как азот не бывает пятивалентным).
Согласно теории Льюиса, названной электронной теорией кислот и оснований
Основания Брёнстеда и основания Льюиса представляют собой одни и те же соединения, понятие «кислота» согласно протолитической и электронной теориям отличается.
В аналитической химии преимущественно используется протолитическая теория. Это связано с тем, что теория Льюиса имеет слишком общий характер и её трудно применить для количественных расчётов.
4.2. Количественное описание силы кислот и оснований
Для количественной характеристики силы кислот, находящихся в растворе, используют константу, характеризующую способность кислоты отдавать протон молекуле растворителя, выступающей в качестве основания. Такая константа называется константой кислотности (Ka).
Активность растворителя не входит в выражение константы, так как считается равной 1.
Для водных растворов
Силу оснований можно описывать двояко: с помощью константы основности (Kb) либо с помощью константы кислотности сопряженной кислоты (KBH+ или Ka). В случае водных растворов данные константы описывают следующие равновесия: Константа основности в современной аналитической химии практически не применяется. Это связано с тем, что при использовании данной константы, приходится работать с активностью (или концентрацией) гидроксид-ионов, в то время как среду раствора принято описывать с помощью концентрации ионов водорода. Кроме того, при использовании константы кислотности сопряжённой кислоты все протолиты (и кислоты и основания) можно объединить в одну таблицу. Константа основности не несёт никакой новой информации, так как её легко рассчитать, зная величину константы кислотности сопряжённой кислоты.
Обозначения KBH + и Ka равнозначны между собой. Первый из них мы в дальнейшем будем использовать в тех случаях, когда речь идёт о характеристике силы основания через сопряжённую с ним кислоту. Это особенно удобно в случае сложных органических молекул, содержащих несколько кислотных и основных центров.
4.3. Влияние растворителя на кислотно-основные свойства растворённого вещества
Кислотно-основные свойства растворителя
Протонизированным называют атом водорода, связанный с атомом сильно электроотрицательного элемента и способный легко отщепляться от молекулы в виде протона (поэтому иногда его называют «подвижным»).
В зависимости от кислотно-основных свойств растворители бывают:
Протонные растворители могут относиться как к кислотным (уксусная кислота), так и к основным (аммиак) или амфотерным растворителям (вода). Одни из представителей полярных апротонных растворителей, например, диметилформамид, обладают основными свойствами, другие (кетоны, ацетонитрил, диметилсульфоксид), а также неполярные апротонные растворители вообще не склонны к реакциям кислотно-основного взаимодействия.
Автопротолиз растворителя. Константа автопротолиза
Рассмотрим реакцию кислотно-основного взаимодействия между двумя молекулами растворителя
Диэлектрической проницаемостью среды (ε) называют безразмерную величину, которая показывает, во сколько раз взаимодействие между двумя точечными электрическими зарядами в данной среде слабее, чем в вакууме.
Чем выше диэлектрическая проницаемость растворителя, тем лучше происходит диссоциация растворённого в нём электролита. Растворители, у которых ε > 15, называются полярными, а те, у которых ε автопротолиза будет небольшим. Диэлектрическая проницаемость растворителя оказывает влияние на константу кислотности (или основности) растворённого вещества. При уменьшении ε величины данных констант уменьшаются. Причём у заряженных частиц они изменяются менее сильно, чем у незаряженных.
4.4. Нивелирующее и дифференцирующее действие растворителя. Сильные и слабые кислоты и основания
У слабых кислот pKa > 4:
Уравнивание по силе кислот более сильных, чем ион лиония, и оснований более сильных, чем ион лиата, а также очень слабых кислот и оснований называется нивелирующим действием растворителя.
Не слишком сильные и не слишком слабые кислоты и основания можно практически различить по силе. Растворитель оказывает на них дифференцирующее действие (рис. 4.1).
Рис. 4.1. Значения pH 0,1 М кислот в воде
Способность растворителя оказывать нивелирующее или дифференцирующее действие зависит от:
Растворитель с сильными основными свойствами нивелирует силу кислот и дифференцирует силу оснований. Сильно кислотный растворитель, наоборот, дифференцирует силу кислот и нивелирует силу оснований.
Чем меньше величина константы автопротолиза растворителя, тем больше вероятность того, что он будет оказывать дифференцирующее действие на силу кислот и оснований (рис. 4.2).
Рис. 4.2. Константа автопротолиза растворителя и его дифференцирующее действие
4.5. Расчёт рН водных растворов различных протолитов
Водородным показателем (рН) называется отрицательный десятичный логарифм активности (или молярной концентрации) ионов водорода в растворе.
Для концентрированных растворов величины рН, рассчитанные через активность и молярную концентрацию, отличаются, поэтому для них иногда даже используют разные обозначения, соответственно, paH и pcH. Обозначение рН используется для экспериментально определяемой величины, которая в точности не соответствует ни paH ни pcH, но ближе к первой, чем ко второй.
Для характеристики кислотности и щёлочности водных растворов используется интервал рН от 0 до 14. В более кислых и более щелочных растворах понятие рН теряет смысл, так как активность и концентрация H3O + обычно значительно отличаются, причём еще и по-разному у различных веществ.
Растворы сильных кислот или сильных оснований
В водном растворе сильной кислоты имеются следующие протолитические равновесия:
В данном случае физический смысл имеет только один из корней полученного квадратного уравнения, так как концентрация не может быть отрицательной.
Аналогичные формулы можно получить и для сильных оснований.
Точный расчёт рН для последнего случая имеет чисто теоретический интерес, поскольку наличие в растворе даже незначительных количеств примесей (например, растворённого CO2) приведёт к заметно большему изменению рН, чем присутствие в растворе такого ничтожного количества HCl.
Растворы слабых кислот или слабых оснований
В водном растворе слабой кислоты, наряду с автопротолизом воды, имеется следующее протолитическое равновесие
Если кислота достаточно слабая (степень протолиза менее 5%), то можно принять, что [HA] ≈CHA. Если не учитывать автопротолиз воды,
Если степень протолиза превышает 5%
Степень протолиза кислоты зависит от её константы кислотности и концентрации в растворе:
Для 0,1 М CH3COOH pKa + lgCHA = 4,75 – 1 = 3,75 (α 5%)
В водном растворе слабого основания имеется следующее равновесие, описываемое константой основности
Для вывода формулы для расчёта рН раствора слабого основания рассмотрим взаимодействие кислоты, сопряжённой с рассматриваемым основанием, с водой. Такое равновесие описывается KBH +
Пример 4.2 Рассчитать рН 0,10 М CH3COOH (pKa = 4,76), 0,10 М CCl3COOH (pKa = 0,70, Ka = 0,20), 0,10 М NH4Cl (pKa(NH4 + )= 9,24) 0,10 М NH3 и 0,10 М CH3COONa
Смеси кислот или оснований и многопротонные протолиты
Пусть в растворе присутствуют две кислоты HA1 и HA2, имеющие константы кислотности, соответственно, Ka1 и Ka2.
Если степень протолиза кислот меньше 5%, то их равновесные концентрации можно заменить общими. Кроме того, если Ka[HA] >> KW, то автопротолиз воды можно не учитывать.
Для n слабых кислот Если произведение KaC для двух кислот значительно отличаются, то при расчёте рН влиянием той из них, для которой это произведение значительно меньше, можно пренебречь.
С учётом того, что для слабой кислоты
Если в растворе присутствуют два слабых основания, то уравнение электронейтральности (без учёта автопротолиза) имеет следующий вид
Растворы амфолитов
Пример 4.4. Рассчитать рН 0,10 М NaHCO3 и 0,10 М HCOONH4 4.6. Расчёт состава равновесных смесей протолитов при заданном значении рН
Рассмотрим двухосновную кислоту H2A.
Молярные доли частиц будут равны:
В общем виде формула для расчёта молярной доли частицы
имеет следующий вид
Для одноосновной кислоты
Если значения Ka для некоторой многоосновной кислоты отличаются друг от друга на 4 и более порядка, то можно считать, что при любом значении рН в равновесной смеси будут присутствовать только два вида частиц, а концентрация остальных пренебрежимо мала. Например, если необходимо рассчитать молярную долю молекул H3PO4 (pKa1 = 2,15; pKa2 = 7,21) при рН 3, то можно принять, что в равновесной смеси присутствуют только частицы H3PO4 и H2PO4-.Рассчёт можно провести по той же формуле, что и для одноосновной кислоты.
Рис. 4.3. Распределительная диаграмма для слабой кислоты (pKa = 5)
Пример 4.5. Рассчитать [NH3] в растворе с общей концентрацией аммиака 0,10 моль/л при рН 7,0.
4.7. Кислотно-основные буферные растворы
Кислотно-основные буферные растворы содержат (в не слишком малых количествах) слабые кислоты и сопряжённые с ними основания.
Причина буферного действия таких растворов заключается в следующем.
Формулу для расчёта рН буферного раствора можно получить следующим образом.
Разбавление, само собой, не может быть безграничным. При значительном разбавлении рН раствора изменится, так как, во-первых, концентрации компонентов станут такими малыми, что нельзя будет пренебречь автопротолизом воды, во-вторых, коэффициенты активности незаряженных и заряженных частиц по-разному зависят от ионной силы.
Пример 4.6. Рассчитать рН растворов, полученных 1) при смешивании 100 мл 0,10 М HCOOH и 200 мл 0,10 М HCOONа; 2) 200 мл 0,10 М NH3 и 100 мл 0,10 М HCl.
Вместо концентрации в уравнение Гендерсона-Хассельбаха могут быть подставлены количества кислоты и основания или объёмы их растворов (если концентрация растворённых веществ в последних одинакова)Способность буферного раствора сопротивляться изменению рН зависит от соотношения концентраций слабой кислоты и сопряжённого с ней основания, а также от их суммарной концентрации в растворе и характеризуется буферной ёмкостью.
Буферной ёмкостью (β или π) называют отношение бесконечно малого увеличения концентрации сильной кислоты или сильного основания в растворе (без изменения его объёма) к вызванному этим увеличением изменению рН. Буферную ёмкость раствора можно рассчитать по следующим уравнениям:
На рис. 4.4. приведён пример зависимости β от рН.
Тип протолита как определить
5. КИСЛОТНОСТЬ И ОСНОВНОСТЬ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
В настоящее время для оценки кислотности и основности соединений, в том числе и органических, применяют две теории: теория Бренстеда и теория Льюиса. Теория Бренстеда (1923 г.) является протолитической или протонной теорией кислот и оснований, а теория Льюиса (1925 г.) – апротонной или электронной теорией кислот и оснований.
КИСЛОТНОСТЬ И ОСНОВНОСТЬ ПО БРЕНСТЕДУ
Согласно теории Бренстеда, кислотой называют соединение, способное отдавать протон, т. е. кислота – донор протона, а основание – соединение, способное присоединять протон, т. е. основание является акцептором протона.
Теория Бренстеда называется протонной или протолитической теорией кислот и оснований, так как определения кислота и основание взаимосвязаны между собой процессом присоединения и отщепления протона.
Кислотно-основный процесс, согласно теории Бренстеда, может быть представлен следующей схемой:
Кислота А–Н, теряя протон, превращается при этом в основание АӨ, которое называется сопряженным основанием данной кислоты. Основание же В, присоединяя протон за счет неподеленной пары электронов, превращается в кислоту ВН+, которая является сопряженной данному основанию.
Таким образом, кислота А–Н и сопряженное основание АӨ, основание В и сопряженная кислота ВН+ образуют две сопряженные кислотно-основные пары.
Кислотность и основность соединений – понятия относительные. Эти два свойства неразрывно связаны между собой и проявляются одновременно, т. е. если одно соединение в данной реакции выступает в роли кислоты, то другое обязательно – в роли основания. Определенное соединение может быть кислотой по отношению к одному веществу и основанием по отношению к другому. Относительность этих понятии становится очевидной при рассмотрении конкретного примера.
Уксусная кислота, которая в воде проявляет кислотные свойства, в безводной серной кислоте ведет себя как основание.
Количественно силу кислот и оснований можно выразить с помощью константы равновесия данной реакции. Величину константы равновесия чаше всего определяют в водной среде. Для реакции:
Учитывая то, что вода в данной реакции выступает в роли растворителя, т. е. концентрация ее практически не изменяется (55,6 моль·л-1), концентрацией воды можно пренебречь. В данном случае константу равновесия называют константой кислотности или константой диссоциации К и выражают формулой:
Любая протолитическая реакция обратима и характеризуется константой диссоциации.
Большинство органических соединений, проявляющих кислотные свойства, в водной среде являются слабыми кислотами, константы которых выражаются малыми величинами. Например, Кa уксусной кислоты при 25°С равна 1,76·10-5. Оперировать такими малыми величинами в практической работе не удобно, поэтому используют значения рКa – показатель константы – отрицательный логарифм константы диссоциации: рКa = – lgKa (например: рКa для СН3СООН равняется 4,75).
Рассматривая зависимость между значениями величин Кa, рКa и силой кислоты, следует отметить одну закономерность: чем больше величина Кa (константа кислотности), тем сильнее кислота, чем больше величина рКa, тем кислота слабее.
Подобно кислотам силу оснований иногда выражают величиной Кb (константа основности), характеризующей легкость, с которой основание отрывает протон от воды:
Для удобства пользуются величиной рКb
При этом, чем меньше рКb, тем сильнее соответствующее основание. Однако намного удобнее выражать степень ионизации кислот и оснований в одной шкале (в шкале рКb) подобно тому, как значение рН одинаково хорошо характеризует и кислотность, и основность. Для основания величина рКa обычно означает кислотность сопряженной кислоты – протонной формы основания рК+вн. Сопряженная кислота в виде R–NH3 отдавая протон, превращается в основание R–NH4+.
Типы органических кислот
В зависимости от природы элемента, который связан с атомом водорода, кислоты разделяют на четыре основные группы:
Наряду с указанными типами кислот известны кислоты: Si-H, Р–Н, As–H, т. е. кислотой может быть любое соединение, содержащее связь А–Н и способное к отщеплению протона. Теория Бренстеда применима к любым типам кислот, способным к диссоциации с разрывом связи элемент–водород.
Кислотность соединений в основном определяется устойчивостью образующегося аниона, которая обусловлена делокализацией (распределением) отрицательного заряда.
Чем устойчивее сопряженное основание, тем сильнее кислота. Устойчивость аниона определяется следующими факторами: природой атома, связанного с атомом водорода (реакционный и кислотный центр); электронодонорными или электроноакцепторными свойствами заместителя, связанного с реакционным центром, и природой растворителя.
При равных других факторах устойчивость анионов, а следовательно, и кислотность возрастают с увеличением электроотрицательности и поляризуемости атомов кислотного центра. С увеличением электроотрицательности увеличивается сила, с которой атом может удержать пару электронов после отщепления водорода. Поскольку в пределах периода периодической системы электроотрицательность атомов возрастает слева направо (поляризуемость не меняется), то ОН-кислоты сильнее соответствующих NH-кислот, а те, в свою очередь, сильнее СН-кислот, например:
В пределах группы периодической системы электроотрицательность атомов уменьшается сверху вниз, но увеличивается их объем, а следовательно, возрастает поляризуемость, т. е. возможность делокализации внешнего электронного облака. Это способствует повышению стабильности аниона и приводит к возрастанию кислотности. Поэтому SH-кислоты обладают большей кислотностью, чем ОН-кислоты, например:
Наряду с природой кислотного центра и строением радикала, значительное влияние на проявление кислотных свойств оказывает растворитель. Наиболее эффективным растворителем является вода, она имеет высокую диэлектрическую постоянную и способна связывать катионы и анионы за счет сольватации. Эффект сольватации приводит к устойчивости образовавшегося аниона, а следовательно, кислотность соединений возрастает.
Типы органических оснований
Согласно теории Бренстеда, любое соединение, способное присоединять протон, может выступать в роли основания; это могут быть как нейтральные молекулы, так и заряженные частицы. В нейтральных молекулах для проявления основных свойств необходимо наличие атома с неподеленной парой электронов или наличие кратной связи. Основаниями могут быть анионы: алкоксид-ион ROӨ; алкилмеркаптид-ион RSӨ, карбанион R3CӨ (триалкилметанид-ион) и другие.
В n-основаниях центром основности, или центром протонирования (местом присоединения протона), чаше всего выступают такие элементы, как азот, кислород, сера. В зависимости от центра основности ониевые основания делятся на три основные группы:
Основность органических соединений в основном определяется устойчивостью образовавшегося катиона, которая обусловлена делокализацией положительного заряда.
На основность значительное влияние оказывает электроотрицательность и поляризуемость элементов, составляющих центр основности, электронодонорное или электроноакцепторное влияние радикала, связанного с центром основности, и природа растворителя.
Большая электроотрицательность атомов основного центра способствует более прочному удержанию им неподеленнои электронной пары, что характеризует меньшую основность соединения, иначе говоря. чем больше электроотрицательность атома, тем меньше основность. Таким образом, аммониевые основания проявляют более сильные основные свойства по сравнению с оксониевыми. Увеличение же поляризуемости атома приводит к уменьшению основности сопряженного основания и увеличению кислотности сопряженной кислоты. Поэтому сульфониевые основания слабее оксониевых.
Существенную роль в проявлении основных свойств играет растворитель. Эффект сольватации способствует устойчивости образовавшегося катиона, а следовательно, приводит к повышению основности.
КИСЛОТЫ И ОСНОВАНИЯ ЛЬЮИСА
Теория кислот и оснований Льюиса, в отличие от теории Бренстеда, является более обшей. Согласно этой теории основанием считается любая частица (атом, молекула или анион), способная отдавать электронную пару для образования ковалентной связи, а кислотой – любая частица (атом, молекула, катион), способная принимать пару электронов с образованием ковалентной связи.
То есть, по Льюису, основание является донором, а кислота – акцептором пары электронов. Из приведенного определения видно, что основания Льюиса тождественны основаниям Бренстеда. Однако кислоты Льюиса охватывают более широкий круг соединений.
Кислотой Льюиса считается любая частица, имеющая вакантную орбиталь.
Согласно теории Льюиса, к кислотам относятся не только соединения, отщепляющие протон (протонные кислоты), но и другие вещества, имеющие вакантную орбиталь и способные принимать пару электронов (апротонные кислоты). Кислотами Льюиса, например, являются такие соединения, как BF4, AlC13, FeCl3, SbCl3, ZnCl2, HgCl3 и др.
Кислотно-основный процесс по Льюису состоит в образовании ковалентнои связи между основанием и кислотой за счет электронной пары основания и вакантной орбитали кислоты. Так, основания Льюиса, имеющие неподеленные пары электронов, образуют с кислотами Льюиса n-комплексы:
Легкость протекания кислотно-основного взаимодействия по Льюису определяется силой кислоты и основания.